黏液型铜绿假单胞菌刺激淋巴细胞过度产生IL-6与难愈性感染的潜在联系
宋立?刘鹏?宋明强?薄金双?张荣明

【摘要】目的 評价非黏液型铜绿假单胞菌与黏液型铜绿假单胞菌刺激淋巴细胞分泌相关细胞因子IL-6的差异。方法 培养2种类型的铜绿假单胞菌,采用革兰染色后观察细菌形态,用质谱分析鉴定菌型,将所获的非黏液型铜绿假单胞菌与黏液型铜绿假单胞菌菌株分别与淋巴细胞共培养,分别设为非黏液型铜绿假单胞菌+淋巴细胞组与黏液型铜绿假单胞菌+淋巴细胞组,再设加入磷酸盐缓冲液(PBS)组为对照组,即PBS+淋巴细胞组。采用流式法分析观察淋巴细胞、中性粒细胞于6、24、48 h细胞因子分泌情况。结果 培养所得的非黏液型铜绿假单胞菌与黏液型铜绿假单胞菌细菌形态完好;非黏液型铜绿假单胞菌+淋巴细胞组及PBS+淋巴细胞组的上清液中几乎检测不到IL-6,而黏液型铜绿假单胞菌+淋巴细胞组可见大量IL-6分泌(P < 0.05);相对于PBS+淋巴细胞组,非黏液型铜绿假单胞菌+淋巴细胞组与黏液型铜绿假单胞菌+淋巴细胞组均可分泌TNF-α,组间差异无统计学意义(P > 0.05)。结论 黏液型铜绿假单胞菌刺激了淋巴细胞分泌大量的炎性因子IL-6,非黏液型铜绿假单胞菌无此特点;基于IL-6具有促进该类细菌增殖的特性,这可能是临床上黏液型铜绿假单胞菌感染难愈性的一个潜在机制。
【关键词】铜绿假单胞菌;白介素-6;肿瘤坏死因子α;难愈性感染
Potential association between mucoid Pseudomonas aeruginosa-stimulated excessive serection of IL-6 by lymphocytes and chronic refractory infection Song Li, Liu Peng, Song Mingqiang, Bo Jinshuang, Zhang Rongming. Department of Burn and Plastic Surgery,the First Affiliated Hospital of Jinzhou Medical University, Jinzhou 121000, China
Corresponding author,Zhang Rongming, E-mail: zrm99999@126.com
【Abstract】Objective To evaluate the differences of IL-6 secreted by lymphocytes stimulated by mucoid and non-mucoid Pseudomonas aeruginosa. Methods Two types of Pseudomonas aeruginosa were cultured. The morphology of the bacteria was observed by Gram staining.The bacterial type was identified by Mass spectrometry. The mucoid and non-mucoid Pseudomonas aeruginosa strains were co-cultured with lymphocytes and assigned into the mucoid and mucoid Pseudomonas aeruginosa+lymphocyte and non-mucoid Pseudomonas aeruginosa+lymphocyte groups. Phosphate buffer solution (PBS) was used in the control group (PBS+lymphocyte group). The cytokine secretion of lymphocytes and neutrophils was observed at 6 h, 24 h and 48 h was observed by flow cytometry. Results The mucoid and non-mucoid Pseudomonas aeruginosa strains were observed in intact morphology. Almost no or only a slight amount of IL-6 production was noted in the non-mucoid Pseudomonas aeruginosa+ lymphocyte group and PBS+ lymphocyte group, whereas a large quantity of IL-6 was observed in the mucoid Pseudomonas aeruginosa+ lymphocyte group (both P < 0.05). Compared with the PBS+ lymphocyte group, TNF-αwas secreted in the other two groups. No significant difference was seen between two groups (P > 0.05). Conclusions Mucoid Pseudomonas aeruginosa rather than non-mucoid Pseudomonas aeruginosa can stimulate excessive secretion of IL-6 by lymphocytes, which may be a specific mechanism underlying the chronic refractory infection of mucoid Pseudomonas aeruginosa based on the fact that excessive IL-6 can promote the proliferation of this type of bacteria.
【Key words】Pseudomonas aeruginosa;Interleukin-6;Tumor necrosis factor-ɑ;
Chronic refractory infection
铜绿假单胞菌是一类极易引起医院感染尤其是ICU获得性感染并造成不良临床结局的常见致病菌之一[1-3]。铜绿假单胞菌可分为非黏液型和黏液型。该菌具备固有形成细菌生物膜的特性,可通过生物膜逃避宿主的免疫杀伤及抗菌药物的作用,是极易引起难愈性感染的重要病原菌[4-5]。除此之外,细菌感染还能够刺激机体细胞分泌大量炎性因子,诸如IL-6、TNF-α、IL-1β等,有研究表明,某些炎性因子如IL-6,虽然在感染早期适量分泌有益于控制感染,但在感染后期高浓度的IL-6又可促进铜绿假单胞菌的生长[6-7]。一旦达到级联式瀑布样释放则可导致炎症反应失控,造成临床慢性迁延性重症感染。此前,我们曾研究了在感染早期作为抗感染前沿防线的中性粒细胞与铜绿假单胞菌共培养后炎性因子的分泌情况,发现其仅能分泌低量的IL-6(< 100 pg/ml),此浓度不足以刺激铜绿假单胞菌的增殖生长。为此我们考虑,在感染后期中性粒细胞数目下降,参与特异性免疫反应的淋巴细胞、单核-巨噬细胞是否会通过IL-6调控免疫反应及促进铜绿假单胞菌的增殖生长?在此过程中是全部菌型还是某个菌型更为重要?为解答这个问题,我们开展了此项实验研究,意在揭示淋巴细胞、单核-巨噬细胞是否通过IL-6参与对黏液型铜绿假单胞菌的免疫反应。
材料与方法
一、实验菌株
非黏液型铜绿假单胞菌和黏液型铜绿假单胞菌菌株均由山东省威海市立医院中心实验室提供。非黏液型铜绿假单胞菌为ATCC27853,黏液型铜绿假单胞菌来自我院烧伤病例感染创面标本。
二、主要仪器与试剂
高速离心机[北京白洋(BYG20)];二氧化碳培养箱[美国ThermoFisher 公司(150i)];倒置荧光显微镜[日本尼康(Nikon Ti-S)];质谱仪[德国布鲁克公司 MALDI BIOTYPER];流式细胞仪(AriaⅡ)[美国BD公司];人Th1/Th2/Th17试剂盒购[美国BD公司];1640培养液[美国Gibco公司],胎牛血清[美国HyClone公司]。
三、方 法
1.铜绿假单胞菌培养与镜检
将非黏液型铜绿假单胞菌和黏液型铜绿假单胞菌用划线法接种于哥伦比亚血琼脂平板上培养,待菌落形成后,取清洁、干燥载玻片,加一滴无菌生理盐水于玻片,用接种环挑取哥伦比亚血琼脂平板上非黏液型铜绿假单胞菌菌落于载玻片上进行涂片固定;采用贝索快速革兰染色液进行革兰染色,再用龙胆紫液染色10 s后水洗甩干;用碘溶液染色10 s后水洗甩干,用脱色液脱色10 ~ 20 s后水洗甩干,用沙黄溶液复染10 s后水洗,用吸水纸吸干水分,于镜下观察制备好的非黏液型铜绿假单胞菌。采用同样方法制备黏液型铜绿假单胞菌,染色后于镜下观察。
2.细菌质谱鉴定
用无菌接种环在生物安全柜中挑取哥伦比亚血琼脂平板上单个非黏液型铜绿假单胞菌菌落于质谱板中涂匀,干燥后加70%甲酸1 μl, 于37℃烘箱晾干,加入质谱基质1 μl,采用质谱仪进行菌种鉴定。用同样方法处理黏液型铜绿假单胞菌。
3.检测标本的制备
取成人健康志愿者外周血10 ml,采用密度梯
度离心法分离淋巴细胞;将淋巴细胞按1.0×106个/孔
的密度接种于6孔板,在孵箱(37℃,5%二氧化碳)中培養2 h。取新培养的非黏液型铜绿假单胞菌和黏液型铜绿假单胞菌,分别制成悬液,测定吸光度(OD600)并计算菌体浓度,按细胞与细菌比值为1∶5接种菌体于细胞的培养体系中。分别设为非黏液型铜绿假单胞菌+淋巴细胞组(非黏液型组)与黏液型铜绿假单胞菌+淋巴细胞组(黏液型组),并设置加入磷酸盐缓冲液(PBS)组为对照组,即PBS+淋巴细胞组。将加入菌液的细胞分别培养12、24、48 h后,1000转/分离心5 min后收集上清液,等待流式细胞仪进行细胞因子检测。
4.细胞因子检测
实验步骤严格按照人Th1/Th2/Th17试剂盒说明书进行。首先涡旋混匀,混合好捕获微球,向每个实验管中各加入50 μl,标准管中加入按说明稀释好的PBS溶液50 μl,样本管中分别加入稀释好的非黏液型铜绿假单胞菌和黏液型铜绿假单胞菌样本液。再向所有实验管中加入50 μl人Th1/Th2 PE检测试剂,将所有实验管室温避光孵育3 h。将仪器条件设置完毕后,每组试验管中加入1 ml洗液,200转/分离心5 min,小心吸去上清液,每管加入300 μl洗液,重悬微球后上机检测。
四、统计学处理
采用SPSS 18.0处理数据,细胞因子浓度以表示,3组间比较采用方差分析,两两比较采用LSD-t检验,P < 0.05为差异有统计学意义。
结果
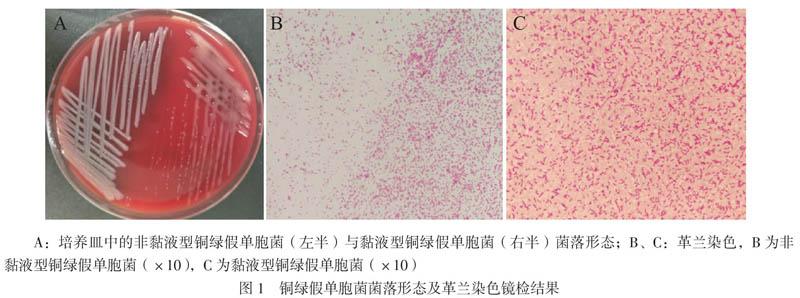
一、铜绿假单胞菌菌落形态及革兰染色镜检结果
培养皿中可见非黏液型铜绿假单胞菌菌落呈光滑、微隆起、边缘清晰的均匀菌落,菌落表面呈现金属光泽。黏液型铜绿假单胞菌菌落形态呈浑浊胶冻样,菌落间融合,边缘不清晰。镜下观察,非黏液型铜绿假单胞菌呈两端钝圆、单一细胞散点生长,大小约(1 ~ 2)μm×(0.5 ~ 0.7)μm,
无芽孢;黏液型铜绿假单胞菌呈短柄状、成对或偶有成链生长,大小约(1 ~ 3)μm×(0.7 ~ 1.0)μm,无芽孢(图1)。
二、质谱鉴定结果
经质谱分析,非黏液型铜绿假单胞菌和黏液型铜绿假单胞菌质谱结果显示其波形图均符合铜绿假单胞菌特征,鉴定结果符合实验标准(图2)。
三、细胞因子分泌情况
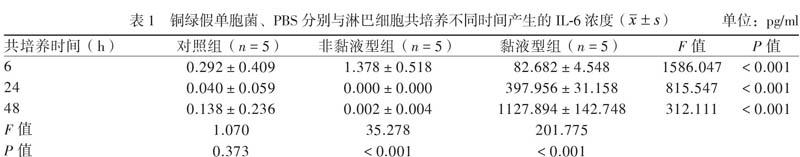
通过流式法分析淋巴细胞分泌细胞因子情况,可以看出黏液型组与非黏液型组和对照组有明显差异(图3)。黏液型组(图3C) 与非黏液型组(图3B)均可见TNF-α分泌(自上到下顺序,色带5),差异无统计学意义(P > 0.05)。黏液型组显著分泌IL-6(色带3),且随培养时间的推移,分泌升高;而非黏液型组(图3B)与对照组(图3A)类似,几乎无IL-6分泌,5次试验各组测定均值见表1。
讨论
铜绿假单胞菌诱导淋巴细胞过度分泌IL-6的是黏液型铜绿假单胞菌,而并非为非黏液型铜绿假单胞菌。早在2010年Ciornei等对细菌在生物膜中的生长是否触发特异性免疫的研究显示,相对铜绿假单胞菌浮游菌,其生物膜形成菌型能够刺激机体产生更多的IL-6[7]。而IL-6是判断细菌生物膜形成和慢性重症感染仅有的几种检测意义显著且属常规检测的细胞因子之一,并被用于脓毒症干预试验[8]。体内外研究显示,过多的IL-6能促进细菌增殖,这意味着除了感染初期天然免疫导致的中性粒细胞或巨噬细胞等分泌IL-6之外,应该还有导致IL-6持续合成与分泌的机制。已有研究证实,IL-6是由TNF和IL-1的原代细胞因子直接诱导的。IL-6在机体受感染刺激后迅速出现,2 h内其水平可达到峰值,在血流中的持续时间比TNF和IL-1长得多[9]。早期分泌的IL-6对炎症和免疫反应的作用是多效的,其可迅速诱导体内产生大量的急性期活性蛋白和促进淋巴细胞特异性分化,在天然免疫应答与获得性免疫应答中发挥重要作用,这些机制也导致了IL-6的持续合成[10]。我们的研究显示,在铜绿假单胞菌与淋巴细胞共培养的体系中,非黏液型组与对照组仅产生极其微量或近于不产生IL-6,而黏液型组在相同的培养条件下却产生了大量的IL-6,这证实了铜绿假单胞菌可以刺激淋巴细胞大量分泌IL-6,但产生此作用的是黏液型铜绿假单胞菌。有研究显示在鉴别脓毒症和非感染性SIRS时,IL-6的最佳切点为500 pg/ml,一旦超过该切点,则意味着体内已有脓毒症和慢性生物膜感染存在的可能[11]。我国田素飞等(2007年)的研究同样提示在体系中的IL-6水平为100 pg/ml以下时,无论是6 h或8 h甚至更长时间,细菌均无太大幅度的增殖,而在IL-6水平达到500 pg/ml时细菌的增殖幅度则骤升。而且,随着IL-6浓度的增加和时间的推移,在IL-6水平接近或达到500 pg/ml以后,细菌增殖幅度可能更显著,加大对淋巴细胞的刺激能力,形成恶性刺激循环。
黏液型铜绿假单胞菌较非黏液型铜绿假单胞菌具有更大免疫刺激作用的原因在于前者可产生大量的藻酸盐而更易形成生物膜。在固体培养基上观察到藻酸盐的过量产生形成的体外表型正是铜绿假单胞菌的黏液型表现[12]。既往我们对宿主免疫反应的大部分知识来自于浮游病原体,而对生物膜病原体的特异性免疫反应研究较少,唯一肯定的区别是后者菌体较难被清除,使生物膜感染成为慢性感染的主要原因[13]。黏液型铜绿假单胞菌较易产生生物膜,生物膜是产生大的免疫刺激作用的物质基础,它提供了一个非常集中的稳定的病原体相关分子模式(铜绿假单胞菌黏多糖)来源,包括DNA、脂多糖和胞外多糖。这些生物膜的胞外物质可以有效刺激中性粒细胞和巨噬细胞,而不必直接接触细菌细胞[14-15]。另有研究者证实了铜绿假单胞菌生物膜基质外细胞DNA也是重要的免疫刺激因素和主要的促炎成分[15]。他们通过运用脱氧核糖核酸酶Ⅰ降解基质细胞外DNA,明显降低了铜绿假单胞菌生物膜诱导中性粒细胞促炎细胞因子IL-8和IL-1b的释放能力(> 75%),而IL-1可通过激活IL-6核转录因子刺激炎症细胞合成和释放IL-6;减少了中性粒细胞活化标记CD18、CD11b和CD66b的上調;降低了每个接触生物膜的中性粒细胞吞噬细菌的数量。因此生物膜参与了诱导中性粒细胞促炎细胞因子的释放能力。我们认为,作为形成铜绿假单胞菌生物膜起因的黏液型铜绿假单胞菌是导致铜绿假单胞菌具有更大免疫刺激作用的菌型。
IL-6的过度分泌是难愈性感染的表现特征或潜在的发生机制,早已有研究者发现IL-6与慢性重症感染的严重程度及预后密切相关,故将其纳入了重症感染或脓毒症的临床评级与预测[17-19]。进一步的研究也显示在重症感染得到控制后,患者的IL-6水平显著下降[20]。高水平的IL-6可显著提高细菌的增殖能力,这使感染更难被控制,成为难愈性感染的可能发生机制[5-7]。细菌如何利用细胞因子来促进自身的增殖,目前尚未明确其机制。细菌是原核生物,缺乏明确的细胞核,而细胞因子主要作用于有明确细胞核的真核细胞,继而可通过信号转导事件调控基因转录完成细胞的增殖与分化。不过,有研究者曾在金黄色葡萄球菌表面鉴定出IL-1β受体,并发现其中的208 ~ 240肽片段对金黄色葡萄球菌生长的影响最为显著,与对照组(牛血清白蛋白)相比,该肽片段可使金黄色葡萄球菌的生长速度提高约22倍[21]。因此,可能是细菌细胞膜通过受体介导的信号转导诱导了激活过程,作用于细菌特定的基因转录和翻译,产生了促进细菌增殖的作用。
总之,本研究结果显示,是黏液型铜绿假单胞菌促进了淋巴细胞产生过多的IL-6,从而可能刺激了细菌的生长。据此我们认为,这可能是铜绿假单胞菌引起慢性难愈性感染的重要原因。但在临床实践中,细菌这种“适量抑菌-过量促菌”的双向作用的根本原因可能在于感染后期细菌生物膜的形成,形成了“细菌感染-生物膜形成-细胞因子生成增多-促进细菌再增殖”的恶性循环,切断这一恶性过程的重要措施是设法消除生物膜的形成[22]。
参 考 文 献
[1] Huszczynski SM, Lam JS , Khursigara CM. The role of pseu-domonas aeruginosa lipopolysaccharide in bacterial pathogenesis and physiology. Pathogens, 2020,9(6):1-22.
[2] Pestrak MJ, Chaney SB, Eggleston HC,Nolan SD, Dixit S, Mathew-Steiner SS, Roy S, Parsek MR, Sen CK, Wozniak,DJ. Pseudomonas aeruginosa rugose small-colony variants evade host clearance, are hyper-inflammatory, and persist in multiple host environment. Plos Pathogens, 2018, 14(2):e1006842.
[3] 張婧,郎欣月,毛莹雪,陈婷婷,杨淑君,赵卫. ICU获得性感染细菌谱及耐药分布. 新医学,2018,49(5):359-363.
[4] Lee K,Yoon SS. Pseudomonas aeruginosa biofilm, a pro-grammed bacterial life for fitness. J Microbiol Biotechnol,2017,27(6):1053-1064.
[5] Watters C, DeLeon K, Trivedi U, Griswold JA, Lyte M, Hampel KJ, Wargo MJ, Rumbaugh KP. Pseudomonas aeruginosa biofilms perturb wound resolution and anti- biotic tolerance in diabetic mice. Med Microbiol Immunol(Berl), 2013,202(2):131-141.
[6] 田素飞,蔡日丹,褚云卓,陈佰义. TNF-α、IL-1β、IL-6促进细菌生长的体外研究.中国感染与化疗杂志, 2007,7(5):344-347.
[7] Ciornei CD, Novikov A, Beloin C, Fitting C, Caroff M, Ghigo JM, Cavaillon JM, Conquy MA. Biofilm- forming Pseudomonas aeruginosa bacteria undergo lipopolysaccharide structural modifications and induce enhanced cytokine response in human monocytes. Innate Immun, 2010,16(5):288-301.
[8] Gentile LF, Cuenca AG, Vanzant EL, Efron PA, McKinley B, Moore F, Moldawer LL. Is there value in plasma cytokine measurements in patients with severe trauma and sepsis? Methods, 2013,61(1):3-9.
[9] Song M, Kellum JA. Interleukin-6. Crit Care Med,2005,33(Suppl):S463-S465.
[10] Tanaka T, Narazaki M, Kishimoto T. IL-6 in inflammation, immunity, and disease. Cold Spring Harb Perspect Biol,2014,6(10):a016295.
[11] Oberhoffer M, Russwurm S, Bredle D, Chatzinicolaou K,Reinhartet K. Discriminative power of inflammatory markers for prediction of tumor necrosis factor-alpha and interleukin-6 in ICU patients with systemic inflammatory response syndrome (SIRS) or sepsis at arbitrary time points. Intensive Care Med,2000,26(Suppl 2):S170-S174.
[12] Damron FH, Goldberg JB. Proteolytic regulation of alginate overproduction in Pseudomonas aeruginosa. Molecular Micro-biology, 2012,84:595-607.
[13] González JF, Hahn MM, Gunn JS. Chronic biofilm-based infections: skewing of the immune response. Pathog Dis,2018,76(3):fty023.
[14] Ciszek-Lenda M, Strus M, Walczewska M, Majka G, Machul-?wirbla A, Miko?ajczyk D, Górska S, Gamian A, Chain B, Marcinkiewicz J. Pseudomonas aeruginosa biofilm is a potent inducer of phagocyte hyperinflammation. Inflamm Res,2019,68:397-413.
[15] Kruger P, Saffarzadeh M, Weber ANR, Rieber N, Radsak M, Bernuth HV, Benarafa C, Roos D, Skokowa J, Hartl D. Neutrophils: between host defence, immune modulation, and tissue injury. PLoS Pathog, 2015,11(3):e1004651.
[16] Fuxman Bass JI, Russo DM, Gabelloni ML, Geffner JR, Gior-dano M, Catalano M, Zorreguieta A, Trevani AS. Extracellular DNA: a major proinflammatory component of Pseudomonas aeruginosa biofifilms. J Immunol, 2010, 184:6386-6395.
[17] Mokart D,Merlin M,Sannini A, Brun JP, Delpero JR, Houvenaeghel G, Moutardier V, Blache JL. Procalcition, interleukin 6 and systemic inflammatory response syndrome(SIRS):early markers of postoperative sepsis after major surgery. Br J Anaesth,2005,94(6):767-773.
[18] Volante E,Moretti S, Pisani F, Bevilacqua G. Early dianosis of bacterial infection in the neonate. J Matern Fatal Neonatal Med, 2004,16(2):13-16.
[19] Miguel-Bayarri V, Casanoves-Laparra EB, Pallás Beneyto L, Sancho-Chinesta S, Martín-Osorio LF, Tormo-Calandín C, Bautista-Rentero D. Prognostic value of the biomarkers procalcitonin, interleukin-6 and C-reactive protein in severe sepsis. Med Intensiva,2012,36:556-562.
[20] Tschaikowsky K, Hedwig-Geissing M, Braun GG, Radespiel-Troeger M. Predictive value of procalcitonin, interleukin-6, and C-reactive protein for survival in postoperative patients with severe sepsis. J Crit Care, 2011,26:54-64.
[21] Umberto Meduri G. Clinical review: a paradigm shift: the bidirectional effect of inflammation on bacterial growth. Clinical implications for patients with acute respiratory distress syndrome.Critical Care, 2002 ,6 (1):24-29.
[22] Verderosa AD, Makrina Totsika M, Fairfull-Smith KE. Bacterial biofilm eradication agents: a current review. Front Chem, 2019,7(Article 824):1-17.
(收稿日期:2020-04-18)
(本文編辑:洪悦民)

