灵武长枣成熟过程中硬度变化的生物力学研究
吴宝婷,王娟,邱雪,朱韵昇,张海红
(宁夏大学食品与葡萄酒学院,宁夏 银川 750021)
灵武长枣具有质脆肉丰、色泽诱人、营养丰富以及鲜食品质极佳的特点,是宁夏地区优良的特色鲜食枣种,深受消费者欢迎。由于长枣的生理特性,不同成熟度果实品质差异较大,对应的储藏条件也有所不同,不适当的贮藏会导致果品过早腐烂变质,严重影响和制约了长枣产业的发展[1]。果实硬度是果实宏观品质中重要的评价参数[2]。果实硬度随着果实成熟过程中细胞壁结构与组成(多糖组分、相关酶)的变化而发生变化。果实细胞壁是维持细胞形状、增加细胞机械强度、控制细胞生长和水分运输的重要结构。细胞壁刚度受到果实成熟过程中多糖累积程度和细胞内渗透作用的影响[3-4]。目前,关于果实微观力学的研究方法主要有BLEWETT等[6]的微压缩方法、HILLER等[7]的微穿刺方法以及ROUTIER等[8]的微压痕方法。其中,纳米微压痕试验具有样品要求低以及适用范围广的特点,近年来在生命科学和食品科学等领域得到了广泛应用。本研究基于原子力显微镜(atomic force microscope,AFM)的纳米微压痕试验,通过改变探针的载荷速率,即探针与样品的作用时间,获得不同载荷速率下探针的动力学变化力曲线,从而获得样品的杨氏模量。PÉREZ等[9]使用原子力显微镜研究了苹果组织在分离细胞中的杨氏模量分布范围,结果表明从苹果分离得到的细胞的杨氏模量平均值为(0.63±0.42)MPa,而苹果组织的杨氏模量为(0.86±0.81)MPa。ZDUNEK等[10]用原子力显微镜研究了梨采收前后果实细胞壁杨氏模量分布范围。XIAO等[11]利用原子力显微镜对洋葱表皮组织细胞进行纳米微压痕试验,发现果胶和纤维素网络对洋葱表皮细胞的细胞壁力学性质影响较大。
本研究分析了不同成熟度的灵武长枣的硬度随细胞壁中的多糖(原果胶、可溶性果胶)以及细胞壁中的果胶甲酯酶(pectin methylesterase,PME)、多聚半乳糖醛酸酶(polygalacturonase,PG)和β-半乳糖苷酶(β-galactosidase,β-Gal)的变化规律,研究了硬度与细胞壁杨氏模量之间的关联性,从生物学和微观力学角度解析灵武长枣成熟过程中果实品质变化的原因,为不同成熟度灵武长枣储藏保鲜提供理论依据和指导性建议。
1 材料与方法
1.1 材料与处理
供试样品采摘自宁夏灵武市大泉林场枣园,选择生长状况良好的同株果树上的灵武长枣果实,树龄为5 a。采收时间在花后60~65 d,果实要求外形完好、无病虫害、无机械损伤以及大小均一,单果质量约20 g。按果实表面绿色面积占长枣总面积进行分级。当绿色面积占枣果总面积的50%定义为50%成熟度,以此类推共分为50%、60%、70%、80%、90%和100%共6种成熟度。根据分级要求分为6组进行试验,每组10个样品,采摘后立即放入低温冷冻箱内进行运输,运输过程避免造成机械损伤[12]。
根据RENARD等[13]的方法从薄壁组织中分离出醇不溶性残留物作为细胞壁材料。将果肉置于无水乙醇中煮沸后冷却,再与无水乙醇混合后用尼龙过滤器过滤,至苯酚-硫酸法检测为阴性后,再将样品用在质量分数96%的乙醇和丙酮混合液中洗涤2次后干燥。
1.2 仪器与设备
TAXT PLUS/50 物性测定仪,英国Stable Micro system公司;原子力显微镜(PicoPlus) ,美国Agilent公司;Si3N4锥形探针(PSA400弹性系数0.35 N·m-1),日本Olympus公司。
1.3 测定指标
1.3.1 硬度 物性测定仪在TPA模式下,利用P/2n针状探头,在整枣赤道部位均匀取3点进行测试。设置测前速度5 mm·s-1,贯入速度1 mm·s-1,测后速度5 mm·s-1,最小感知力5 g,穿刺深度5 mm[14]。
1.3.2 可溶性果胶和原果胶测定 参照曹建康等[15]的方法略加改进,取长枣果肉经质量分数95%乙醇处理后,蒸馏水50 ℃水浴30 min,离心后上清液即为可溶性果胶待测液。在剩余的沉淀中加入25 mL 0.5 mol·L-1硫酸溶液,沸水浴后离心得到的上清液即为原果胶待测液。将提取的可溶性果胶和原果胶用咔唑法测定质量分数,结果以生成半乳糖醛酸的质量浓度表示。
1.3.3 PME活力测定 参照LYNGUYEN等[16]的方法用NaOH滴定法测定酶活力,并略有改动。取长枣果肉加入提取缓冲液后冰浴研磨离心,上清液为PME提取液。酶液预热后加入果胶,记录在37 ℃恒温反应时pH值为7.5消耗的0.1 mol·L-1NaOH的体积,以该条件下1 g鲜质量样品1 min催化果胶释放羧酸的物质的量为1个酶活力单位。
1.3.4 PG活力测定 参照曹建康等[15]的方法并略加改进。取长枣果肉加入缓冲液研磨提取,离心后得酶提取液。加入乙酸-乙酸钠缓冲液和多聚半乳糖醛酸溶液,用DNS比色法测OD540值,以1 g鲜质量样品在37 ℃下1 h催化多聚半乳糖醛酸水解生成半乳糖醛酸的质量表示。
1.3.5 β-Gal活力测定 参照GANPUA等[17]的方法。取长枣果肉加入缓冲液冰浴研磨,提取后离心得酶提取液。取酶液加入柠檬酸盐缓冲液和4-硝基苯基-β-D-吡喃半乳糖苷,37 ℃保温后加Na2CO3溶液终止反应,测OD400值,以1 g鲜质量样品1 min水解释放对硝基苯酚的物质的量表示。
1.3.6 细胞壁材料测定 在干燥的细胞壁材料中加入去离子水,得到10 g·L-1的悬浮液滴在显微镜载玻片上固定,在测试前滴加去离子水使样品膨胀[10]。试验前先使用原子力显微镜热调谐适配器获取探针的弹性系数,不同样品每次进行试验前测量敏感度,反复校正5次。将处理好的细胞壁材料片段置于载物台上,将探针移动到长枣细胞壁材料上方,通过轻敲模式,在液体环境中对长枣细胞壁材料进行纳米微压痕试验,获取力-距离曲线。根据样品的自身特性,选择合适的测试位置。每组样品随机选取10个片段,得到10 μm×10 μm的扫描结果,然后在8×8的规则网格中收集到64个曲线,每组样品获取640条力-距离曲线。测前探针加载速度3 μm·s-1,测试探针加载速度为1 μm·s-1,测后速度3 μm·s-1[18]。锥形探针的Hertz-Sneddon模型满足以下方程:
(1)
式中:F是探针对细胞施加的压力,E是杨氏模量,v是泊松比,α是探针半开角,δ是压痕深度。在此试验中选择泊松比为0.3,α半开角为35°。
1.4 数据统计与分析
使用Origin 8.5进行统计分析,SPSS statistics 22.0软件在参数之间进行了Pearson相关性分析以及邓肯式多重差异分析(P<0.05 表示差异显著,P<0.01 表示差异极显著)。使用原子力显微镜专用的软件Atomicj得到杨氏模量,获得的杨氏模量值表示为具有标准误差的平均值。
2 结果与分析
2.1 不同成熟度灵武长枣果实硬度的变化
硬度是反映鲜食果品质构特性与成熟品质的重要指标。果实在成熟过程中,其表观硬度会随果实内部生化代谢过程的进行与果实细胞壁物质的降解而发生变化,主要体现为细胞果胶多聚体水解导致的细胞壁复杂多糖网络的变化。灵武长枣随成熟度的增加果实硬度的变化如图1所示。灵武长枣果实在成熟过程中,果实硬度值随着成熟度的增加逐渐下降,但下降速率随成熟度的不同而不同。其中,硬度从50%成熟度至70%成熟度下降最快,此后硬度虽继续降低但速率有所减缓,至100%成熟度时,硬度下降为(58.6±15.4)g,相比50%成熟度下的初始硬度,其硬度值下降35.47%(P<0.01)。灵武长枣果实在成熟过程中硬度下降的原因主要是果胶多聚体水解导致枣果胞壁多糖网络结构减弱。
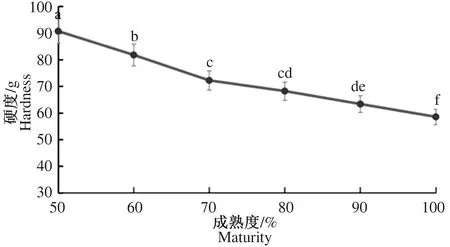
注:不同字母表示存在显著性差异(P<0.05)。下同。Note:There was significant difference (P<0.05) with different letters.The same as below.图1 不同成熟度灵武长枣果实硬度的变化Fig.1 Fruit hardness changes of Lingwu long jujube of different maturity
2.2 不同成熟度果实中细胞壁组分及相关酶的变化
2.2.1 不同成熟度果实中原果胶、可溶性果胶含量的变化 枣果中的原果胶是构成细胞壁架构的主要物质,对维持细胞壁完整性和果实硬度起着至关重要的作用,而可溶性果胶是果胶随成熟度增加的降解产物,在果实成熟过程中二者共同调控细胞壁架构体系。由图2可知,原果胶含量随着成熟度的增加总体呈下降趋势,50%成熟度至60%成熟度原果胶含量下降速率平缓,60%成熟度至90%成熟度原果胶含量则迅速下降。相比50%成熟度,100%成熟度的灵武长枣原果胶含量下降了45.45%(P<0.01)。对比图3可知,可溶性果胶含量在成熟过程中与原果胶含量趋势并不相同,即50%成熟度至90%成熟度可溶性果胶含量增加速率较快,90%成熟度至100%成熟度可溶性果胶含量增加趋于平稳。100%成熟度灵武长枣可溶性果胶含量相比50%成熟度增加了125.37%(P<0.01)。

图2 不同成熟度下果实中原果胶含量的变化Fig.2 Variation of the original pectin content of fruits of different maturities

图3 不同成熟度下果实中可溶性果胶含量的变化Fig.3 Variation of soluble pectin content of fruits of different maturity
2.2.2 不同成熟度灵武长枣果实中细胞壁酶活力的变化 在图4中,PME活力随着枣果成熟度的增加总体呈现先升高后降低的变化趋势。80%成熟度时,PME活力达到最大值1 170.5 μmol·g-1·min-1,此后虽稍有下降,但相比50%成熟度,100%成熟度PME活力显著增加至1 049.0 μmol·g-1·min-1。图5同样表明,PG活力随成熟度的增加而显著增加,相比50%成熟度,100%成熟度PG活力显著增加了73.68%。从图6中可以看出,β-Gal活力也随着成熟度的增加相应增加,相比50%成熟度,100%成熟度β-Gal活力增加了113.11%。
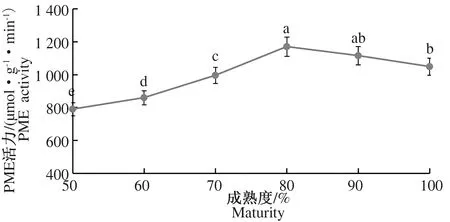
图4 不同成熟度下果实中PME活力的变化Fig.4 Changes in PME activity in fruits of different maturities
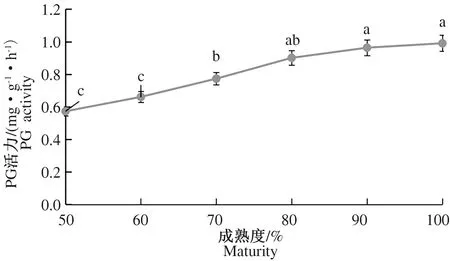
图5 不同成熟度下果实中PG活力的变化Fig.5 Changes in PG activity in fruits of different maturities
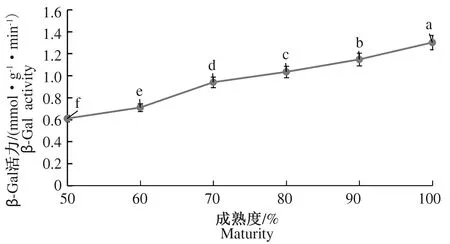
图6 不同成熟度果实中β-Gal活力的变化Fig.6 Changes in β-Gal activity in fruits of different maturity
2.3 不同成熟度灵武长枣果实中细胞壁杨氏模量的变化
随着灵武长枣成熟度的增加,果实宏观质构特性主要表现为果实硬度的变化,而杨氏模量则可作为其内部微观力学特性变化的体现。从图7中可以看出不同成熟度果实的杨氏模量分布特点。不同成熟度杨氏模量值主要分布在0~60 kPa。50%成熟度果实细胞壁杨氏模量主要分布在0~50 kPa,在30~40 kPa分布最多。60%成熟度果实细胞壁杨氏模量分布在0~20 kPa最多,拟合曲线峰值在40~45 kPa,且在100~200 kPa之间仍有较多分布。70%成熟度果实细胞壁杨氏模量主要分布在0~40 kPa,尤其在10~15 kPa范围内,这也就是70%成熟度平均杨氏模量值最小的原因。在80%成熟度果实的频率直方图中拟合曲线波峰在50~60 kPa,分布在60 kPa以上也很多,使得其杨氏模量平均值最大。90%成熟度果实细胞壁杨氏模量主要分布在0~60 kPa,在60~160 kPa区间也有较多分布。100%成熟度果实细胞壁杨氏模量主要分布在0~50 kPa,大于50 kPa的数据只占5%左右,降低了其杨氏模量平均值。拟合曲线波峰从50%成熟度到60%成熟度先有所后移,在70%成熟度又前移,到80%成熟度又变高且后移,至90%成熟度时变得平缓,最后在100%成熟度时变尖且继续前移。
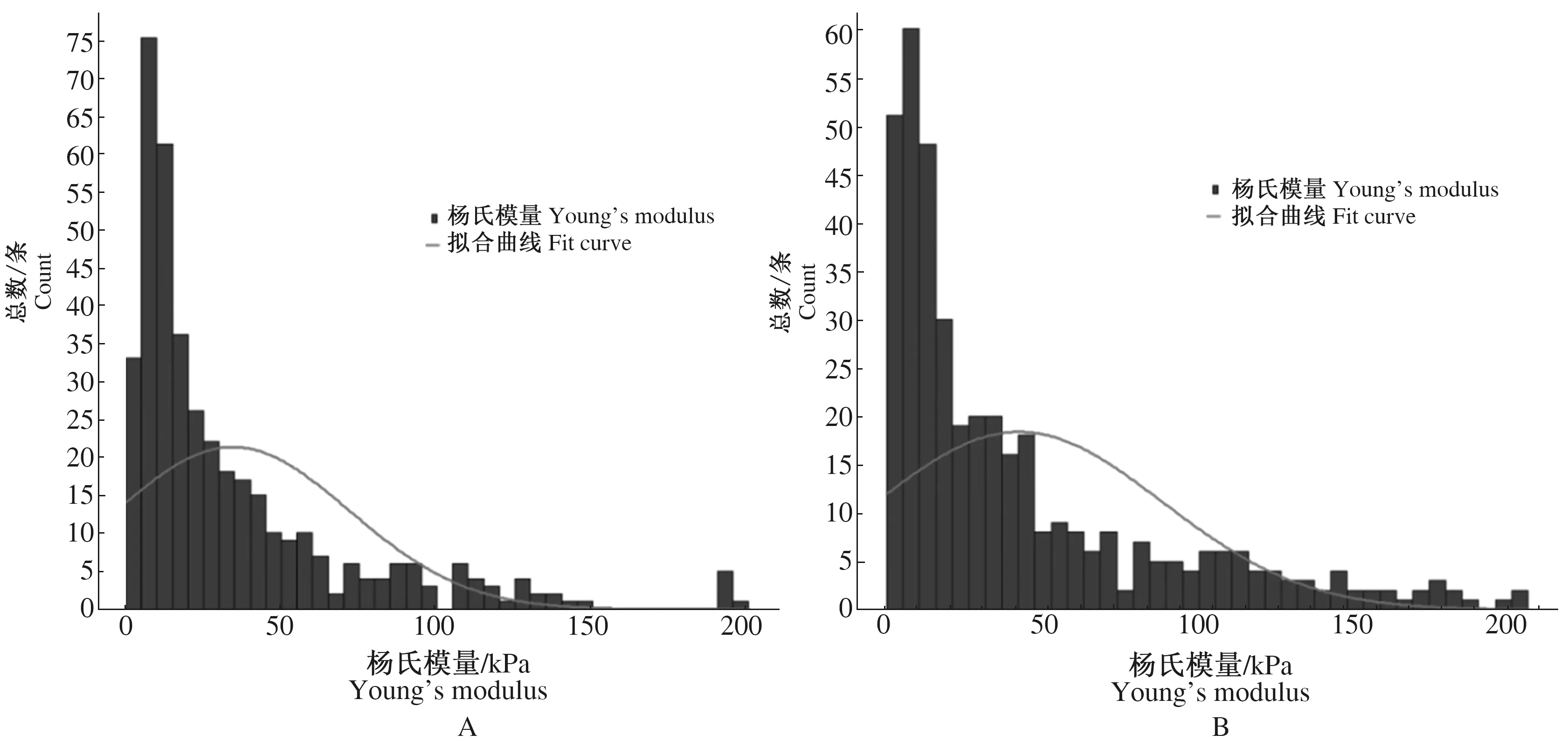

注:A、B、C、D、E、F分别为50%、60%、70%、80%、90%、100%成熟度。Note:A,B,C,D,E,F,means 50%,60%,70%,80%,90%,and 100% maturity of the ripe fruit,respectively.图7 不同成熟度果实的杨氏模量分布频率直方图Fig.7 Histogram of Young’s modulus distribution frequency of fruits of different maturity
图8为灵武长枣生长过程中,随着成熟度增加其对应杨氏模量的变化情况。不同成熟度之间的杨氏模量分布范围差别较大,且经高斯拟合计算后,各成熟度下的杨氏模量范围均呈偏正态分布。其中,50%、60%、70%、80%、90%和100%成熟度的平均杨氏模量分别为(35.38±17.56)、(41.49±16.52)、(23.27±21.35)、(51.83±23.53)、(43.93±15.34)、(22.59±17.19) kPa。80%成熟度与100%成熟度的平均杨氏模量呈现显著性差异(P<0.05);60%成熟度与90%成熟度的平均杨氏模量之间差异不显著(P>0.05),70%成熟度与100%成熟度的平均杨氏模量差异不显著(P>0.05)。该结果表明不同成熟度下的平均杨氏模量差异较大。
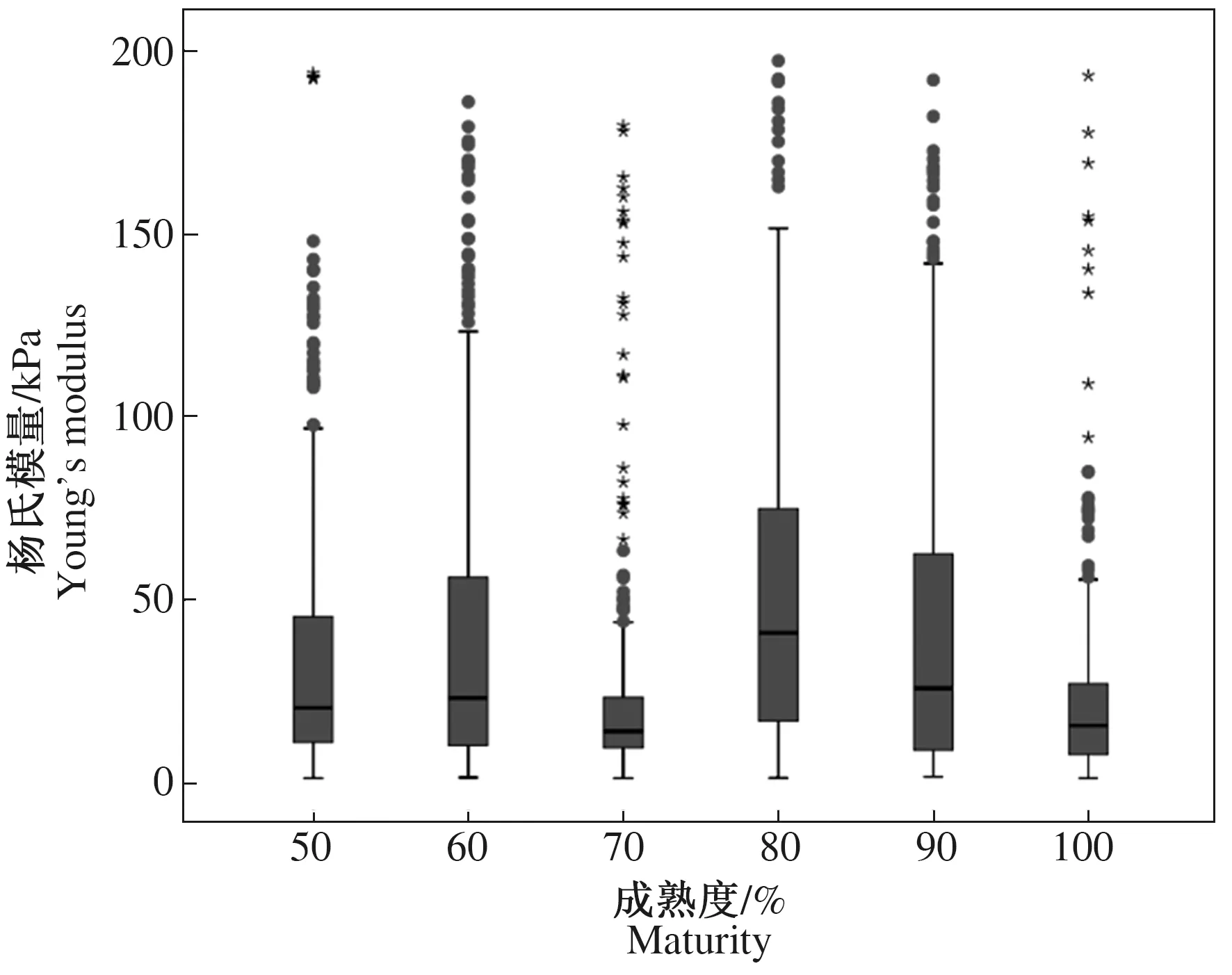
图8 不同成熟度果实的杨氏模量分布箱型图Fig.8 Box diagram of Young’s modulus distribution of fruits of different maturity
2.4 果实硬度、细胞壁杨氏模量、细胞壁组分及其相关酶之间的相关性
表1为灵武长枣成熟过程中硬度、细胞壁杨氏模量、细胞壁组分及其相关酶之间的相关性。成熟度与硬度、原果胶含量呈极显著负相关(P<0.01),相关系数分别达到-0.984、-0.971;与可溶性果胶、PG和β-Gal之间呈极显著正相关(P<0.01),相关系数分别达到0.987、0.984、0.993;与PME呈显著正相关(P<0.05),相关系数达到0.812;但成熟度与杨氏模量之间缺乏直接相关性,相关系数仅为-0.128。灵武长枣成熟过程中果实硬度、细胞壁组分质量分数及其降解酶活力之间密切相关。硬度与原果胶、可溶性果胶质量分数的相关系数分别达到0.931、-0.974,与果实的PG、PME和β-Gal之间呈相关系数分别达到-0.986、-0.863、-0.990。但果实的细胞壁杨氏模量与硬度、原果胶、可溶性果胶质量、PG、PME和β-Gal之间均缺乏直接相关性。
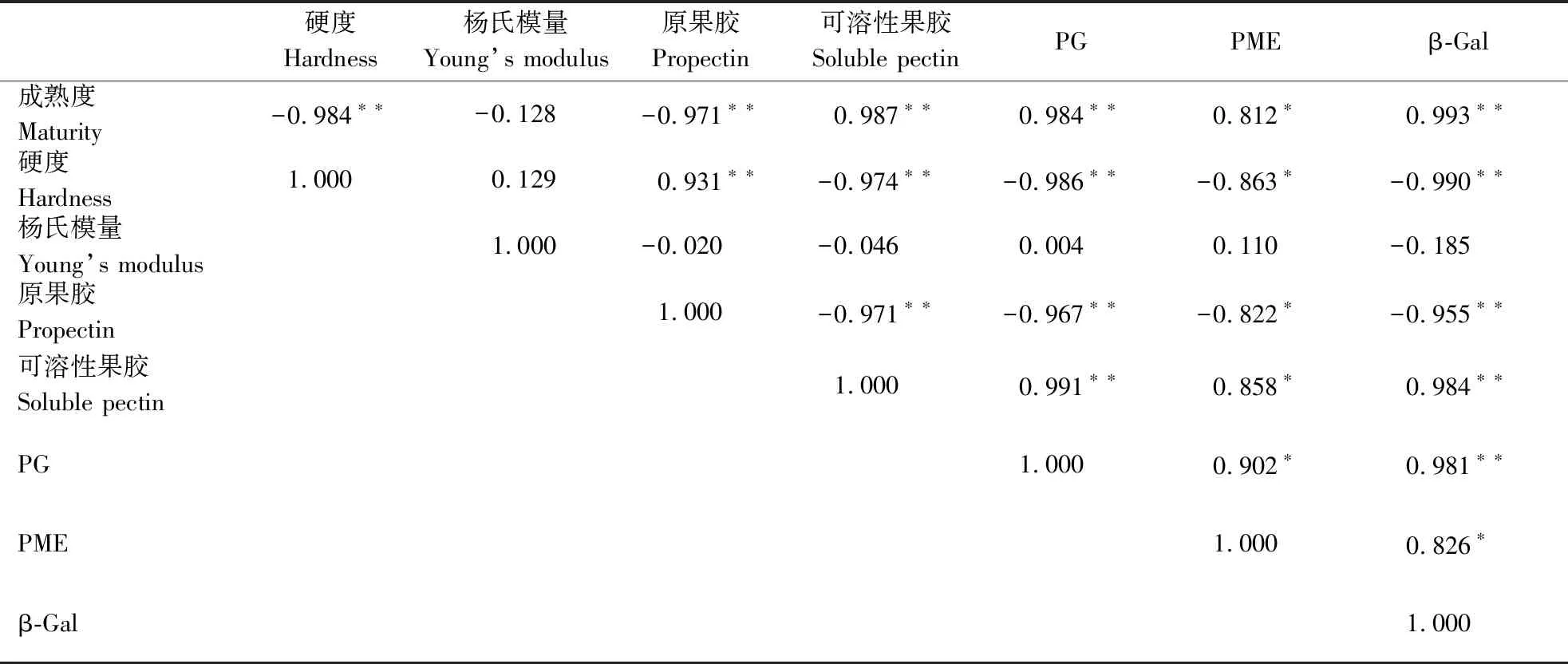
表1 果实硬度、细胞壁杨氏模量、细胞组分及其相关酶之间的相关性Table 1 Correlation between fruit hardness,cell wall Young’s modulus,cell components and their related enzymes
3 结论与讨论
本研究从生物学及微观力学角度对灵武长枣宏观硬度随成熟度的变化进行了分析。研究结果表明,灵武长枣成熟过程中其硬度变化是细胞壁组分变化造成的,与参与果实成熟代谢酶密切相关。随着成熟度的增大,灵武长枣果实硬度不断降低,推测是因为成熟初期的果实内部生命活动较为旺盛,伴随着内部干物质的大量生成积累,在生长素和细胞分裂素的共同作用下,细胞数量增加较快,果实体积快速增长膨大,果实细胞网络结构从紧密逐渐松散,硬度下降较快[19]。此后,果实网络结构随着果实成熟度的增加逐渐趋于稳定,细胞数量变化不大,硬度的下降主要是细胞代谢及果实内部降解酶系对果实细胞壁果胶物质的增溶解聚及中胶层、中性侧链的共同降解作用所致,故果实硬度下降有所减缓[20]。原果胶含量降低,可溶性果胶含量增加,这是由于枣果在成熟过程中,原果胶在PME的作用下进行去酯化,同时PG的酶活力增强使得果胶链进一步解聚,长链缩短,故其原果胶含量随成熟度增加呈下降趋势。同时,随着原果胶降解程度的增加,使得内部果胶短链含量增加,可溶性果胶含量进一步增加。原果胶由于其致密结构,初始含量高,故果实硬度较大。随着果实成熟的进行,果胶的降解会增加细胞壁交联网络的细孔大小,导致软化后期细胞壁膨胀,使底物更容易受到酶的作用,进而导致果实硬度下降[21]。
PME和PG是枣果生长发育中调控其成熟软化的重要酶类,均对采后果实软化及硬度下降起着关键作用。由于PG隐藏在细胞壁内,并且高度甲酯化,在去酯化作用后才能发挥PG的水解作用。PME主要使果胶去甲酯化,催化果胶酯酸转化为果胶酸,破坏多聚糖醛酸链间钙的横向联接而导致细胞分离,同时生成适合于PG作用的底物,在共同作用下果胶降解,细胞壁结构松散,果实软化[22]。β-Gal的作用主要是切断细胞壁物质的半乳糖苷键,清除半乳糖残基,并作用于果胶多糖的侧链,使果胶网络松动,细胞间隙增大,有利于与其他果胶酶与底物的接触[23],增加了与枣果硬度相关的底物的降解。
细胞壁降解酶水解细胞壁多糖,使细胞间连接减少,导致细胞离散,且这些酶在果实软化的不同阶段起不同的作用。该研究结果有助于深入研究不同成熟度灵武长枣果实的酶学调控机制,为灵武长枣的保鲜储藏提供科学依据。在果实成熟过程中PME、PG、β-Gal对果胶的降解具有协同效应,随着枣果成熟度的增加,上述细胞壁降解酶系活力随之增加并共同作用于枣果果胶链的降解和溶解,启动了灵武长枣果实的软化进程,进而造成果实硬度下降。这与李欢等[24]对枣成熟软化机理的研究一致。另外,成熟过程中果实的宏观硬度与细胞壁杨氏模量之间相关性不显著,相关系数仅为0.129(P<0.01),推测是在灵武长枣果实成熟过程中,与硬度下降有关的因素较多,相关参数之间差异过大,导致细胞壁刚度对果实硬度的作用被果实组织力学模型的其他参数所掩盖。杨氏模量与细胞微观力学参数之间并不存在绝对相关性。邱雪等[25]研究表明,静压损伤枣果与撞击损伤枣果的细胞壁杨氏模量值之间无显著差异。本研究推测在成熟过程中不同因素包括外部损伤等都会导致枣果之间细胞微观力学发生变化。

