靛玉红及其衍生物的合成与研究进展*
姬长安,于 健,严国兵
(丽水学院化学系,浙江 丽水 323000)
肿瘤(tumor)/癌症(恶性肿瘤)是目前威胁人类健康的最大杀手,肿瘤的治疗方式有三种:放疗、化疗和手术,放疗、化疗为常用抗肿瘤疗法,主要通过细胞毒性药物来杀死癌细胞,但对人体健康细胞的伤害较大,而且肿瘤还会复发。随着医学技术的进步,只针对肿瘤细胞的特异性靶点药物治疗方式引起了人们的广泛关注,即针对肿瘤或各种疾病发生时体内的个别蛋白激酶异常表达,诱导细胞变异,参与变异细胞、肿瘤细胞核酸的编译、转录等等,是细胞非正常再生、表达的最直接诱因,所以直接针对这些激酶进行抑制,就可以达到抑制肿瘤细胞的作用。不仅是癌症,还有糖尿病、阿兹海默症(AD)等等,都是由于特定激酶的异常表达[1]。
人体有30%的蛋白质含有共价键结合的磷酸盐结构,蛋白质磷酸化被认为是细胞精细调节代谢和调控途径的主要翻译后机制之一,蛋白激酶利用ATP或GTP作为磷酸盐供体催化蛋白质的磷酸化。蛋白激酶的异常表达会导致蛋白质的异常磷酸化,这往往是多种人类疾病如癌症、糖尿病、AD等的诱因。人体内有500多种激酶,其中有两类激酶被特别研究:细胞周期素依赖激酶(CDKs)和糖原合成酶激酶-3(GSK-3)。一些CDKs(CDK1,2,4,6)能控制细胞分裂周期和凋亡,常见于癌症患者体内;另一些CDKs(CDK5,11)参与神经系统各项功能,如CDK5在AD和其他神经退行性疾病中异常表达。GSK-3参与细胞程序化死亡,异常表达于肿瘤、糖尿病、AD等等[1],是许多此类疾病的诊断特征之一。因此,各种激酶抑制剂的研究,成为了当下抗肿瘤医药的热点。
靛玉红(Indirubin,图1)是靛蓝(indigo)的同分异构体,属于双吲哚生物碱类化合物,是中药当归龙荟丸的主要成分之一,主要用于治疗慢粒白血病。近年来研究发现靛玉红及其衍生物对实体乳腺癌、肝癌、肺癌等实体肿瘤和血液系统肿瘤均具有抗肿瘤活性,在炎症、神经系统疾病、自身免疫性疾病等方面也有作用,所以,靛玉红在抗肿瘤、抗炎、神经药物开发等方面有着很大的发展前景[2]。

图1 靛玉红(a)与靛蓝(b)结构式
通过对靛玉红母核进行各种取代修饰,能有效抑制CDKs、GSK-3激酶的表达,从而抑制肿瘤细胞的生长、增殖等。靛蓝化合物是常用的蛋白激酶抑制剂,通过与ATP、GTP结合的竞争作用产生作用,是良好的激酶抑制剂。
1 靛玉红的合成
由于靛玉红很早就被发现有药用价值,早期靛玉红的获取是从马蓝、蓼蓝和菘蓝等含靛蓝高的植物中提取,因靛玉红在植物体内含量低,水溶性差,提取分离的成本高,所以此方法收率低,大都采取合成法[3-10],当然,也有人员提出了产率比较好的微生物提取法[11](大肠杆菌培养提取靛玉红),为靛玉红生产提供了可能的新途径。目前比较普遍的靛玉红合成方法是靛红(isatins)和吲哚乙酸酯缩合反应,酸性碱性的选择是根据所合成靛玉红衍生物的特性,碱法的适用范围大些,所以大都采用碱催化法(图2),此方法操作简单,条件温和,收率较高[12]。而合成4取代靛玉红时,用酸法产率高[9]。靛玉红衍生物的合成通常是选用不同取代的靛红和吲哚,再用此法反应。
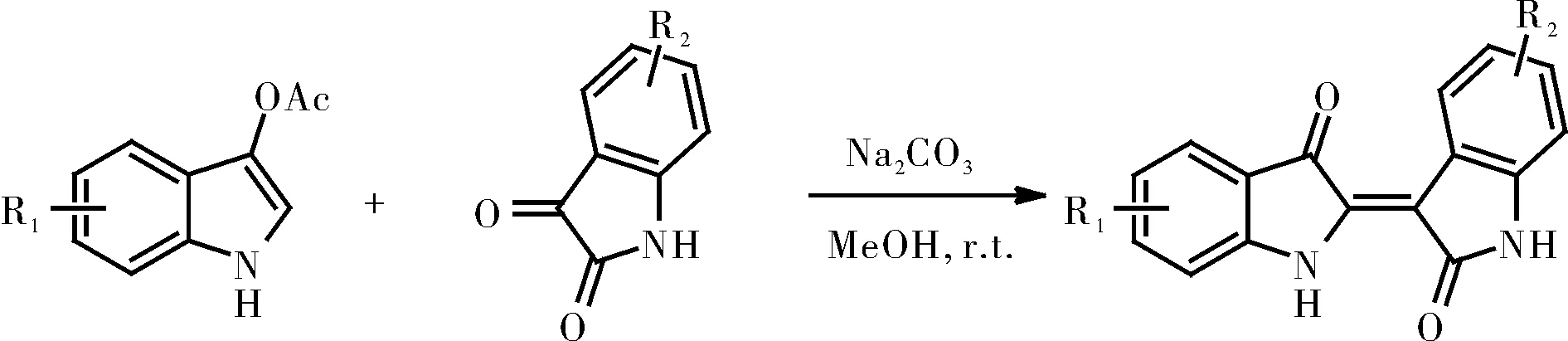
图2 碳酸钠催化靛玉红合成反应
近几年,有人报道了一个合成靛玉红的新方法[12]。Wang等总结了近十几年来靛玉红的5种合成方法,并提出使用KBH4一步还原欧联法制备靛玉红(图3)。经条件筛选,乙醇作溶剂效果最好,KBH4也可以用NaBH4代替,活性相似,且对于此反应,闭口反应时无产物或产率极低,所以要敞口在氧气的条件下反应。此法产率可以达到90%,操作简单,适用范围广,比传统合成方法更具有潜力。

图3 KBH4催化一步法合成靛玉红

图4 KBH4催化反应机理
由于靛玉红水溶性差,导致细胞吸收不良,活性降低,且不易提纯与制剂,所以人们的关注点逐渐从靛玉红转移到靛玉红-3’-肟(肟醚)化合物上面来。最开始靛玉红亲水性的改进时在苯环引入羟基、酸基等亲水基团,但是这些基团活性提升小,拓展空间有限。在靛玉红3’位引入肟基(=N-OH)或醚肟(=N-O-R)(图5),含有了靛红肟骨架,不仅改善了亲水性,还增加了其生物活性,能表现出更多药理活性,在醚肟R基基础上引入其他活性基团(烯烃类、环氧化物、胺环类等等),使其表现出更多的生物活性,力求更多的临床价值。

图5 靛玉红肟的合成
2 靛玉红的生物活性与构效关系
由于靛玉红的抗肿瘤活性是近十几年才研究发现的,所以迄今为止靛玉红的生物活性研究报道并不多,由于其在生物体内较好的配位能力以及较好的拓展性,人们的研究主要集中在其对CDKs、GSK-3等的选择性抑制及其作为先导化合物的各种取代改性上,常见的CDKs抑制剂是作CDK2和CDK5抑制剂,因为CDK5和GSK-3同样都是是作为AD患者的诊断特征之一。
较早的研究如Polychronopoulos等[1]利用分子模型研究了各种靛玉红结构在ATP口袋中的选择性结合情况,此模型的提出方便了日后人们对靛玉红的选择性抑制研究。对靛玉红进行取代修饰时,在5、5′、3′位等引入取代基往往对活性有较大影响,是研究靛玉红构效关系的首选。Wu等[13]利用大肠杆菌研究了靛玉红衍生物对GSK-3激酶的抑制活性,对靛玉红母核取代修饰,并得到了一种抑制效果较好的化合物(图 6),可见在5、5′位引入酯基等比较显著的提高了靛玉红的抑制活性。

图6 靛玉红母核5、5′位修饰
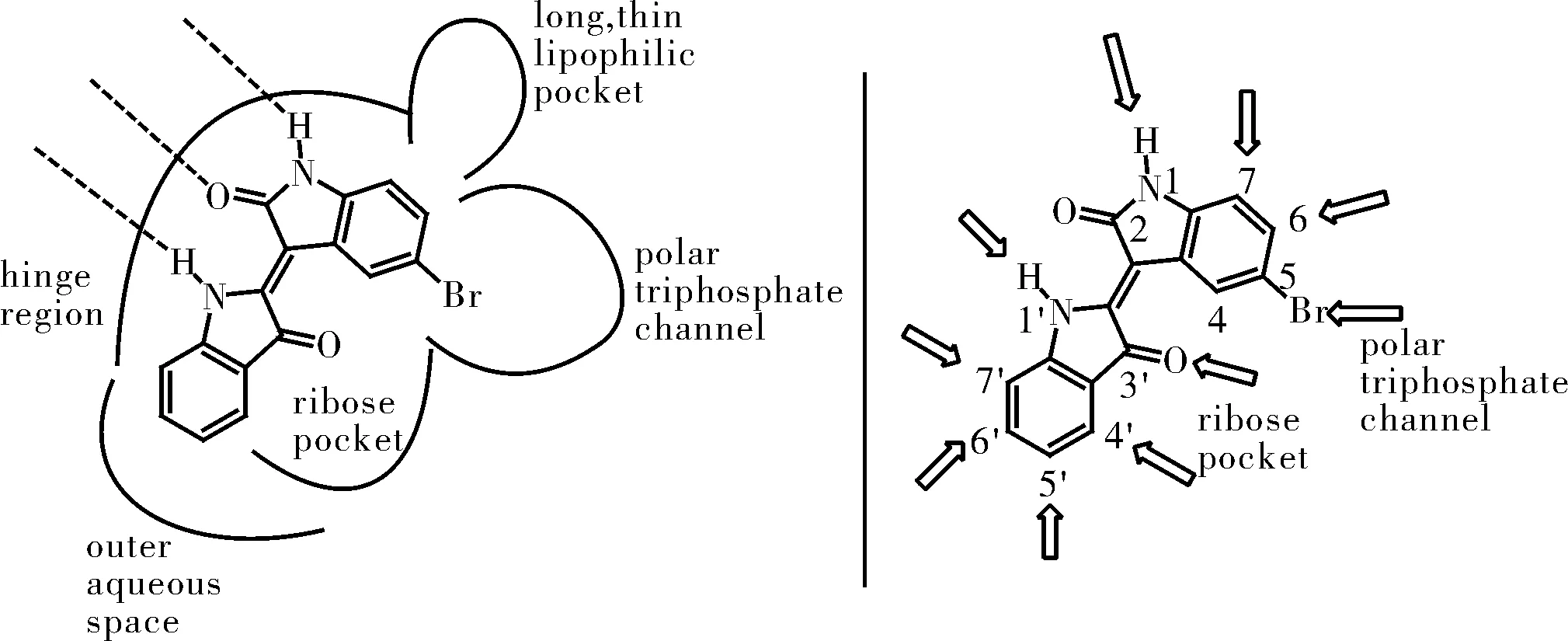
图7 靛玉红母核的生物结合关系
Jautelat等[14]研究靛玉红结构对CDK2的抑制活性,找寻其构效关系,他们利用计算机建模,根据X射线观察出的靛玉红与CDK2结合后的结构数据,发现只有5、3′、4′、5′位容易取代(图7),而在1、6、7、6′、7′位取代则会导致失活,确定了5位指向极性三磷酸盐通道、3′位指向核糖口、5′位指向核糖口末端的含水环境,通过修饰这几个位置不仅改变靛玉红极性来增强亲水性,还能增加与ATP的亲和力。他们在5位引入磺酰基和磺酰胺基,在3′为引入肟醚结构,改变化合物结晶性和水溶性,活性显著增加。
Moon等[3]研究新的靛玉红衍生物对乳腺癌细胞的抗增殖活性,在5位引入F、Cl、OCF3等等,均有较好的抑制效果,在5位引入酰胺基(图8),R基含有叔丁基结构时比含烷基结构活性高,R基位苯环化合物取代时,大都无活性。他们还对多种癌细胞菌株(A 549、SNU-638、Col2、HT 1080、HL-60和MCF-7)进行抑制观察,发现靛玉红有会选择性抑制性。

图8 靛玉红引入肟基、酰胺基
Beauchard等[4]研究新的5取代靛玉红衍生物对CDK1、CDK5、GSK-3等的抑制活性,抑制效果显著,还在N1位引入甲基进行对照研究,但效果较差,可能是因为增加了位阻。Ferandin等[15]研究了3’-取代-7-卤代靛玉红,因为发现其具有优异的细胞死亡诱导属性,发现7位卤素取代对CDKs和GSK-3几乎没有效果,他们推测是因为7位取代阻碍了靛玉红与受体结合,也应了上文Jautelat等的报道。Beauchard等[6]研究对比了5、7双取代和6取代靛玉红的选择性抑制关系,发现6位取代靛玉红对GSK-3有较高选择性,5位取代对CK1有较高选择性。
Magiatis等[16]研究了靛玉红衍生物在神经退行性疾病方面的药物活性,通过检测小鼠大脑内纹状体单胺类物质的消耗,来观测其效果,除了研究5位、6位的溴取代-3′-肟外,发现在5位引入氨基能增强CDK5抑制活性,还在此基础上合成了新的5-氨基-6-溴靛玉红,得出靛玉红可能对海人酸(KA)所致的伸进系统损伤具有保护作用,因为这些神经毒素(KA、MPTP等)都与CDK5相关。
Choi等[17]为了更进一步增强靛玉红抗癌活性,在5、5’位用羟基、硝基和氟类等基团拓展,受到之前研究的强效抑制剂5-硝基-5′-溴靛玉红-3′-肟启发,合成了5-硝基-5′-羟基和5-硝基-5′-氟等靛玉红-3′-肟衍生物,作为CDK1和CDK5抑制剂有较好的抗癌效果,5-硝基-5′-羟基靛玉红-3′-肟(图9)对CDK的选择性和抗肿瘤活性是同参与测试激酶的500倍。构效关系表明,5′位为羟基和卤素时,抑制活性优于甲基、甲氧基等供电子基团。

图9 靛玉红肟5、5′号位修饰
Cheng等[8]在5位引入羧酰胺,制备了一系列新的靛玉红、靛玉红肟、靛玉红肟醚等衍生物(图10),能与水质子化,使其有更好的水溶性,增强了其抗增殖活性。
图10 水溶性靛玉红骨架(R为各种-N类)
Saito等[10]研究甲氧基靛玉红衍生物在诱导神经母细胞瘤细胞死亡的细胞毒性,得出5′-甲氧基靛玉红对诱导神经母细胞瘤细胞死亡有着高特异性,可能开发为治疗神经母细胞瘤药物。Myrianthopoulos等[18]提出一种新的反结合模式,即采用倒置结合的方式与受体结合,他们发现当靛玉红7位为溴取代、5′位为羧酸类基团时,靛玉红对DRYK(双特异性酪氨酸磷酸化调节激酶,参与AD、唐氏综合症等神经性病理)激酶表现出有效的选择性抑制。Jung等[19]研究了靛玉红衍生物作为体细胞转分化诱导剂的活性,他们发现5-硝基-5′-羟基-靛玉红-3′-肟有高效的转分化活性,优于其他分子,且无潜在致癌和免疫原性iPSC转录的表达,可作为细胞编程的分子工具。Yan等[20]发现了靛玉红-3′-肟衍生物对CDK9有较好的抑制活性,其中效果最好的是5-甲氧基-5′,6′-二氟靛玉红-3′-肟醚(图11)。Jung等[21]研究了靛玉红衍生物作为一种新的DRAK2抑制剂的活性,是5-酰胺基靛玉红-3′-肟骨架,在酰胺基变换(图8)。

图11 引入卤素和肟醚结构
Cheng等[22]在研究靛玉红衍生物作为胰岛素样生长因子1受体(IGF-1R)的抑制剂时,进一步研究了靛玉红亲水性与取代位的关系,研究了5′位的基团耐受性,发现5′位取代基不能像3′位可以容忍较大基团和刚性基团而不影响活性,5′位有限的修饰空间会导致化合物整体细胞毒性和水溶性降低,他们研究合成了有效的、水溶性好的IGF-1R抑制剂(图12)。

图12 含靛玉红母核的水溶盐
Ichimaru等[23]合成了一种靛玉红新结构(图13),发现其具有长效抗癌活性和环氧水解酶自杀抑制活性,此结构中,环氧结构的引入可与蛋白质共价连接,表现出的细胞毒性可与顺铂相媲美(以HepG2细胞实验)。他们发现溴取代除6′位的芳环位都能提高抗癌活性,5位溴取代的活性最好,5位溴取代活性好于氟、氯、碘,5位甲氧基取代时活性也优于其他位。

图13 肟醚结构引入溴
Kosuge等[24]也研究了靛玉红结构对神经退行性疾病的治疗作用,是研究靛玉红衍生物对内质网应激诱导产生的神经系统疾病的保护作用。
3 结 语
靛玉红以其出色的抗肿瘤生物活性和可拓展性,使其成为近几年抗肿瘤靶向药物极具研究价值的药物前体,其本身具有良好的生物结合性,是一种更好的、新的激酶抑制剂,适当、准确的对其加取代修饰,可使靛玉红发挥更好的生物活性,还可以通过特殊的基团或C位修饰,让其表现出独特的特异性细胞毒性和靶标选择性,可对多种激酶的选择性抑制,具有很大的研究价值和发展潜力。但近十几年的研究只是大概推断出其药理活性以及其作为多种抗癌、神经疾病药物的可能性,对其构效关系的探究也没有十分准确的解答,因为合成的困难,靛玉红的修饰多停留在3′位、5位等,取代的基团也相对较简单,对其生物方面活性的研究也有待深入。因此,进一步探究靛玉红衍生物的准确构效关系,提高其生物活性与选择性,将成为日后靛玉红衍生物研究发展的重点。

