基于功能化纳米金和石墨烯量子点的比色/荧光双信号检测Pb2+研究
薛晓洁,雷茹淋,张帆,熊华玉,文为,张修华,王升富
(1. 湖北大学化学与化工学院, 湖北 武汉 430062; 2. 铜仁职业技术学院, 贵州 铜仁 554330)
0 引言
铅离子(Pb2+)是环境中毒性最强、分布最广的重金属污染之一,已引起科学界的广泛关注.Pb2+对人体的许多组织和器官都能造成毒害,尤其是对神经系统和泌尿系统的毒害[1-2].现有研究已表明长期暴露在低浓度的Pb2+中将对儿童造成严重的智力损伤[3].目前检测Pb2+的常用方法有:电感耦合等离子质谱法[4]、原子吸收光谱测定法[5-6]、反向高效液相色谱法[7]、表面增强拉曼光谱法[8]等,这些方法选择性好、灵敏度高,但也存在需要对样品进行预处理、分析时间长、不适合现场检测等缺点.其中,基于金属纳米粒子的比色测定法因其简便,快速,经济高效且不需要任何复杂的仪器来检测各种分析物而受到越来越多的关注.但是,大多数检测限为微摩尔量级.因此,结合比色法开发高灵敏度、高选择性的检测Pb2+双信号探针具有重要意义.
与传统有机发色团的消光系数相比,Au NPs消光系数要较之大几个数量级.此外,Au NPs的表面等离子体共振带对其粒子之间的距离十分敏感.当Au NPs相互接近并聚集时,Au NPs表面等离子体共振带会发生红移[9-11],相应地,其溶液颜色会从红色逐渐变为蓝色.因此,通过目标物对Au NPs的聚集程度的影响,可以实现对目标物的分析检测.由于Au NPs的这些特殊的性质,其经常应用于可视化检测体系[12-13],如Chen等基于Au NPs对CdTe QDs的内滤效应实现了对溶菌酶的可视化和荧光检测[14].
石墨烯量子点(GQDs)是横向尺寸小于20 nm的石墨烯的零维结构,由于其具有合成方法简单、成本低、优异的化学和光稳定性、高生物相容性、水溶性好以及可调的粒径与光致发光等优点,引起越来越多人的兴趣.并作为半导体量子点和有机荧光团的替代物广泛地用于荧光成像[15]和生化分析[16].Liu等由氧化石墨制得了发橙色荧光的GQDs,在辣根过氧化物酶以及过氧化氢(H2O2)的同时存在下,儿茶酚会被羟基自由基氧化并转化为邻苯醌,可以显著淬灭GQDs的荧光.然而,当抗坏血酸存在时,它可以抑制邻苯醌的产生,导致荧光复苏,实现了抗坏血酸的检测[17].Jiang报道了一种使用Fe3O4和GQDs纳米复合材料的新型的靶向荧光成像诊断肾病的方法[18].
与单独通过测定吸光度或荧光强度来检测目标物的方法相比,基于内滤效应的方法因为吸光物质的吸光度的变化会导致荧光团的荧光强度呈指数变化从而获得更高的灵敏度,且该过程并不需要吸光物质和荧光团之间的连接,使得该方法相对简单和灵活[19-20].基于此,本工作构建了功能化纳米金对石墨烯量子点的内滤作用可视化检测Pb2+新方法.工作原理如图1所示,具有双齿性质的二硫代氨基甲酸盐(DTC)配体通过螯合作用紧密地结合在Au NPs表面,N-C-S2基团形成共振结构,对Pb2+具有很强的亲和力并将其捕获到Au NPs表面,从而诱导DTC-Au NPs的聚集,降低了其内滤效应,使GQDs的荧光得到恢复.实验结果表明,设计的荧光传感器可以方便快捷、选择性、可视化地检测实际样品中的Pb2+.
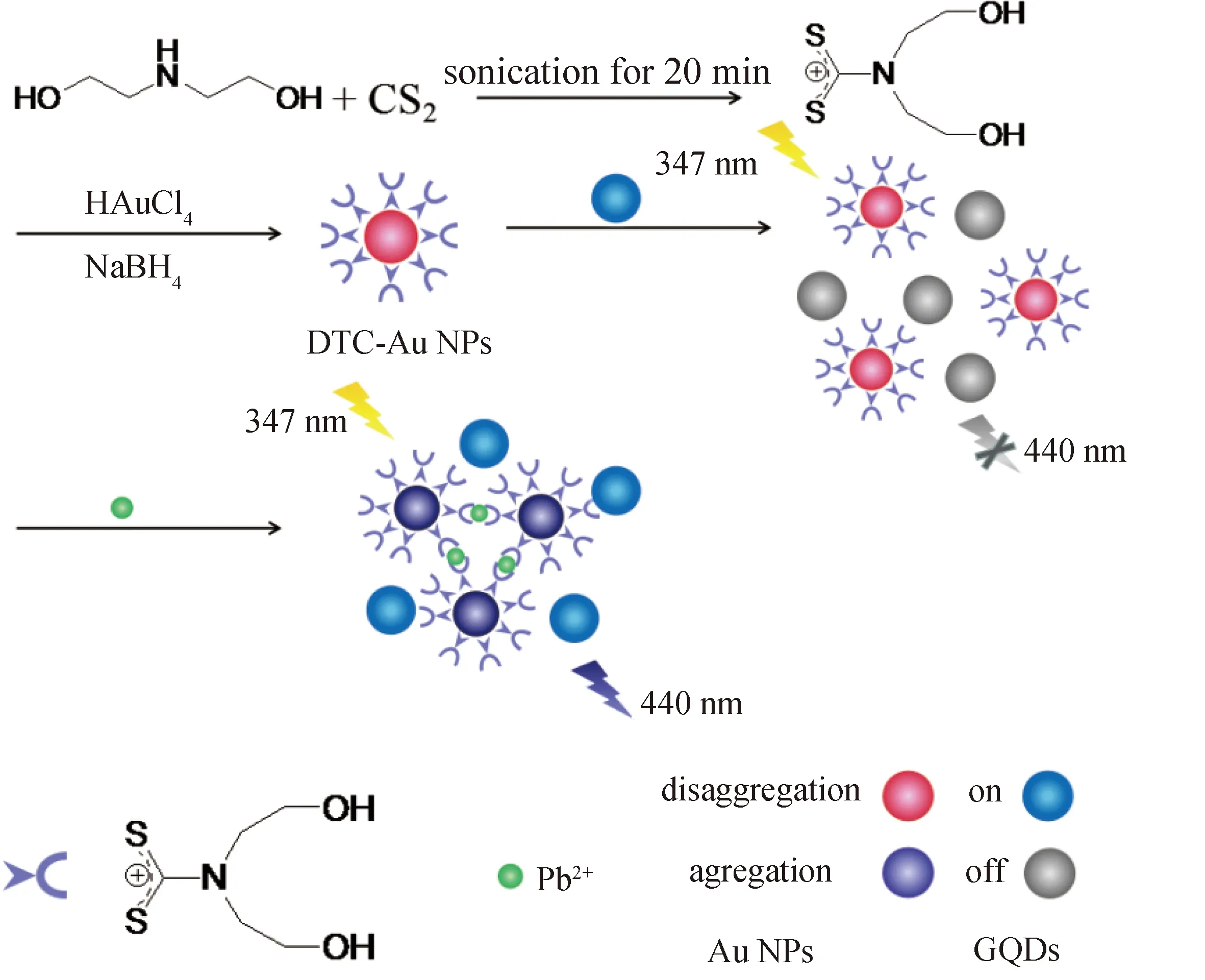
图1 DTC-Au NPs和GQD的Pb2 +检测机制的示意图
1 实验部分
1.1 实验仪器RF-5301PC的荧光分光光度计(日本岛津公司);UV-2700的紫外-可见分光光度计(日本岛津公司);Tecnai G20透射电子显微镜(TEM,美国FEI公司).
1.2 实验试剂二硫化碳(CS2)、二乙醇胺(DEA)、乙酸锌二水合物(ZnC4H6O4·2H2O)、氯化锶(SrCl2)、硝酸铅(Pb(NO3)2)、氯化钠(NaCl)、氯化镁六水合物(MgCl2·6H2O)、氯化钡一水合物(BaCl2·H2O)均购于国药集团化学试剂有限公司.乙酸锰四水合物(MnC4H6O4·4H2O)、氯化铜(CuCl2·2H2O)、柠檬酸钠二水合物(Na3C6H5O7·2H2O)均购于西格玛奥德里奇有限公司.氯金酸三水合物(HAuCl4·3H2O)、硼氢化钠(NaBH4)、氯化镉(CdCl2·2.5H2O)均购于上海阿拉丁生化科技股份有限公司.实验用的石墨烯量子点(GQDs)购于南京先丰纳米有限公司.所有试剂均为分析纯.实验用水为超纯水(18.25 MΩ·cm).
1.3 实验方法
1.3.1 DTC-Au NPs的合成 按文献方法制备DTC-Au NPs[21-22],过程如下:首先,将1 mmol/L DEA和1 mmol/L CS2在甲醇中混合超声5 min,得到DTC溶液;然后,在100 mL的水中加入80 μL HAuCl4·3H2O(10%,质量分数),0.1 mL 柠檬酸钠(1 mmol/L)和0.75 mL DTC(1 mmol/L)搅拌20 min;向混合溶液中加入4 mg的NaBH4还原HAuCl4;最后,将混合溶液在室温下搅拌2 h得到DTC-Au NPs,将其放入冰箱中保存备用.
1.3.2 Pb2+的测试方法 将10 μL不同浓度的Pb2+的溶液依次加入到1 mL DTC-Au NPs溶液中,涡旋30 s并反应8 min后,向其中加入10 μL GQDs(10 mg/mL).经充分混合后,在激发波长为347 nm,激发和发射狭缝宽度分别为10 nm和5 nm的条件下,在波长范围360~600 nm测定荧光信号.
2 结果与分析
2.1 DTC-Au NPs的表征DTC配体以CS2和DEA为主要前体分子混合超声原位合成.N-C-S2基团在二硫代氨基甲酸酯分子中形成共振结构,从而对金属具有很强的亲和力.图2A(曲线c)为DTC的UV-vis光谱,在紫外区260 nm和290 nm出现DTC的两个吸收峰,与文献报道一致[22].当将NaBH4和HAuCl4添加到形成的DTC溶液中时,形成了透明的酒红色Au NPs溶液;同时,UV-vis光谱表明,在524 nm处出现一个吸收峰(图3A,曲线a),这是由于Au NPs的表面等离子体吸收引起的.利用透射电镜(TEM)表征了DTC-Au NPs和GDQs的形态和大小.结果表明,DTC-Au NPs具有高度均匀的单分散性,呈球形,平均直径约为5 nm(图2B).图2C显示GQDs也呈球形且分散性良好,平均直径为约3 nm.
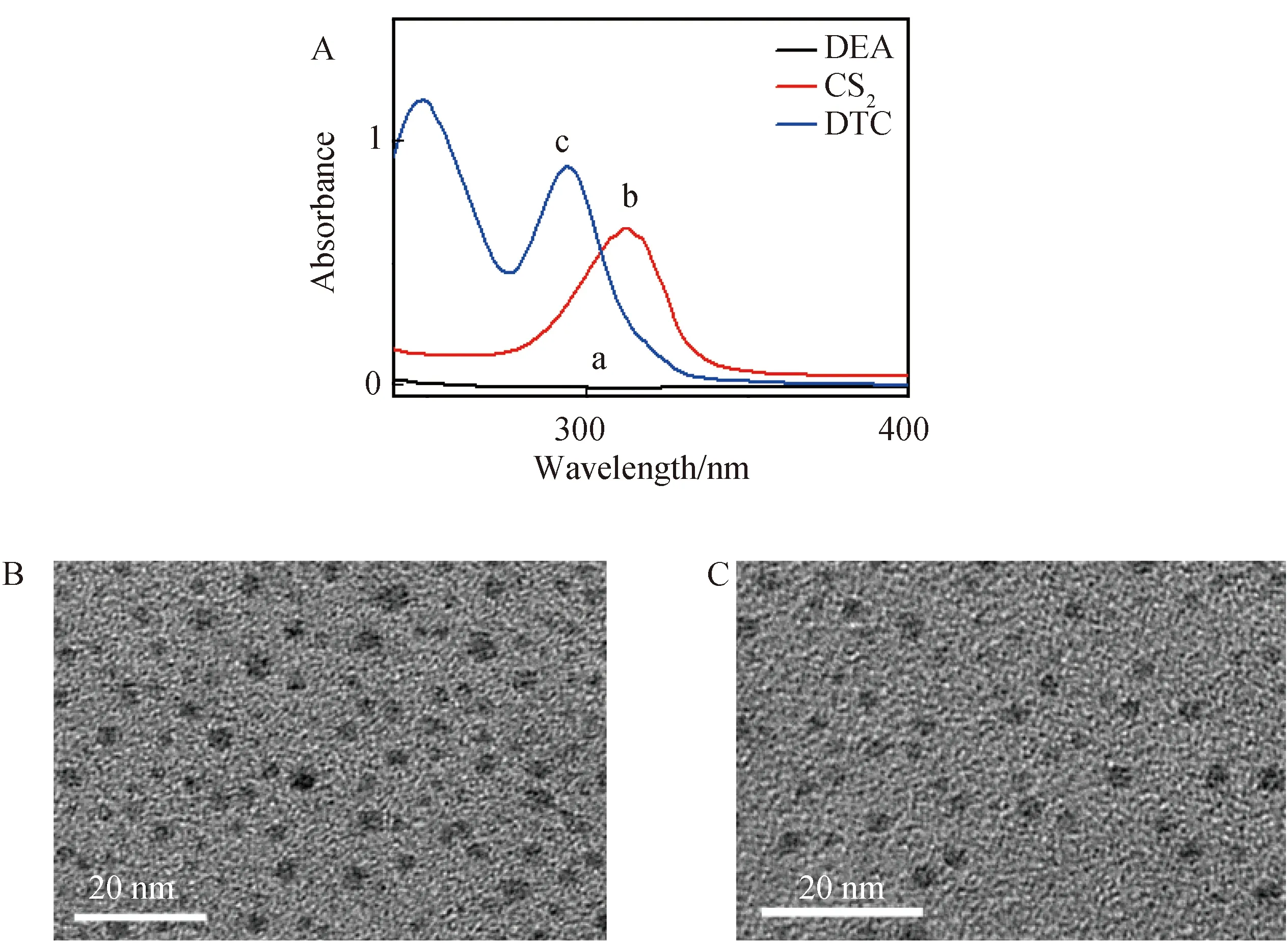
图2 (A)二乙醇胺(a)、CS2(b)和二硫代氨基甲酸酯(c)的UV-Vis吸收光谱和(B)DTC-Au NPs、(C)GQDs的TEM图像
2.2 Pb2+的检测机理利用紫外可见光谱和荧光光谱探究Pb2+的检测机理.如图3A所示,随着Pb2+的加入,DTC-Au NPs紫外吸收发生轻微的蓝移,强度逐渐减小(图3A,曲线b),这是由于Pb2+与DTC-Au NPs上的DTC产生配位使得DTC-Au NPs发生聚集.透射电镜图像进一步证实了Pb2+存在时DTC-Au NPs的聚集:Pb2+存在时,单分散纳米颗粒(图2B)聚集为较大的纳米颗粒(图3B),其原因是Pb2+通过配体DTC的N、O原子与Au NPs表面发生强结合,导致Au NPs的聚集.这种Pb2+-Au的聚集模式可以利用视觉色彩的变化来检测Pb2+.如图3C所示,随着Pb2+的逐渐加入,DTC-Au NPs的颜色由酒红色变为紫色,再变为深蓝色.人眼可见引起颜色变化的Pb2+最低浓度为5 μmol/L.
GQDs的荧光光谱显示其在440 nm处出现最大发射(图3A,曲线c,λex=347 nm),与DTC-Au NPs的最大吸收(图3A,曲线a)部分重叠.当DTC-Au NPs加入到GQDs溶液中后,GQDs的荧光强度显著的降低(图3A,曲线d).这是由于DTC-Au NPs内滤效应(IFE)引起GQDs的荧光猝灭.在DTC-Au NPs/GQDs溶液中加入50 μmol/L Pb2+,GQDs的荧光得到了明显的恢复(图3A,曲线e),这是由于Pb2+诱导了DTC-Au NPs的聚集,减弱了其内滤效应,使得GQDs的荧光恢复;此外,GQDs的荧光发射光谱形状和位置不受Pb2+和DTC-Au NPs加入的影响,表明增加的荧光发射强度来自GQDs,而不是任何其他新形成物种的发射.因此,基于DTC-Au NPs的内滤效应,GQDs荧光发射将受Pb2+浓度的影响,可用于Pb2+浓度的检测.
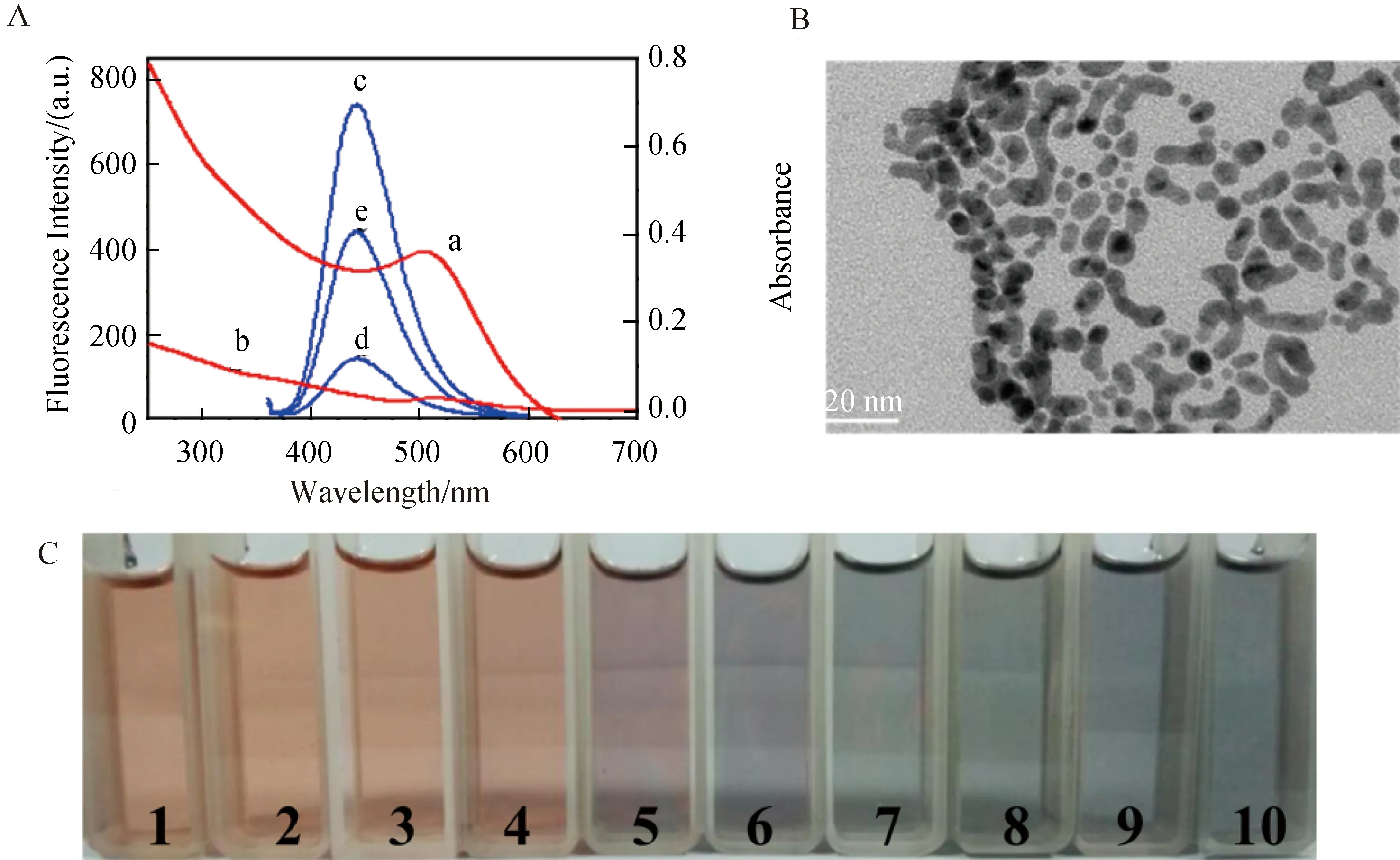
图3 (A)UV-Vis光谱:DTC-Au NPs(a)和DTC-Au NPs中加入50 μmol/L Pb2+(b);荧光发射光谱:0.1 mg/mL GQDs(c),DTC-Au NPs/GQDs(d)和加入50 μmol/L Pb2+时,DTC-Au NPs/GQDs(e).(B)加入10 μmol/L Pb2+的DTC-Au NPs的TEM图像.(C)在DTC-Au NPs中加入不同浓度的Pb2+(1至10∶0.2、0.8、2、5、8、20、50、80和100 μmol/L)后的颜色变化
2.3 Pb2+的线性测定为获得更好地检测Pb2+的效果,优化了反应时间对DTC-Au NPs聚集程度的影响.如图4所示,DTC-Au NPs中加入Pb2+后,DTC-Au NPs于524 nm处的吸收强度迅速降低且在5 min之后保持稳定,使得Pb2+的检测能在相对灵活的时间范围内灵敏和快速地进行.
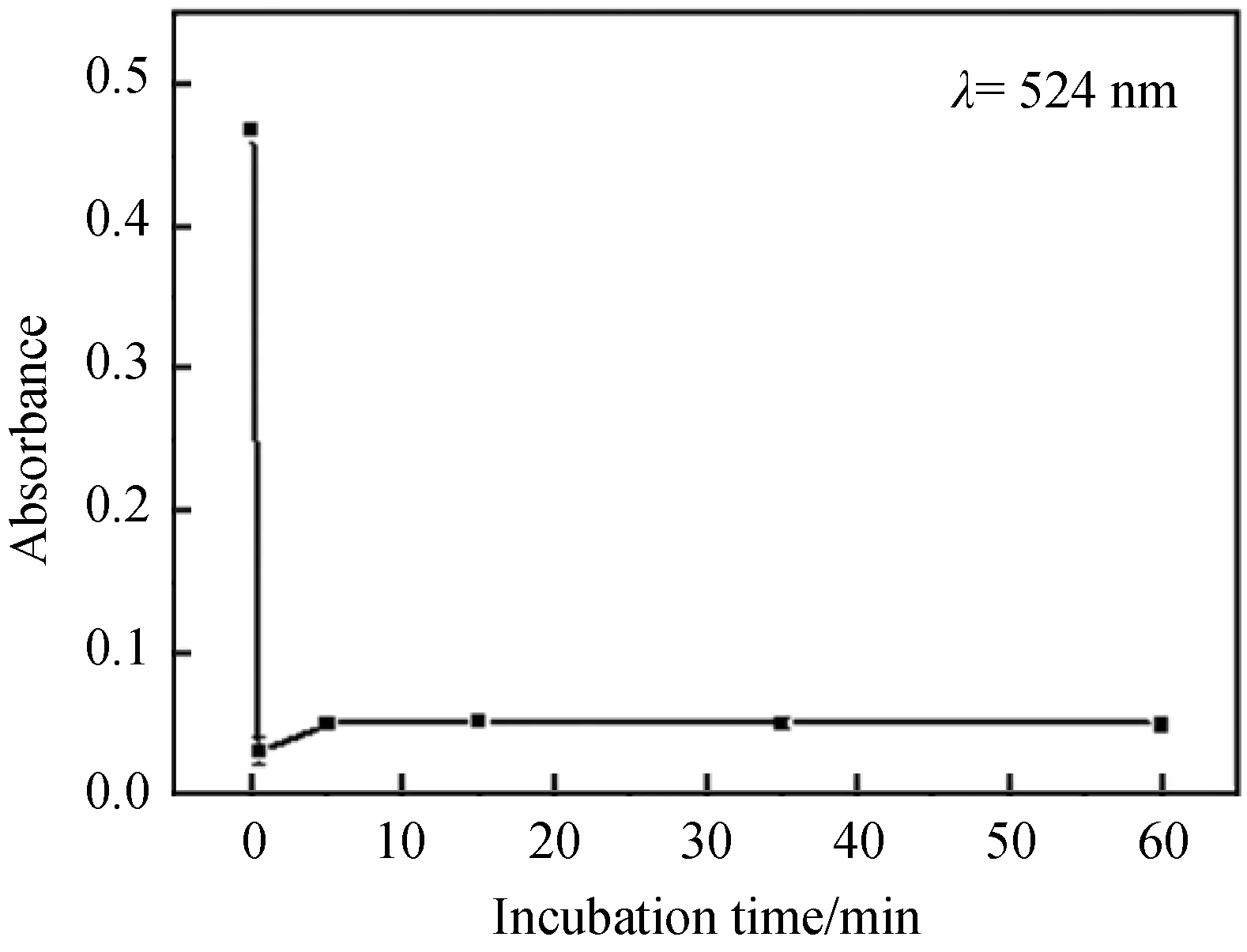
图4 加入Pb2+后,反应时间对DTC-Au NPs吸光度的影响
在最佳条件下,DTC-Au NPs /GQDs的荧光强度随着Pb2+浓度的增加而逐渐增加(图5 A).在0.5~100 μmol/L的范围内,荧光强度增加(ΔF=F-F0)与Pb2+浓度之间具有良好的线性关系(其中F0表示DTC-Au NPs/GQDs的初始荧光强度,F表示DTC-Au NPs/GQDs在Pb2+存在下的荧光强度),线性曲线拟合回归方程为ΔF=4.82c(μmol/L)+ 37.37(R2=0.99,图5B),检测限为0.35 μmol/L(S/N=3).
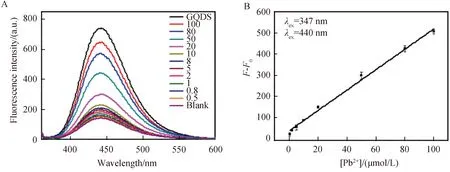
图5 (A)加入不同浓度的Pb2+(从上到下,100、80、50、20、10、8、5、2、1、0.8、0.5和0 μmol/L的DTC-Au NPs/GQDs的荧光光谱和(B)Pb2+的线性关系曲线
2.4 选择性实验为研究探针的选择性,选择些常见的金属离子作为干扰物.如图6 A所示,分别将5 mmol/L的Pb2+、Mn2+、Zn2+、Cd2+、Sr2+、Ba2+、Mg2+、Cu2+加入到3 mL的DTC-Au NPs中,结果表明只有加入Pb2+的DTC-Au NPs的颜色从红色变为了蓝黑色,其他离子基本不影响DTC-Au NPs的聚集.同时,紫外-可见光谱表明,添加其他二价金属离子对DTC-Au NPs的吸收光谱没有明显影响(图6B).结果表明该探针对Pb2+的选择性高于其他金属离子.

图6 在比色皿(A)和UV-vis光谱(B)中加入不同颜色的金属离子后,DTC-Au NPs对Pb2+的选择性
2.5 实际样品中Pb2+的分析检测通过检测自来水样品中的Pb2+,评估了该方法在Pb2+检测中的实际应用.将自来水煮沸冷却至室温,添加已知浓度的Pb2+的标准溶液来进行加标回收测试,每个样品重复测定三次,在相同的实验条件下进行空白实验.结果如表1所示,回收率在93.8%至98.0%之间,相应的相对标准偏差为2.5%至3.5%.实验表明,自来水样品中其他物质对实际样品中Pb2+测定没有明显干扰,该荧光传感器可用于实际样品中Pb2+的分析检测.
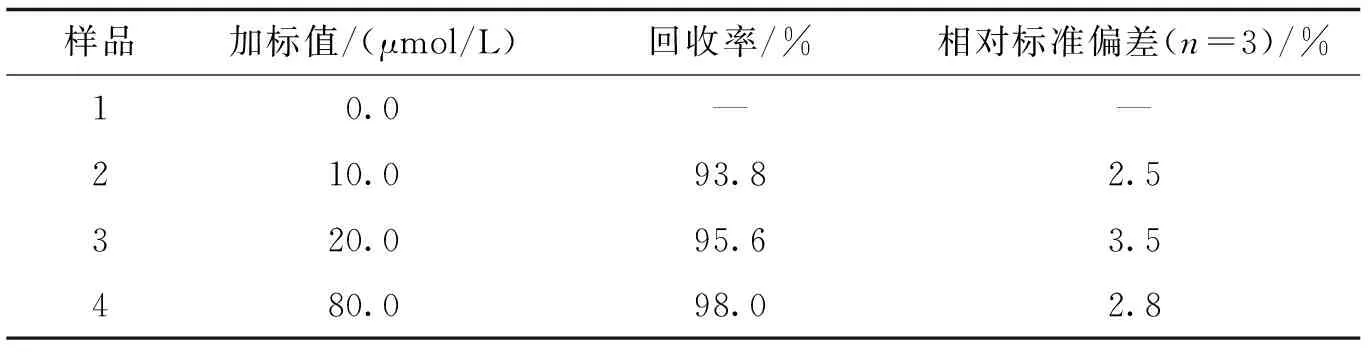
表1 自来水中Pb2+的测定
3 结论
本研究通过简单的方法成功制备了DTC稳定化的Au NPs悬浮液,基于其对GQDs的内滤效应设计了可视化分析检测Pb2+的高选择性和灵敏度的双信号探针.向DTC-Au NPs/GQDs中加入Pb2+时,使GQDs荧光得到大幅恢复.同时,DTC-Au NPs的颜色也会相应地发生一定的变化,这归因于Pb2+和DTC之间的极强的络合作用,以及Au NPs的表面等离子体共振带对Au NPs之间的距离非常敏感的特性.该荧光传感器具有可视化、方便快捷、灵敏度较高、选择性较好以及线性范围相对较宽的优点.整个过程可以在10 min内完成,满足现场快速监测痕量Pb2+的需求.

