川楝子抗炎作用与机制研究
张梦迪 ,杜金城 ,杜钢军*
1.河南大学药学院 药物研究所,河南 开封 475004;2.湖南中医药大学 中医学院,长沙 410208
川楝子,楝科植物川楝(MeliatoosendanSied.etZucc.)的干燥成熟果实,性寒、味苦、有小毒,具有舒肝、行气止痛和驱虫的功效,适用于肝郁化火、胸胁、脘腹胀痛、疝气疼痛、虫积腹痛。临床上主要用于胃病、胁痛、急性乳腺炎、乳痈、带状疱疹、前列腺炎等[1]。关于川楝子驱虫、抗病毒、抗氧化、镇痛等方面药理作用已有相关研究,抗炎方面还未有详细报道。因此,基于网络药理学的分析方法,以此来观察川楝子药物与药理网络之间的相互影响[2]。
中药具有多组分、多靶点、协同作用等特点[3],运用网络药理学对中药活性成分鉴定与筛选,可为中药的药理活性研究提供良好的物质基础[4-5]。本研究在证明川楝子有良好的抗炎作用的基础上,通过网络药理学的方法对川楝子的抗炎作用机制进行分析,为进一步研究其抗炎成分奠定基础。
1 材料
1.1 药品及试剂
药物:川楝子原药材,购于开封市天济大药房,经河南大学药学院丛悦教授鉴定为楝科植物川楝(MeliatoosendanSied.etZucc.)的干燥成熟果实。
川楝子水煎液制备:称取40 g川楝子原药材,加800 mL的蒸馏水浸泡1 h,煎煮30 min,滤出药液,再以相同方式连续煎煮2次。合并3次药液加热浓缩至200 mL,得到川楝子水煎液,每1 mL 水煎液含生药量0.2 g,分装冻存于-80 ℃冰箱,临用前蒸馏水稀释到所需浓度。
试剂:二甲苯500 mL(天津市富晨化学试剂厂,批号20160812)。
1.2 仪器
微量移液器(上海佳安分析仪器厂);FA1004B型电子天平(上海越平科学仪器有限公司);WH-866涡旋振荡器(太仓市科教器材厂)。
1.3 实验动物
健康雄性昆明小鼠,体质量(26±2)g,由河南省医学实验动物中心提供,许可证号SCXK(豫)2015-0002,实验动物合格证号:No.41000100002406,所有动物使用均经河南大学动物实验伦理委员会批准,许可号:HUSAM2016-288。
1.4 分析平台与软件
①中药系统药理学数据库和分析平台TCMSP(http://Isp.nwu.edu.cn/tcmsp.php);②Uni-Prot 数据库 (https://www.uniprot.org/);③PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/);④Swiss TargetPrediction(http://www.swisstargetprediction.ch/);⑤STITCH(http://stitch.embl.de/);⑥蛋白质相互作用分析平台STRING (https://string-db.org/);⑦人类基因组注释数据库DAVID v6.8(https://david.ncifcrf.gov/);⑧网络图形拓扑分析与编辑软件Cytoscape3.2.1。
2 方法
2.1 二甲苯诱导的小鼠耳肿胀
小鼠20只,随机分为2组,每组10只:对照组和川楝子组。川楝子组按小鼠体重4 g/kg(人体表面积等效剂量)灌胃川楝子水煎液,对照组以相同容量灌胃生理盐水,每天1次,连续10 d。第10天小鼠给药30 min后,于各组小鼠右耳正反面均匀涂上二甲苯40 mL 致炎,左耳做对照。涂上二甲苯30 min后,脱臼法处死小鼠,剪下同只小鼠左右耳用直径8 mm 打孔器在同一部位打下耳片,分析天平称重,以两耳片重量差值为耳肿胀度,并计算肿胀抑制率。肿胀抑制率=[(模型组耳平均肿胀度-给药组耳平均肿胀度)/模型组耳平均肿胀度]×100%[6]。
2.2 川楝子活性成分搜集与筛选
在TCMSP数据库中选择“Herb name”项,检索框中输入关键词“川楝子”,得到川楝子所含化合物,根据分子类药性(DL)来进行筛选。本研究以DL≥0.18作为筛选条件,对检索到的川楝子化合物进行筛选,得到活性成分。并从PubChem 数据库获得川楝子活性成分的3D 结构。
2.3 活性成分靶点获取及活性成分-预测靶点网络构建
从TCMSP数据库、Swiss Target Prediction数据库及STITCH 数据库将活性化合物对应的所有靶点导出,通过UniProt将靶点蛋白名转变成基因名。利用Cytoscape 3.2.1 软件进行可视化,建立川楝子活性成分-预测靶点网络以探究川楝子的药理学作用原理及机制。在构建的网络图中,节点(node)代表活性成分、蛋白质或基因等生物分子,节点与节点之间的连接(edge)代表生物分子之间的相互作用。一个节点的度值(degree)表示网络中节点与节点相连的数目,degree越大,这个靶点则越有可能是化合物的关键作用靶点[7]。
2.4 蛋白-蛋白相互作用(PPI)网络构建及核心靶点筛选
一般情况下,蛋白质不会以独立个体的形式实现其生物学功能,而是与其他蛋白通过彼此相互作用,以大分子复合物的形式完成生物学功能,因此蛋白质相互作用的研究、分析是理解生命活动中分子功能、细胞组织、生物过程和信号通路不可缺少的基础条件[8]。为了使靶点蛋白在系统层面的作用更好地表现出来,将活性成分对应的靶点信息导入STRING 数据库,限定物种为“Homo sapiens”,获得PPI的相关信息。从STRING 中下载Excel表格数据,置信度设为≥0.9,将筛后结果导入Cytoscape 3.2.1中,利用CytoNCA 进行分析,筛出核心靶点。
2.5 靶点通路注释分析
利用DAVID 生物信息学资源数据库,对获取的川楝子相关靶点信息进行GO 生物功能和KEGG 通路富集分析,得到靶点相对应的功能分布及生物学通路。
2.6 活性成分-核心靶点-通路网络构建
根据得到的川楝子活性成分信息、核心靶点信息及通路信息,利用Cytoscape软件中的Merge功能构建活性成分-靶点-通路网络。
2.7 统计学方法
采用GraphPad Prism-5统计软件分析处理,实验数据以±s表示,采用单因素方差分析和t检验。P<0.05,表示组间有显著差异。
3 结果
3.1.川楝子的抗炎作用
取小鼠耳片称重后,进行数据分析。对照组耳肿胀度为(0.016 2±0.000 7)g,川楝子组耳肿胀度为(0.006 2±0.000 3)g,肿胀抑制率为61.7%(P≤0.05)。实验结果显示,川楝子有显著的抗炎作用。
3.2 川楝子活性成分筛选
从TCMSP中共获得化合物33个,根据DL>0.18筛选出活性成分18个,见表1。甘露醇(Mandenol)、亚麻酸乙酯(Ethyl linolenate)、β谷甾醇(βsitosterol)、印楝波为定C(Nimbolidin C)、川楝素(Toosendanin)、豆甾醇(Stigmasterol)、苦楝子酮(Melianone)、印楝波为定D(Nimbolidin D)、异槲皮甙(ISOQUERCITRIN)、印楝波为定A(Nimbolin A)、三聚四氟乙烯(Thujopsadiene)、脱氢二苯基醛((+)-Dehydrodiconiferyl aldehyde)、楝叶吴萸素B(evofolin-B)、皮树脂醇(Medioresinol)、芦丁(Rutin)、甜菜酸(Melissic acid)、槲皮素(Quercetin)、正三氯硝醇(n-Triacontanol)。

表1 川楝子活性成分
3.3 川楝子活性成分-靶点蛋白网络构建
获得281个靶点蛋白,通过Uniprot将蛋白名全部转变成基因名。导入Cytoscape软件后,得到川楝子活性成分-靶点网络,见图1。该网络包含299个节点(nodes)和468条边(edges),节点代表化合物与靶点蛋白,边代表化合物和靶点蛋白之间的相互作用关系。网络图中,节点的度值(degree)代表与之相连的路线条数,各节点对应的参数值越大,则说明其在网络中的枢纽作用越重要[9]。从图1中可以看出同一靶点连接多个活性成分,充分体现了川楝子多成分、多靶点的作用特点。
3.4 川楝子靶点蛋白相互作用网络(PPI)构建与分析
使用STRING 数据库,导入已获得的川楝子预测靶点蛋白,限定物种为人源(Homo sapiens),得到靶点蛋白相互作用的相关数据,下载数据文件,设置置信度≥0.9进行筛选。将筛后数据导入Cytoscape软件,绘制相互作用网络图并筛选核心靶点,导出拓扑数据,代表预测靶点蛋白,代表核心靶点,见图2。共涉及219个节点,1 106条边。设置节点度值degree≥36筛选得到4个核心靶蛋白,见表2。转录因子AP-1(JUN)、丝裂原活化蛋白激酶1(MAPK1)、磷脂酰肌醇4,5-二磷酸3-激酶催化亚基α同种型(PIK3CA)、转录因子p65(RELA)。最终结果显示,JUN 的degree值等于54,为所有靶点之最。MAPK1和PIK3CA 的degree值分别为42和41,表明这3个节点为连通网络中其他节点的桥梁,并发挥着关键作用。
3.5 川楝子靶点GO 注释与KEGG 通路分析
通过DAVID 数据库,对川楝子靶点蛋白进行生物功能注释分析(GO)和信号通路分析(KEGG),当P≤0.05时被认为显著富集,以此为条件进行筛选,GO 生物功能注释为34 个、KEGG 通路为63条。经过分析可知,GO 结果显示,川楝子的靶点蛋白主要涉及Fc-epsilon受体信号通路、细胞增殖的积极调节、RNA 聚合酶Ⅱ启动子转录的正调节、调节磷脂酰肌醇3-激酶信号、凋亡过程的负调节、血管生成、MAPK 级联、RNA 聚合酶Ⅱ启动子的转录负调节等生物学功能,见表3。KEGG 通路富集显示,川楝子的抗炎靶点蛋白主要与MAPK 信号通路、B细胞受体信号通路、T 细胞受体信号通路、Toll样受体信号通路、TNF信号通路等通路功能有关,见表4。

图1 川楝子活性成分-靶点蛋白网络
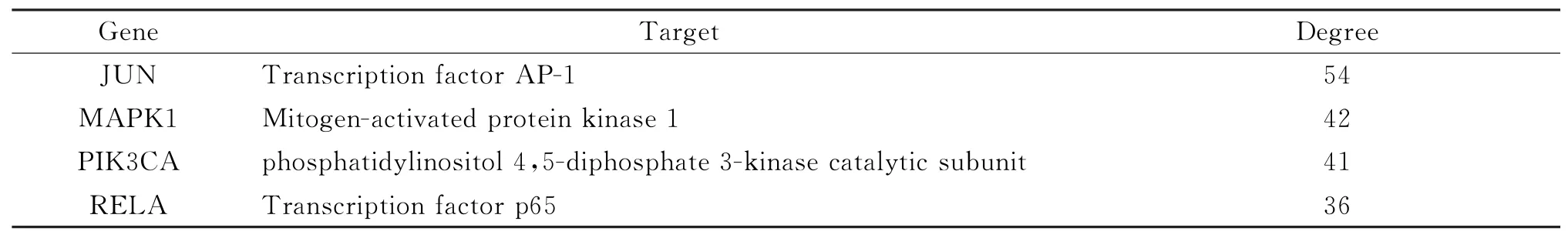
表2 核心靶点蛋白

图2 川楝子靶点蛋白-蛋白相互作用图
3.6 川楝子活性成分-核心靶点-通路网络图分析
使用Cytoscape软件中的Merge功能构建川楝子活性成分-核心靶点-通路网络,显示川楝子活性成分与靶点以及相关作用通路之间的关系,见图3。从图3中可以看出,川楝子阻止炎症通路的共同组分是川楝素、斛皮素及印楝波利丁C。

表3 GO 生物过程

续表3
4 讨论
动物炎症模型是筛选和评价抗炎药物的有效手段。本研究采用小鼠耳肿胀实验表明,川楝子水煎液对实验小鼠有明显抗炎作用。网络药理学为分析中药材多组分疾病防治机制提供了强大的工具。利用网络药理学方法,我们筛出川楝子18种活性成分及281个预测靶点,PPI显示靶点蛋白之间的相互作用关系,筛选出4 个核心靶点分别为JUN、MAPK1、PIK3CA 和RELA。其中,JUN 为原癌基因靶点蛋白、MAPK 是一类进化保守的丝/苏氨酸蛋白激酶,在由机体细胞内在促炎细胞因子或者细胞外界物理刺激等所引发的级联反应中起重要作用。它们调控着许多生理活动,与机体炎症密切相关等[10]。PIK3CA 蛋白阳性表达率与高危型HPV感染率及宫颈癌的发生密切相关[11],也与炎症密切相关。KEGG 显示,预测的川楝子抗炎靶点主要富集在MAPK 信号通路、Toll样受体信号通路和TNF信号通路等。已有报道[12]研究,MAPK 信号传导介导炎症反应;肿瘤坏死因子TNF 在细胞相关的增殖、分化等生物过程及免疫和炎症反应方面起着不容忽视的作用;Toll样受体信号通路可诱导炎症因子的表达等,这可能是川楝子抗炎的主要机制。川楝子活性成分-核心靶点-通路网络显示川楝子阻止炎症通路的共性成分是川楝素、斛皮素及宁玻利丁C,与文献[13-14]报道的研究内容相符。有研究[15]表明,经过不同方法炮制的川楝子,抗炎镇痛的作用有所区别,而导致这种不同的内在因素及深层机制机理,需要结合已获得的靶点、生物途径及信号通路进行探究。
综上所述,川楝子抗炎活性成分可能是川楝素、斛皮素及宁玻利丁C,其抗炎作用可能与影响JUN、MAPK1、PIK3CA、RELA 等靶点蛋白阻止MAPK 信号、TNF信号及Toll样受体等炎症通路有关。

