外周血淋巴细胞亚群比例紊乱与帕金森病的相关性研究
王玉玲 姚亚妮 高华

[摘要] 目的 通過检测帕金森病(PD)患者外周血中各淋巴细胞亚型的百分率差异,探讨神经免疫机制与PD发生的相关性。 方法 应用荧光染色法测定新疆医科大学第一附属医院(以下简称“我院”)2014年6月—2017年7月收治的原发性PD患者(病例组,83例)及同期我院健康体检者(对照组,100名)外周血中CD3+、CD4+、CD8+、CD19+、CD56+、Fas、Tregs细胞百分率差异,并进一步分析病例组患者是否服用药物复方左旋多巴、Hoehn-Yahr(HY)分级差异与各淋巴细胞亚群变化相关性。 结果 病例组CD3+、CD4+、CD8+低于对照组,CD56+细胞、Fas和Tregs阳性亚群高于对照组,差异有高度统计学意义(P < 0.01)。服药组Fas和Tregs细胞亚群低于未服用组,差异有统计学意义(P < 0.05)。相关性分析显示,Fas和Tregs阳性细胞数与HY分级呈正相关(r = 0.620、0.761,P < 0.05)。结论 PD患者外周血各淋巴细胞亚群存在比例紊乱,其中Fas及Tregs细胞比例与PD患者病情严重程度有关,对于未口服复方左旋多巴治疗的PD患者该比例会进一步升高。
[关键词] 帕金森病;死亡受体;T淋巴细胞;B淋巴细胞;Tregs细胞
[中图分类号] R749.1 [文献标识码] A [文章编号] 1673-7210(2020)09(b)-0049-04
[Abstract] Objective To explore the correlation between neural immune mechanisms and the occurrence of Parkinson′s disease (PD) by detecting the percentage differences of lymphocyte subtypes in peripheral blood of patients with PD. Methods Fluorescence staining method was used to determine the periphery of primary PD patients (case group, 83 cases) admitted to the First Affiliated Hospital of Xinjiang Medical University (“our hospital” for short) from June 2014 to July 2017 and healthy physical examination patients (control group, 100 cases) in our hospital during the same period, while the differences in the percentage of CD3+, CD4+, CD8+, CD19+, CD56+, Fas and Tregs cells in the blood were measured, and the correlation between whether the patients in the case group took the drug Compound Levodopa, Hoehn-Yahr (HY) grade difference and the changes of lymphocyte subsets were analyzed. Results CD3+, CD4+, and CD8+ in the case group were lower than those in the control group, while the positive subsets of CD56+ cells, Fas and Tregs were higher than those in the control group, and the differences were highly statistically significant (P < 0.01). Fas and Tregs cell subsets in the medication group were lower than those in the non-administration group, and the differences were statistically significant (P < 0.05). Correlation analysis showed that the number of Fas and Tregs positive cells were positively correlated with HY grade (r = 0.620, 0.761, P < 0.05). Conclusion Peripheral blood lymphocyte subsets of PD patients have a disorder in the proportions. The the proportion of Fas and Tregs cells are related to the severity of the disease in PD patients. For PD patients who are not treated with oral Compound Levodopa, the proportion will further increase.
[Key words] Parkinson′s disease; Death receptor; T lymphocyte; B lymphocyte; Tregs cell
帕金森病(Parkinson′s disease,PD)的病理改变主要以多巴胺(dopamine,DA)能神经元变性坏死为基础导致的锥体外系功能障碍[1]。尸检发现中枢神经系统毛细血管壁基底膜增厚并伴有CD4+、CD8+等T淋巴细胞浸润[2]。研究显示[3-4],免疫系统激活后,可以通过Fas阳性T细胞与配体结合诱导包括神经细胞在内的多种细胞凋亡,与乳腺癌、阿尔兹海默病等多种疾病发生有关。当大量炎症因子如白细胞介素2(interleukin 2,IL-2)释放入血时,调节性T细胞(regular T cell,Treg)通过竞争性消耗IL-2,下调CD4+T细胞IL-2R链的转录与表达,从而抑制靶细胞的增殖,同时Treg细胞分泌转化生长因子β(transforming growth factor β,TGF-β)等进一步抑制CD4+T细胞的活化,发挥其免疫负调控功能[5-7]。鉴于PD发生过程中存在复杂的神经免疫紊乱。因此,本研究拟抽取PD患者及健康体检者外周血,测定并分析外周血各淋巴细胞亚群的变化,探讨其与PD发生机制的相关性。
1 资料与方法
1.1 一般资料
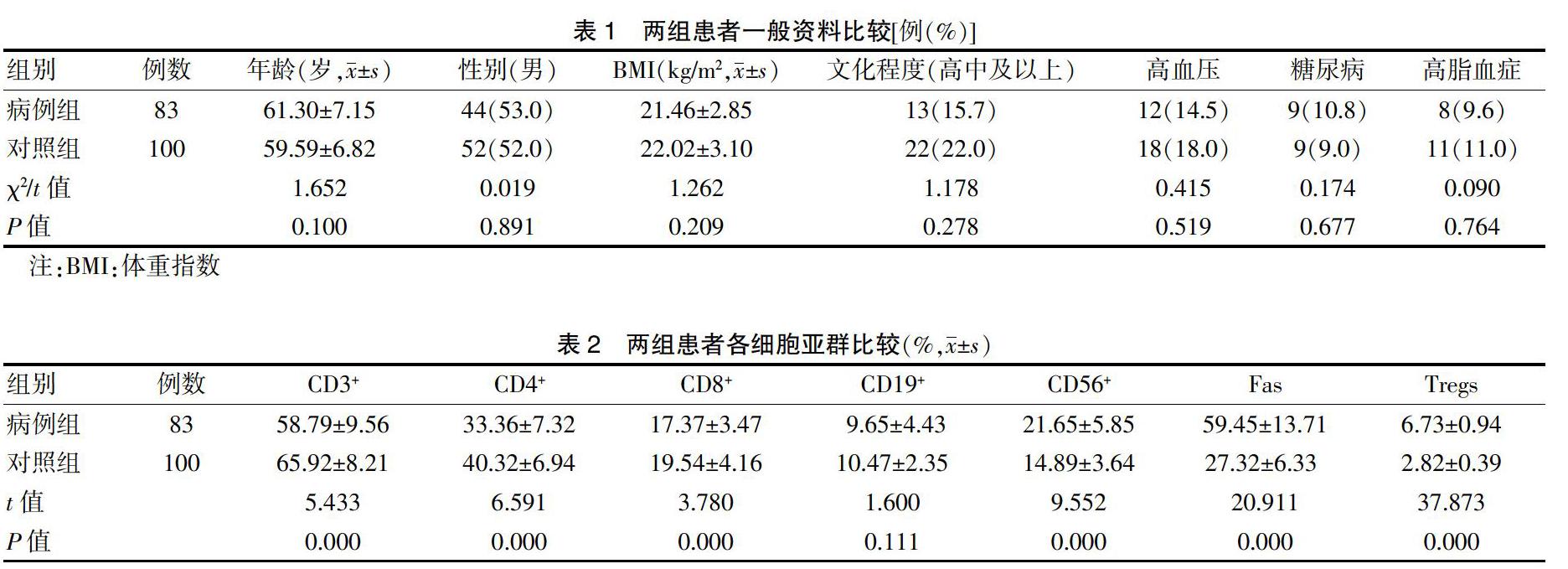
选取2014年6月—2017年7月新疆医科大学第一附属医院(以下简称“我院”)收治的原发性PD患者83例为病例组,年龄(61.30±7.15)岁;所有患者均符合英国PD协会的诊断标准[8]。排除标准:脑外伤、脑炎、锥体束受损、脑肿瘤等继发性PD患者。选择我院同期与病例组年龄和性别相匹配的体检者100名作为对照组,年龄(59.59±6.82)岁。收集两组人群体重指数(body mass index,BMI)、文化程度、既往病史等一般临床数据。
1.2 方法
病例组根据是否口服复方左旋多巴(每片250 mg,上海罗氏制药有限公司,国药准字:H10930198),分为服药组(63例)与非服药组(23例)。服药方法:首次0.5片,2~3次/d,以后每周日服量增加1/2片,直至控制症状(最多不超过5片)。另根据Hoehn-Yahr(HY)分级[9]不同,将病例组进一步分为HY 1~5级。
1.3 淋巴细胞及自然杀伤细胞(NK)检测
空腹抽取静脉血2 mL于抗凝管中。各取血100 μL置于7个试管中,分别加入CD3、CD4、CD8、CD19、CD56、Fas、Tregs抗体(美国Cell Signaling Technology公司和美国BD公司)各5 μL。保留1个空白对照试管,放置于20℃避光孵育20 min。后加入2 mL红细胞裂解液,震荡后避光孵育10 min。最后加入1 mL的磷酸缓冲盐溶液进行稀释后,低速2000 r/min离心5 min(离心半径6 cm),使用流式细胞仪(美国BD公司)进行检测。
1.4 统计学方法
运用SPSS 19.0软件对所得数据进行统计分析。計量资料以均数±标准差(x±s)表示,采用t检验。计量资料以例数或百分比表示,采用χ2检验。相关性采用Spearman秩相关性分析。以P < 0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料及各细胞亚群比较
两组患者年龄、性别、BMI、文化程度及合并症比较,差异无统计意义(P > 0.05),具有可比性。见表1。病例组CD3+、CD4+、CD8+低于对照组,CD56+细胞、Fas和Tregs阳性亚群高于对照组,差异有高度统计学意义(P < 0.01)。见表2。
2.2 不同服药方式患者各细胞亚群比较
服药组Fas和Tregs细胞亚群低于未服用组,差异有统计学意义(P < 0.05)。见表3。
2.3 各细胞亚群不同HY分级差异及相关性分析
CD56+细胞亚群在不同HY分级中比较,差异有统计学意义(P < 0.05),进一步两两比较,HY 3级CD56+细胞亚群显著高于HY 1级患者,差异有统计学意义(P < 0.05),其他细胞亚群在不同HY分级中比较,差异无统计学意义(P > 0.05)。相关性分析显示,Fas和Tregs阳性细胞数与HY分级呈正相关(r = 0.620、0.761,P < 0.05)。见表4。
3 讨论
PD最主要的病理特征即DA神经元退行性变,其机制尚未阐明[10]。近年来,神经免疫机制学说逐渐得到人们的重视。研究显示[11-13],全身免疫体统的激活可导致外周血大量促炎性因子释放、外周T淋巴细胞亚群进入神经系统后激活小胶质细胞,引起大量毒性分子分泌,进一步加速了DA细胞凋亡及进程。在本研究中,与对照组比较,病例组PD患者外周血CD3+T、CD4+T、CD8+T低于对照组;相反,Fas和Tregs阳性T细胞的数量却高于对照组。分析相关原因,CD3+T、CD4+T、CD8+T亚群通常被称为辅助性T细胞,在MTPT诱导的PD大鼠模型中,辅助性T细胞可通过Fas阳性T细胞与配体FasL结合诱导DA细胞的凋亡[14-15]。但免疫应答与免疫耐受的平衡是维持人体内环境稳态的关键,在辅助性T细胞大量活化的同时,IL-2信号通过刺激Treg细胞,使Treg细胞中AKT的磷酸化路径明显受到抑制,AKT磷酸化促进细胞生长的作用被减弱,间接抑制上述辅助性T细胞的增殖,减少机体的免疫应答[16-19]。
在对药物的分层研究中,服药组Fas及Tregs细胞低于未服用组。研究显示,在PD患者及时补充DA后,放射性示踪显影提示PD患者神经系统DA转运体受体及DA转运体较未服药组增加,提示DA对PD患者神经元的保护作用可能与促进上述转运体和受体途径有关,而免疫损伤作用之一就是辅助性T细胞调节下游Fas+T细胞增殖,促进DA神经元凋亡[20],故口服左旋多巴的患者Fas+T数量减低可能与DA对于神经元的保护机制有关。在免疫应答相对减弱的同时,Treg细胞下降可能涉及PD患者口服左旋多巴后神经保护效应增强有关[21],具体机制还有待于进一步深入研究。
对各细胞亚群与PD患者HY分级的相关性分析发现,Fas和Treg增加与HY分级程度呈正相关性,提示Fas和Tregs各自在机体整个免疫细胞中的比例紊乱与PD的病情进展有关[22]。随着病程的进展,免疫应答涉及的Fas+T细胞增殖介导的凋亡路径活化,而Treg细胞数量增加可能是免疫耐受缓解炎症反应增强的一种保护性调节,故PD患者外周血免疫细胞亚群比例紊乱涉及免疫损伤及免疫耐受相关的多个机制。
综上所述,淋巴细胞亚群的失衡与PD存在密切的相关性,其中涉及到了诸多免疫损伤及免疫耐受相关的改变,故对于淋巴细胞亚群与PD的联系还需要进一步从分子学角度深入探索。
[参考文献]
[1] Michel PP,Hirsch EC,Hunot S. Understanding dopaminergic cell death pathways in Parkinson disease [J]. Neuron,2016,90(4):675-691.
[2] Ide K,Yamada H,Umegaki K,et al. Lymphocyte vitamin C levels as potential biomarker for progression of Parkinson′s disease [J]. Nutrition,2015,31(2):406-408.
[3] Cen L,Yang C,Huang S,et al. Peripheral lymphocyte subsets as a marker of Parkinson′s disease in a Chinese population [J]. Neurosci Bull,2017,33(5):493-500.
[4] Rocha NP,Assis F,Scalzo PL,et al. Reduced activated T lymphocytes (CD4+ CD25+) and plasma levels of cytokines in Parkinson′s disease [J]. Mol Neurobiol,2018, 55(2):1488-1497.
[5] Shrestha S,Yang K,Guy C,et al. Treg cells require the phosphatase PTEN to restrain TH1 and TFH cell responses [J]. Nat Immunol,2015,16(2):178-187.
[6] Spence A,Klementowicz JE,Bluestone JA,et al. Targeting Treg signaling for the treatment of autoimmune diseases [J]. Curr Opin Immunol,2015,37:11-20.
[7] Chinen T,Kannan A,Levine A,et al. An essential role for the IL-2 receptor in Treg cell function [J]. Nat Immunol,2016,17(11):1322-1333.
[8] Hughes AJ,Daniel SE,Kilford L,et al. Accuracy of clinical diagnosis of idiopathic Parkinson′s disease:a clinico-pathological study of 100 cases [J]. J Neurol Neurosurg Psychiatry,1992,55(3):181-184.
[9] Hoehn MM,Yahr MD. Parkinsonism:onset,progression,and mortality [J]. Neurology,1967,17(5):427.
[10] Maetzler W,Berg D. Changing views after 200 years of Parkinson disease [J]. Nat Rev Neurol,2018,14(2):70-72.
[11] Spittau B. Interleukin 4-induced neuroprotection and regulation of microglia activation as a therapeutic approach in the MPTP model of Parkinson′s disease [J]. Neural Regen Res,2017,12(9):1433-1434.
[12] 孫雪婷,李可为,余刚.帕金森病免疫炎症机制的研究进展[J].中华神经科杂志,2019,52(8):670-673.
[13] 杨毅,韩晨阳,郭丽,等.帕金森病患者外周血中辅助性T细胞亚群Th9及其细胞因子白细胞介素9的研究[J].中华神经科杂志,2018,51(3):171-174.
[14] Feng J,Feng L,Zhang G. Mitochondrial damage in hippocampal neurons of rats with epileptic protein expression of Fas and caspase-3 [J]. Exp Ther Med,2018,16(3):2483-2489.
[15] 夏欢,罗琴,王玉玲,等.帕金森病多巴胺细胞凋亡与Fas基因表达的机制研究[J].中国医药导报,2019,16(34):4-6.
[16] Overacre AE,Vignali DA. Treg stability:to be or not to be [J]. Curr Opin Immunol,2016,39:39-43.
[17] Wyss L,Stadinski BD,King CG,et al. Affinity for self antigen selects Treg cells with distinct functional properties [J]. Nat Immunol,2016,17(9):1093-1101.
[18] Damo M,Joshi N S. Treg cell IL-10 and IL-35 exhaust CD8+ T cells in tumors [J]. Nat. Immunol,2019,20:674-675.
[19] Fasching P,Stradner M,Graninger W,et al. Therapeutic Potential of Targeting the Th17/Treg Axis in Autoimmune Disorders [J]. Molecules,2017,22(1):134.
[20] Nasi G,Ahmed T,Rasini E,et al. Dopamine inhibits human CD8+ Treg function through D1-like dopaminergic receptors [J]. J Neuroimmunol,2019,332:233-241.
[21] Guan YQ,Zhao CS,Zou HQ,et al. Aging,rather than Parkinson′s disease,affects the responsiveness of PBMCs to the immunosuppression of bone marrow mesenchymal stem cells [J]. Mol Med Rep,2019,19(1):165-176.
[22] 栗永生,薛莉,韓珣,等.Fas相关死亡结构域蛋白基因沉默对帕金森病模型鼠黑质凋亡相关蛋白的影响[J].中华神经科杂志,2012,45(9):659-663.
(收稿日期:2020-01-14)

