基于盆栽试验的苯并噻唑硫酮对感染青枯病烟株根围土壤细菌群落结构的影响
向立刚,汪汉成,郭 华,李芝义,郑 苹,蔡刘体,余知和
1.贵州省烟草科学研究院,贵阳市龙滩坝路29号 550081 2.长江大学生命科学学院,湖北省荆州市荆秘路88号 434025 3.贵州省疾病预防控制中心,贵阳市八鸽岩路101号 550004 4.荆州市荆州区马山镇农业技术服务中心,湖北省荆州市荆州区马山镇马南路28号 434031
烟草青枯病是由青枯雷尔氏菌(Ralstonia solanacearum)引起的一种典型的细菌性土传病害[1],该病传播速度快、分布范围广,在我国各烟区均有发生,是烟草生产中常见的病害之一[2]。由于烟叶生产中的连作、农药化肥过量使用,造成土壤理化性质改变、化感自毒物质增加、病虫害发生加剧[3-5]。研究表明,烟草连作年限越长,烟田土壤细菌多样性与均一度越低,青枯病发生越严重[6-8]。而合理轮作能提高烟田土壤品质,改善土壤微生物环境[9-11]。常见轮作模式有烤烟—油菜[12]、烤烟—小麦[13]、烤烟—马铃薯[14]和烤烟—玉米[15]等。王欣英等[16]试验表明,玉米根系分泌物具有抑制烟草疫霉菌孢子萌发作用,通过烤烟—玉米轮作能调节土壤理化性质、改善微生物群落结构,减少烟田土壤病害的发生率。孟玉芳等[17]研究发现,玉米根系分泌物能在短时间内杀死烟草疫霉游动孢子,并抑制其萌发,进而减轻烟草疫霉菌对烟株的侵染。玉米根系分泌物中对土壤病原菌起抑制作用的主要成分为苯并嗪类化合物丁布及其降解产物[18]。3-甲基-2(3H)苯并噻唑硫酮(简称苯并噻唑硫酮)作为玉米根系分泌物之一,本课题组在前期青枯病防治研究中发现,其灌根处理对烟草青枯病有较好的防治作用,而目前有关苯并噻唑硫酮防治烟草青枯病应用研究尚鲜见报道。细菌作为土壤微生物的重要组成部分,在物质循环和能量代谢方面发挥着重要作用,土壤细菌群落结构的稳定性和多样性与植物正常生长发育及病害防治密切相关[19-20]。为此,采用Illumina MiSeq高通量测序技术对苯并噻唑硫酮灌根前后感染青枯病烟株根围土壤细菌群落结构进行分析,旨在明确苯并噻唑硫酮对土壤细菌群落结构的影响,为有效防治烟草青枯病提供依据。
1 材料与方法
1.1 试验材料
供试烟草品种为K326;青枯菌菌株由贵州省烟草科学研究院植保团队分离获得;盆栽土壤采自贵州省烟草科学研究院福泉基地(107°30′41″E,26°44′48″N)近3年无土传病害发生的烟田。苯并噻唑硫酮(M30000-25G,美国SIGMA-ALDRICH公司);DNA试剂盒为 E.Z.N.A.®Soil DNA Kit(D4015-1,美国OMEGA公司);超微量核酸定量光谱仪(NanoDrop 2000,美国 Thermo Fisher Scientific公司)。
1.2 方法
1.2.1 盆栽试验
将供试烟草种子播种于装有育苗基质的专用漂浮育苗盘中,土壤风干混匀后分装至盆钵中,每盆9.5 kg,40 d后将育苗盘中的烟苗移栽至盆钵(外径×高=31.2 cm×19.5 cm)中。盆栽烟株置于开放的自然环境中,按常规进行栽培管理,每5 d浇水和施肥1次。
1.2.2 试验处理与样品采集
烟株移栽后第26天,选取20株长势均匀的烟株,用1.0×108CFU/mL的青枯菌菌液灌根,每株的菌液用量50 mL,沿烟株茎基部灌入,并用铁锨在根部人为制造伤口,便于病菌侵染。接菌2 d后配制苯并噻唑硫酮药液,取0.2 g苯并噻唑硫酮原药溶于10 mL无水乙醇中,待药剂完全溶解后加入990 mL灭菌蒸馏水配制成1 L药液。将20株烟随机分为2组,处理(JY)为100 mL苯并噻唑硫酮药液灌根,对照(CK)为100 mL灭菌蒸馏水灌根。
处理与对照各随机选取3株烟并作标记,参照闫欢等[21]根围土壤的采集方法,分别于灌根处理当天(0 d)、灌根后2、7、20和40 d采集烟株根围土壤样品,采集样品编号见表1。采集样品迅速装入无菌取样袋中,带回试验室置于-80℃冰箱中保存、备用。烟草青枯病等级分类参照GB/T 23222—2008[22]。
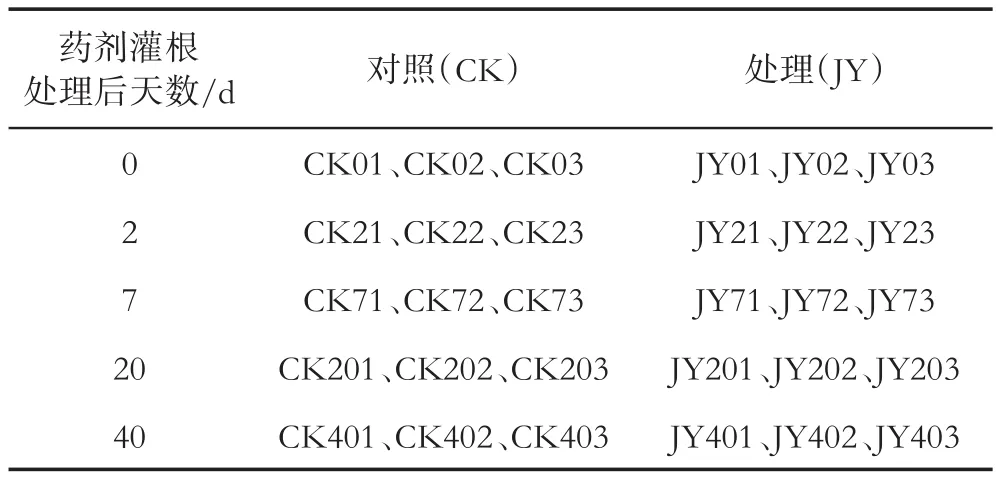
表1 采集样品编号Tab.1 Serial numbers of collected samples
1.2.3 样品DNA提取、扩增和测序
每个土壤样品混合均匀后取0.5 g,采用DNA试剂盒提取样品DNA,具体步骤按其操作说明书进行。采用超微量核酸定量光谱仪检测提取的DNA浓度与纯度,并用无菌水将样品DNA稀释至20 ng/μL。
以样品DNA为模板,采用引物338F(5'-ACTC CTACGGGAGGCAGCAG-3')和 806R(5'-GGACT ACHVGGGTWTCTAAT-3')扩增细菌16S rRNA基因的V3~V4可变区。PCR扩增体系及反应程序参照谢红炼等[23]的方法进行。PCR扩增产物用2%的琼脂糖凝胶电泳检测。纯化后样品由上海美吉生物医药科技有限公司利用Miseq PE300平台(美国Illumina公司)进行高通量测序。
1.2.4 数据处理
使用Trimmomatic软件[24]对原始序列进行过滤质控去除低质量的序列,然后使用FLASH软件[25]进行序列拼接。使用UPARSE软件[26]对相似度≥97%的序列进行操作分类单元(OTU)聚类,并在聚类过程中去除单序列和嵌合体。利用RDP classifier[27]将每条序列与 Silva数据库比对进行物种分类与注释。通过对样品序列进行Alpha多样性分析和物种组成分析等评估苯并噻唑硫酮对青枯病发病烟株根围土壤细菌群落结构的影响。
2 结果与分析
2.1 苯并噻唑硫酮对青枯病的防治效果
接菌后第9天(灌根处理第7天),对照的部分烟株出现明显青枯病症,第30天时对照烟株发病程度十分严重,到第40天时烟株已全部萎蔫变黄,对照的10株烟经灭菌蒸馏水灌根后不同时期的病级和病情指数见表2。经苯并噻唑硫酮灌根处理的烟株试验过程中未出现青枯病症状,且生长良好。说明苯并噻唑硫酮灌根处理对烟草青枯病有较好防治效果。

表2 对照烟株青枯病的病级调查Tab.2 Disease levels of tobacco bacterial wilt for the check tobacco plants
2.2 高通量测序深度与数据分析
由稀释曲线(图1)可以看出,本试验中10组共30个样品测序reads数均在30 000以上,样本Sobs多样性指数稀释曲线在测序reads数为30 000时已趋于平缓,说明此次测序数据量合理,测序结果能够满足后续样品间细菌群落结构变化的比对分析要求,更多的reads只能产生少量的新OTU。
原始数据优化处理后对照共获得754 945条高质量序列片段,21 974 378个碱基,单一样品序列数在44 559~61 236条之间,平均序列数为50 329条,序列平均长度为437 bp;处理共获得868 433条高质量序列片段,25 233 613个碱基,单一样品序列数在51 463~69 131条之间,平均序列数为57 895条,序列平均长度为436 bp。
2.3 OTU聚类分析
表3显示,通过对不同分类水平上鉴定出的种系统计表明,对照样品中共鉴定到细菌的37个门、99个纲、213个目、399个科、799个属、1 686个种、4 882个OTU;处理样品中鉴定到细菌的38个门、97个纲、213个目、402个科、814个属、1 695个种、4 863个OTU。
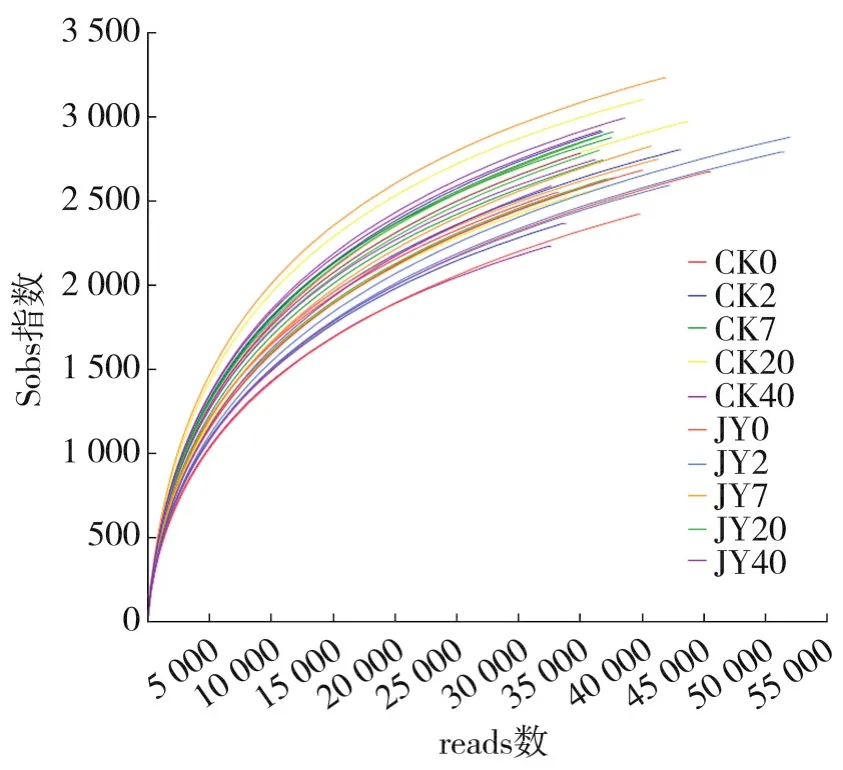
图1 稀释曲线(OTU水平Sobs指数)Fig.1 Rarefaction curve(Sobs index at OTU level)
2.4 细菌Alpha多样性指数分析
Alpha多样性指数中Sobs和Chao1指数反映群落丰富度,香农指数(Shannon)和辛普森指数(Simpson)反映群落多样性[28]。表 4显示,对照与处理根围土壤细菌的Sobs和Chao1指数呈现先增后减的趋势,试验第7天细菌丰富度达到最高,之后开始降低。苯并噻唑硫酮灌根当天处理细菌丰富度指数小于对照,试验第40天处理丰富度指数大于对照。土壤细菌多样性指数在处理后5个时期中除第40天外,其余4个时期的Shannon值均低于对照,处理5个时期的Simpson值均高于对照,表明前4个时期对照细菌群落多样性高于处理,第40天时对照细菌多样性低于处理。处理与对照5个时期的样品覆盖度指数(Coverage)均在97%以上,说明样品中序列被检测出的概率高,测序结果能够代表样本中细菌群落的真实情况。
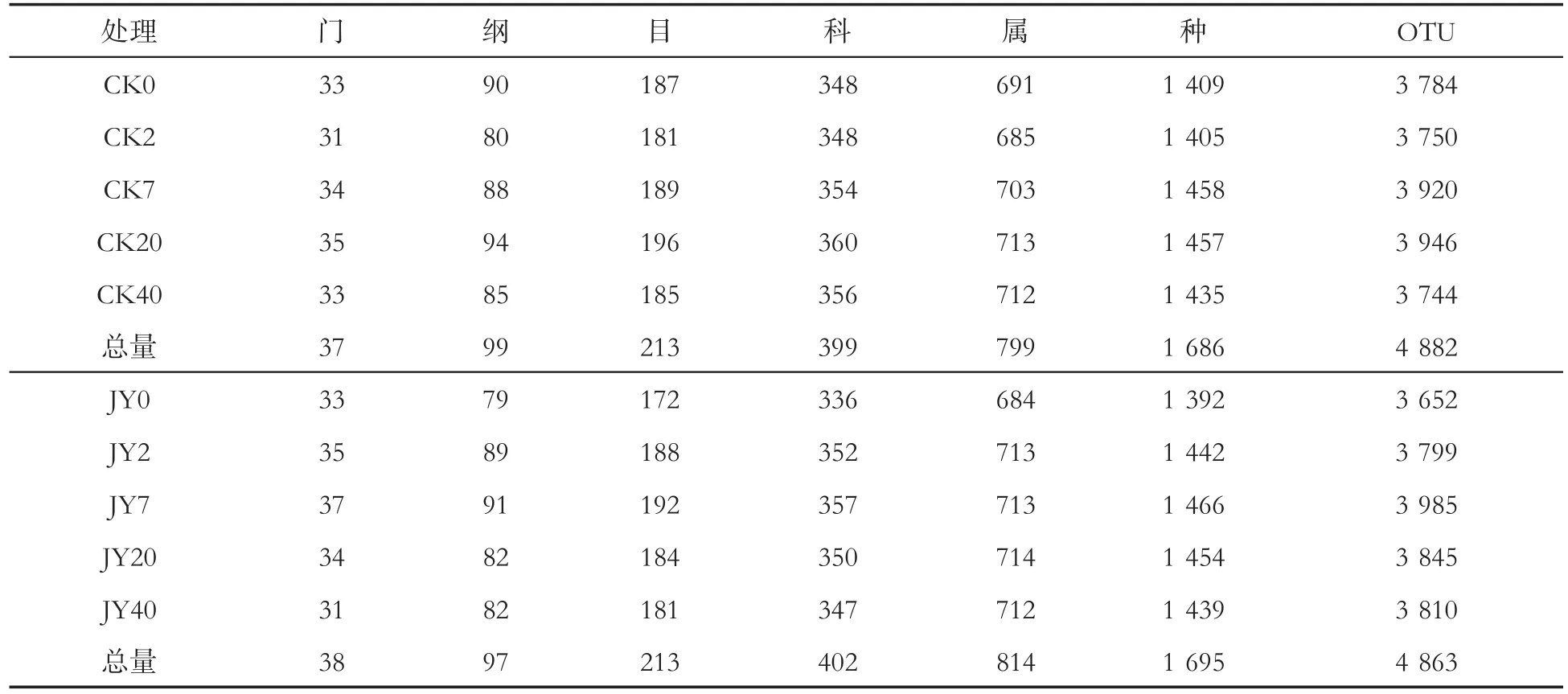
表3 灌根处理后不同时期烟株根围土壤细菌总量比较Tab.3 Comparison of total amount of bacteria in rhizospheric soil of tobacco plants at different stages after root irrigation(个)
2.5 细菌群落分析
在门水平,对照与处理样品的细菌群落组成相似。其主要菌门包括变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)、Saccharibacteria、蓝细菌门(Cyanobacteria)、硝化螺旋菌门(Nitrospirae)和疣微菌门(Verrucomicrobia)等,但在灌根处理后不同时期与对照各菌门相对丰度存在差异,见表5。
对照烟株根围土壤中变形菌门和拟杆菌门相对丰度显著降低;绿弯菌门和厚壁菌门相对丰度显著提高;放线菌门、酸杆菌门、芽单胞菌门、浮霉菌门、蓝细菌门和硝化螺旋菌门相对丰度略有上升,Saccharibacteria和疣微菌门相对丰度略有降低。苯并噻唑硫酮处理烟株根围土壤中变形菌门、拟杆菌门和Saccharibacteria相对丰度显著降低;放线菌门、绿弯菌门和厚壁菌门相对丰度显著升高;酸杆菌门、芽单胞菌门、浮霉菌门、蓝细菌门、硝化螺旋菌门和疣微菌门相对丰度略微升高。表明苯并噻唑硫酮能显著提高放线菌门相对丰度,显著降低Saccharibacteria菌门相对丰度,而对于其他细菌门类影响较小。
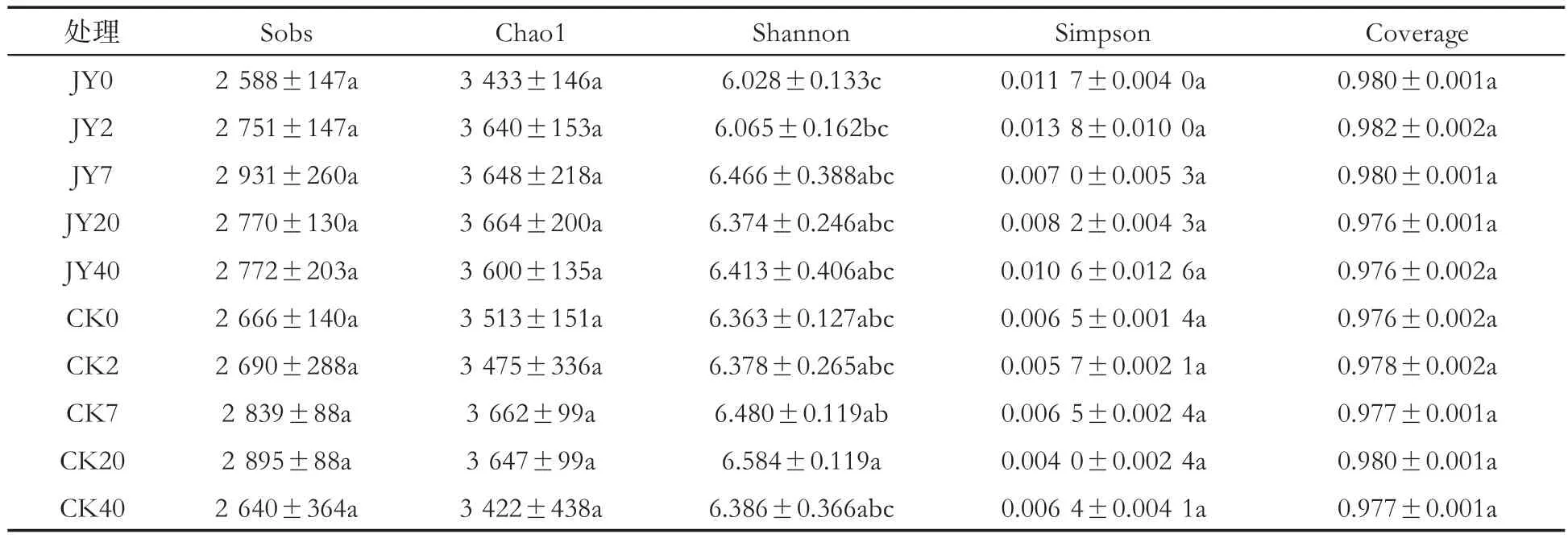
表4 灌根处理后不同时期烟株根围土壤细菌的Alpha多样性指数比较①Tab.4 Comparison of Alpha diversity index of bacteria in rhizospheric soil of tobacco plants at different stages after root irrigation
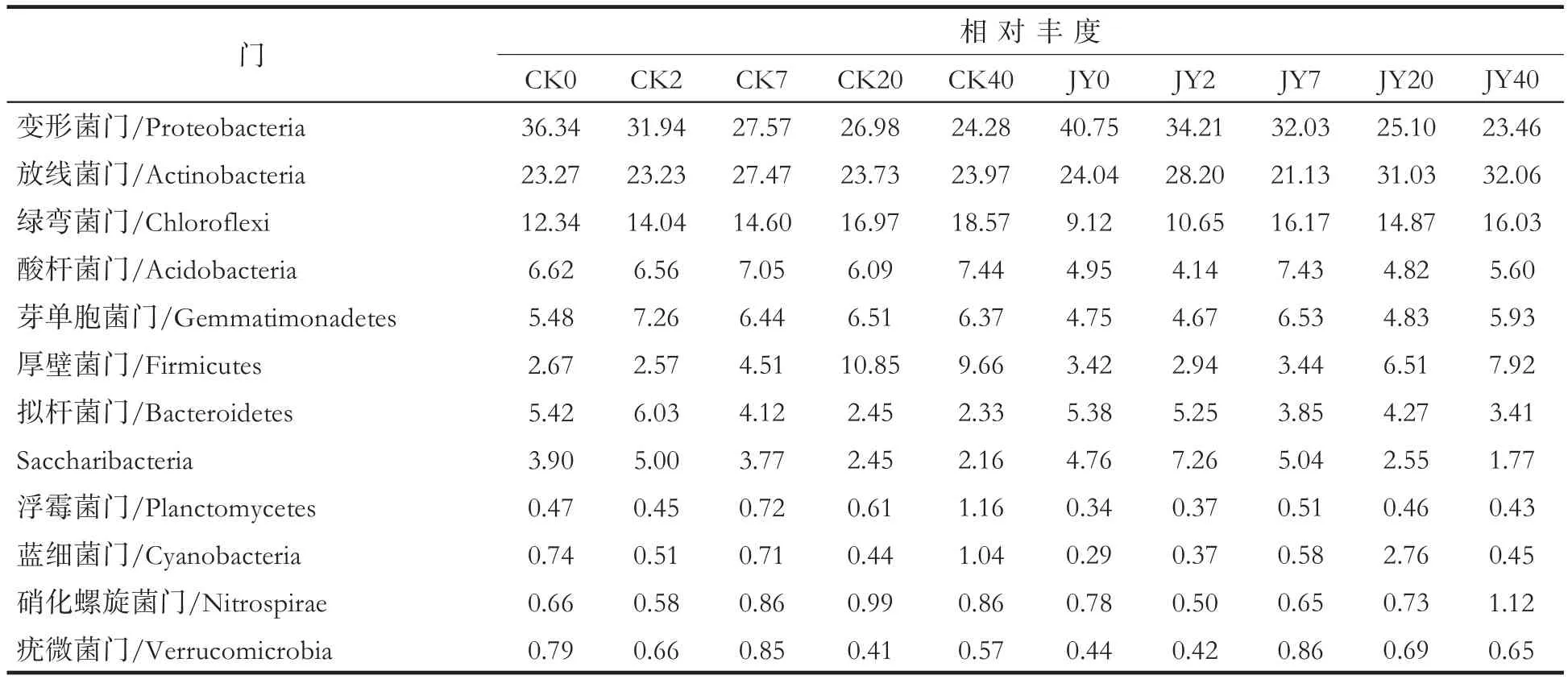
表5 不同时期烟株根围土壤细菌各菌门的相对丰度Tab.5 Relative abundances of bacteria phyla in rhizospheric soil of tobacco plants at different stages(%)
细菌属水平的变化见表6。对照根围土壤中Pseudarthrobacter、Flavisolibacter、雷 尔 氏 菌 属(Ralstonia)、鞘脂菌属(Sphingobium)、Massilia和Bryobacter相对丰度显著降低;芽孢杆菌属(Bacillus)和产黄杆菌属(Rhodanobacter)相对丰度显著增加;鞘氨醇单胞菌属(Sphingomonas)和Micromonospora相对丰度略有降低;芽单胞菌属(Gemmatimonas)、类 诺 卡 氏 属(Nocardioides)、Roseiflexus和链霉菌属(Streptomyces)相对丰度略微增加。处理组根围土壤样品中Pseudarthrobacter、鞘氨醇单胞菌属、Flavisolibacter、鞘脂菌属(Sphingobium)、雷尔氏菌属和Massilia相对丰度显著降低;芽孢杆菌属、类诺卡氏属和链霉菌属相对丰度显著增加;芽单胞菌属、Roseiflexus、Bryobacter和Micromonospora相对丰度略有增加;产黄杆菌属在5个取样时间点均未检出。表明苯并噻唑硫酮能显著增加类诺卡氏属和链霉菌属的相对丰度,显著降低鞘氨醇单胞菌属的相对丰度,而对于其他菌属影响较小。
图2为属水平下对照与苯并噻唑硫酮处理后不同时期土壤样品细菌群落热图,通过颜色的变化直接反映出样品中各菌属相对丰度的高低。颜色分布表明,除Pseudomonas、鞘脂菌属、雷尔氏菌属、Pseudarthrobacter和Massilia外,其余菌属在各样本中的相对丰度无明显差异。热图上方为灌根处理后不同时期样品的层级聚类树。其中JY01、JY23、JY71和JY73聚为一类,JY03、JY22和JY21聚为一类,CK23、JY02、CK03、CK02和 CK01聚为一类,CK71、CK22和 CK21聚为一类,CK73、JY202、JY203、JY201和 CK72聚为一类,CK403、JY401、CK401、CK203、CK202和JY72聚为一类,CK201和JY403聚为一类,CK402和JY402与其他样品细菌群落结构差异较大,因而各自聚为一类。处理后不同时期的样品可聚集成为1个分支,处理相同时期3个样品不能聚集为1个分支,说明处理相同时期的3个土壤样品间细菌群落存在较大差异。
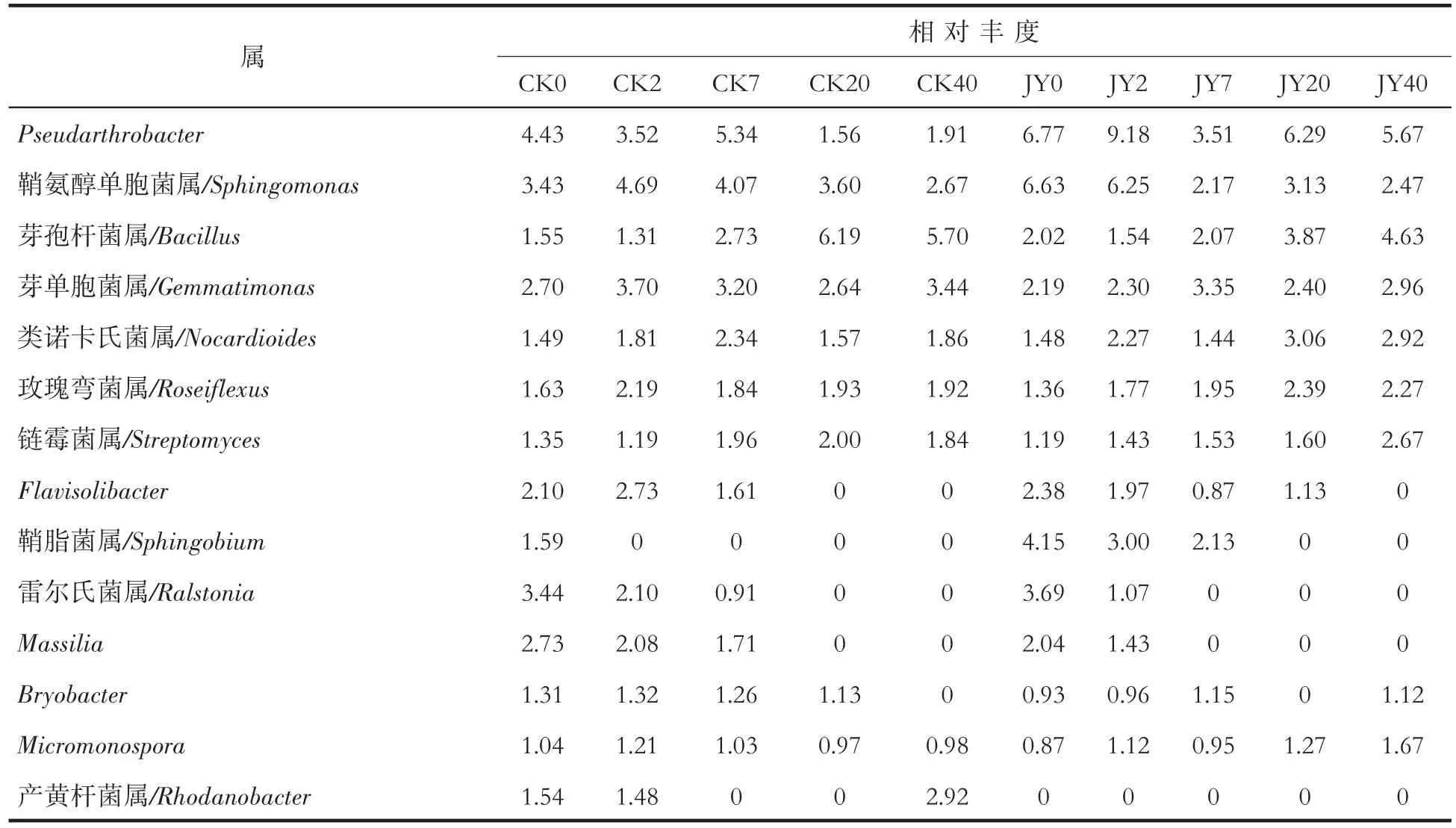
表6 不同时期烟株根围土壤细菌各菌属相对丰度Tab.6 Relative abundances of bacteria genera in rhizospheric soil of tobacco plants at different stages (%)
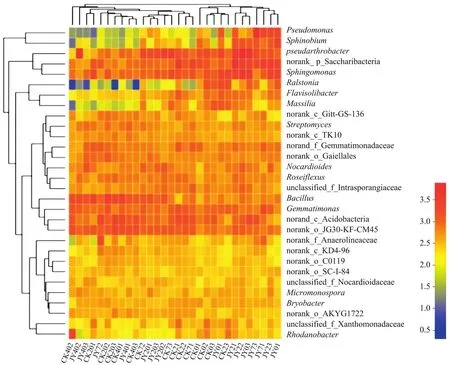
图2 土壤样品中细菌属水平群落热图Fig.2 Heatmap of bacterial community in soil samples at genera level
3 讨论
土壤微生物多样性的增加在维持土壤健康和抑制植物病害方面起着十分重要的作用[29-30]。有研究表明土壤微生物多样性的降低是导致土传病害发生的重要原因[31]。Shiomi等[32]发现青枯雷尔氏菌很难在土壤微生物多样性高的土壤中定殖。本研究中,苯并噻唑硫酮灌根处理后烟株根围土壤的细菌丰富度与多样性增加,而用灭菌蒸馏水灌根的烟株根围土壤的丰富度与多样性降低。因此,推测苯并噻唑硫酮灌根可能是通过增加烟株根围土壤细菌群落多样性,从而降低青枯雷尔氏菌在土壤中的定殖,进而达到抑制烟草青枯病的发生。
样品细菌群落基本组成和结构分析表明,烟株根围土壤中优势菌门为变形菌门、放线菌门和绿弯菌门。这与施河丽等[33]试验的青枯病发病烟株根际土壤和曹毅等[34]分析的烟草青枯病病圃土壤的研究结果基本一致。放线菌门含量通常被视为土壤健康与否的指标[35],同时放线菌也是产生抗生素的主要菌门,经苯并噻唑硫酮灌根处理后烟株根围土壤中放线菌门的含量显著增加。可见苯并噻唑硫酮灌根促进烟株根围土壤中有益微生物大量增殖,这在一定程度上可减轻烟草青枯病的危害。
为使烟株感染青枯病,试验前期人为在土壤中加入了青枯雷尔氏菌。在苯并噻唑硫酮灌根处理后2 d,雷尔氏菌属在苯并噻唑硫酮处理中的衰减速度高于对照;在2 d后苯并噻唑硫酮处理中雷尔氏菌属衰减速度低于对照;20 d后苯并噻唑硫酮灌根和灭菌蒸馏水灌根烟株根围土壤均未能检测出雷尔氏菌属。以此推测苯并噻唑硫酮处理的雷尔氏菌属衰减速度先快后慢,可能与苯并噻唑硫酮的药效有关,前期药效高抑制雷尔氏菌属能力强,雷尔氏菌属衰减速度快,后期药效减弱,抑制效果降低。但该推测有待进一步试验验证。烟株接种青枯菌后,灭菌蒸馏水灌根的烟株根围土壤中雷尔氏菌属相对丰度降低,原因目前尚不清楚,有待进一步试验研究。
4 结论
盆栽试验结果表明,苯并噻唑硫酮灌根能显著抑制烟草青枯病的发生,对烟草青枯病有较好防治效果。苯并噻唑硫酮灌根增加了烟株根围土壤细菌群落的丰富度与多样性,并显著提高了放线菌门、类诺卡氏属和链霉菌属等有益细菌的相对丰度,显著降低了Saccharibacteria菌门和鞘氨醇单胞菌属等的相对丰度。但苯并噻唑硫酮灌根并未改变烟株根围土壤细菌的优势菌门和菌属,灌根后不同时期烟株根围土壤中细菌的优势菌门均为放线菌门、变形菌门和绿弯菌门,优势菌属均为Pseudarthrobacter、鞘氨醇单胞菌属和芽单胞菌属。

