差速离心法联合聚乙二醇6000富集脂肪间充质干细胞来源的外泌体
李萍,王静,沈美萍,戴成祥,李苏克,刘必佐
干细胞是胚胎或成体个体中存在的可以持续自我更新,并具有多向分化能力的细胞,按照分化潜力的大小,干细胞分为全能干细胞、多能干细胞及单能干细胞。其中,间充质干细胞(mesenchymal stem cell,MSC)是一种多能干细胞,是来源于中胚层的体细胞,广泛存在于骨髓、脂肪、胎盘、新生儿脐带等组织中[1]。间充质干细胞在促进损伤组织修复,抗炎调节免疫等方面具有重要作用。其中脂肪间充质干细胞取材方便,不存在伦理问题,并且已经在治疗膝骨关节炎等疾病方面表现出良好的疗效[2],呈现出巨大的医疗潜力而备受关注。
目前,间充质干细胞促进组织修复和拮抗炎症的作用机制还不是十分明确,大量研究表明,除了依靠自我增殖和分化,间充质干细胞的大部分功能是通过分泌蛋白与外泌体等囊泡与其他细胞相互作用进行的[3-4]。外泌体是从细胞中释放出来的病毒大小的膜囊[5]。它是一种由活细胞通过内吞-融合-外排等一系列生物学机制产生,并通过主动分泌的方式排出细胞膜外的脂质双分子层膜囊,直径 < 150 nm[6]。它们含有介导细胞间通讯的蛋白质和核酸物质[7-9],如脱氧核糖核酸(DNA)、核糖核酸(RNA)、微小 RNA(miRNA)等。外泌体还包含主要组织相容性复合体(MHC)I 和 II[10];四跨膜蛋白超家族,如 CD81、CD82、CD63、CD9[11-12]和肿瘤易感基因 101(TSG101)等[13]。
目前富集外泌体的方法包括差速离心法、超滤法及沉淀法等,其中最常用的是差速离心法[14]。所谓差速离心法,就是通过逐步增加离心力(比较典型的就是离心力达到 100 000 × g,甚至更高)去除较小的不需要的细胞碎片和较大的囊泡亚群[15-16]。差速离心法的难点是浓缩和纯化所需的费用巨大和处理时间较长,特别是药物研发实验阶段需要浓缩大量的培养基来提取囊泡蛋白。超滤法是基于大小对溶液中的囊泡进行筛选,大量提取时对设备有较高要求。沉淀法是目前大多数外泌体分离试剂盒采用的方法,采用多种助沉降的试剂组分将蛋白因子和囊泡沉聚下来,再结合超滤或层析法筛选得到目标大小的囊泡[17]。然而试剂盒处理的样本体积有限,且沉淀溶液采用的试剂成分复杂,不适合囊泡 的后续医疗用途。所以我们希望探索一种通过单一成分将外泌体进行富集并纯化的方法,以满足生产需要。聚乙二醇(PEG)是由重复的乙二醇单元[-(CH2CH2O)n]组成的聚合物,是大部分沉淀法试剂盒采用的核心原料。PEG 也是药物传递系统的 首选聚合物,因其良好的可塑性和安全性而备受 推崇:它是任何配方开发过程中所选用辅料的首 选[18]。聚乙二醇溶液用于病毒的浓缩和纯化已经有 50 多年的历史[19]。Rider 等[20]发现,终浓度 8% 的 PEG 6000 沉淀结合超离清洗相较于差速离心法,分离 293T 外泌体的得率提高,纯度也没有受到太大影响。而我们由于使用的是脂肪间充质细胞,其大小分布可能不同,且培养基成分也不同,结合文献中关于使用 PEG 富集大肠杆菌包涵体的方法,重新实验确定最佳的沉淀浓度,进一步优化外泌体富集的方法[21],为我们的商用外泌体分离提供一种廉价有效的替代方法。
1 材料与方法
1.1 材料
1.1.1 试剂与耗材 人脂肪经知情同意情况下获得,符合伦理要求。超速离心管购于美国贝克曼公司;聚乙二醇 6000(PEG 6000)和 PKH-67 购于美国 Sigma 公司;BCA 试剂盒购于上海碧云天生物技术有限公司;抗体 CANX、CD63、CD81 和 TSG101 均购于美国 Thermo 公司;蛋白预制胶和 SDS 预制胶电泳缓冲液均购于上海天能科技有限公司;CD73-FITC、CD90-PerCP-Cy5.5、CD105-APC、CD34-PE、CD45-PE、HLA-DR-FITC 均购于美国 Biolegend 公司;成脂、成骨、成软骨诱导分化培养基购于美国 Sciencell 公司;人血小板裂解物 EliteGro 购于美国 Elitecell 公司;miRNeasy Mini Kit 购于美国 Qiagen 公司;TaqMan®Advanced miRNA Assays 和 Exo-spin columns 购于美国 Thermo 公司。
1.1.2 仪器 Optima XPN-90 超速离心机购于美国贝克曼公司;FACS Canto II 分析型流式细胞仪购于 BD 公司;ZetaView 纳米颗粒追踪分析仪购于德国 Particle Metrix 公司;实时荧光定量 PCR 仪、NanoDrop 和 Evos 荧光显微镜购于美国 Thermo 公司。
1.2 方法
1.2.1 hAdMSC 的分离培养 无菌条件下在 50 ml 脂肪悬液中,加入 I 型胶原酶,37 ℃ 恒温 消化 0.5 h,待组织发白,终止消化。将消化液室温 500 × g 离心 10 min。离心结束后悬液分为三层,吸去上中两层,保留最下层。最下层悬液使用 PBS 进行重悬,500 × g 离心 10 min。收集细胞沉淀加入含 5% EliteGro 的 α-MEM 培养细胞,置于 37 ℃、5% CO2培养箱内进行培养。待细胞达到约 90% 融合度,使用 0.25% 胰酶进行消化传代,接种密度为 1 × 104/cm2,每 2 天换一次液。
1.2.2 hAdMSC 表面抗原鉴定 收集 P3 代细胞悬液,1500 r/min 离心 5 min,弃上清(留 100 μl 左右液体)。加抗体(CD73、CD90、CD105、CD34、CD45、HLA-DR),避光 20 min 孵育。每管加 1 ml PBS,1500 r/min 离心 5 min,弃上清。加 500 μl PBS,样品用于上机。
1.2.3 hAdMSC 三向分化 取 P3 代 hAdMSC 接种于 6 孔板中,细胞密度为 1 × 105个/cm2,于 37 ℃、5% CO2培养箱中培养,待细胞融合度达到 60% 左右,弃去原培养基,分别更换为成脂、成骨、成软骨诱导分化培养基,诱导分化培养基的使用方法见 Sciencell 诱导培养基的使用说明书。
1.2.4 培养基去除外泌体 将 EliteGro 按照体积比 15% 添加至 α-MEM 基础培养基中,120 000 × g 离心 6 h。离心完毕,使用移液管从上层开始轻吸收取培养基,至离心管底部 0.5 cm 处的培养基弃去。使用 α-MEM 基础培养基,将超速离心收取的培养基稀释,两者体积比为 2:1,稀释后 4 ℃ 储存。
1.2.5 PEG 沉淀法收集外泌体 P3 代 hAdMSC 90% 融合后,弃去完全培养基,使用去除外泌体的培养基于 37 ℃、5% CO2条件孵育 48 h,并收集细胞培养上清液,3 000 × g 离心 15 min,吸取上清液,去除沉淀;10 000 × g 离心 0.5 h,吸取上清液,去除细胞碎片。离心后的培养基等体积分成 4 份,分别添加含 100 mmol/L NaCl 的 8%、12%、16% 和 20% 的 PEG 6000,4 ℃ 过夜;3200 × g,4 ℃ 离心 1 h,去上清,使用 PBS 重悬沉淀; 120 000 × g 离心 70 min,去上清,使用 PBS 重悬离心管底部收集沉淀。筛选最适浓度 PEG 6000 做后续与差速离心法获取外泌体的比较实验。
1.2.6 差速离心法收集外泌体 P3 代 hAdMSC 90% 融合后,弃去完全培养基,使用去除外泌体的培养基于 37 ℃、5% CO2条件孵育 48 h,并收集细胞培养上清液,3000 × g 离心 15 min,吸取上清液,去除沉淀;10 000 × g 离心 0.5 h,吸取上清液, 去除细胞碎片;120 000 × g 离心 70 min,去上清,使用 PBS 重悬离心管底部沉淀;120 000 × g 离心 70 min,去上清,使用 PBS 重悬并收集离心管底部沉淀。
1.2.7 Western blot 检测 使用加过蛋白酶抑制剂的 NP-40 裂解外泌体。使用 BCA 试剂盒检测外泌体蛋白浓度,剩下的样品添加 4 × loading buffer,95 ℃ 煮 5 min。样品分别以同蛋白量或者同体积上蛋白预制胶,80 V 跑 0.5 h,120 V 跑 1 h。跑完胶,转 PVDF 膜,恒流 250 mA,转 1.5 h。转膜完毕,封闭 0.5 h。使用一抗(CD63、CD81、TSG101)(1:1000)添加至封闭液中,4 ℃ 孵育过夜。使用 TBST 洗膜,10 min/次,洗 3 次,使用对应种属的二抗(1:3000),室温孵育 3 h。使用 TBST 洗膜,10 min/次,洗 3 次,HRP 显色。
1.2.8 外泌体粒径浓度(NTA)检测 以去离子水清洗 ZetaView 纳米颗粒追踪分析仪样本池。仪器使用聚苯乙烯微球校准。以 PBS 清洗样本池。样本以 PBS 进行稀释并检测。取待测样品 10 ~ 20 μl 滴在碳网上,静置 1 min,让待测颗粒吸附在碳膜上,用滤纸吸去液滴,然后取 2% 醋酸双氧铀滴在碳网上染色 1 min,用滤纸吸去染液,干燥后,在 TecnaiTMG2 Spirit Bio TWIN 电镜平台上观察样本形态。
1.2.9 miRNA qRT-PCR 按照 1.2.5 和 1.2.6 所述分离出的外泌体,各取 40 μl,使用 miRNeasy Mini Kit 分离 miRNA,使用 NanoDrop 定量,统一用量为 10 ng,进行后续反转实验。使用 TaqMan®Advanced miRNA Assays 反转录为 cDNA,-20 ℃ 保存。由于 hsa-miR-93-5p 在血清和血浆中能够稳定表达[22],因此使用 hsa-miR-93-5p 作为内参。qRT-PCR 测定外泌体中 miR-133b、miR-124-3p 的 miRNA 的表达。PCR 扩增条件:95 ℃,20 s;40 个 PCR 循环(95 ℃,1 s;60 ℃,20 s)。
1.2.10 外泌体摄取实验 按照 1.2.5 和 1.2.6 所述分离出的外泌体,各取 3 μg,使用 PKH-67 进行荧光标记,使用 Exo-spin columns 对标记完毕 的外泌体进行过柱洗涤。将成纤维细胞按照 1 × 104个/cm2接种于 48 孔板,培养 24 h。将使用 PKH-67 标记后的外泌体加入孔板中,20 h 后在免疫荧光显微镜下镜检。
1.3 统计学处理
使用 GraphPad Prism 5.0(La Jolla,USA)对数据进行分析。
2 结果
2.1 hAdMSC 表面抗原鉴定
流式检测 P3 代 hAdMSC 表面抗原标志物,结果显示 CD34-/CD45-/HLA DR-阴性细胞数百分比为 0.98%,表达特异性抗原 CD73+、CD90+、CD105+阳性细胞数分别为 99.0%、100.0%、100.0%(图 1),符合国际细胞治疗协会定义的 MSCs 标志性抗原表达鉴定标准。
2.2 hAdMSC 三向分化能力鉴定
hAdMSCs 经成脂诱导培养 21 d,油红 O 染色后观察到细胞的胞浆出现大小不等的红色脂滴(图 2B);hAdMSCs 经成骨诱导培养 16 d,茜素红 S 染色后出现大量橘色沉淀颗粒,有明显的“矿化”结节(图 2C);hAdMSCs 成软骨诱导培养 28 d,阿利新蓝染色后观察到细胞基质和纤维呈蓝紫色(图 2D)。表明本研究获得的 hAdMSCs 具有很好的成脂、成骨和成软骨分化潜能。
2.3 PEG 沉淀法和差速离心法收集外泌体
将分别添加含 100 mmol/L NaCl 的 8%、12%、16% 和 20% PEG 6000 的分离出的外泌体按照相同的总蛋白量上样,进行 CD63 鉴定(图 3A),发现 12% PEG 6000 和 16% PEG 6000 分离出的外泌体的 CD63 表达量最高,本着尽量减少终样品中 PEG 残留的原则,我们在后续实验中使用 12% PEG 6000 对外泌体进行沉淀分离。
将使用 12% PEG 6000 分离 200 ml 培养基所获得的外泌体和超速离心分离 350 ml 培养基所获得的外泌体进行蛋白标志物鉴定、电镜分析、NTA 检测(图 3)。按照同体积和同蛋白量上样进行 CANX、TSG101 和 CD81 鉴定。其中,无论是同体积还是同蛋白做 Western blot 鉴定,PEG 6000 分离出的外泌体的目的蛋白量都远大于差速离心法分离出的外泌体的量。电镜结果显示差速离心(图 3E)和 PEG 沉淀(图 3F)所得外泌体均为茶托样的双层膜结构。NTA 结果显示,PEG 6000 分离出的外泌体的浓度为 1.35 × 108个/ml,差速离心分离出的外泌体的浓度为 6.8 × 107个/ml;PEG 6000 分离出的外泌体粒径大小为(126.6 ± 2.09)nm,差速离心分离出的外泌体的粒径大小为(137.8 ± 3.8)nm。实验结果表明,12% PEG 6000 分离出的外泌体产量比差速离心分离出的产量高得多,且 PEG 并不影响外泌体的粒径大小。
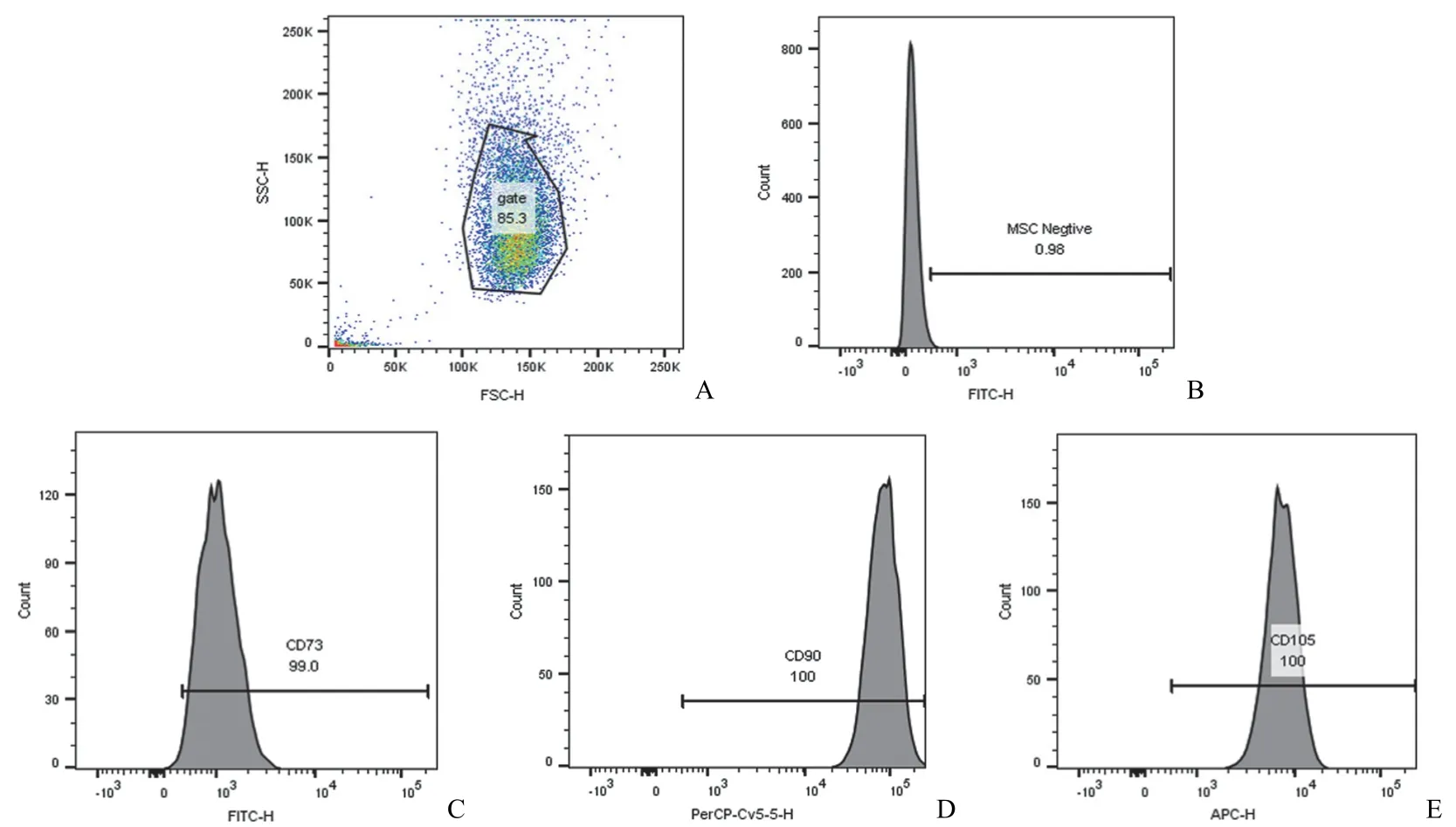
图1 hAdMSCs 表面标志性抗原流式鉴定结果(A:总细胞散点分布;B:阴性对照;C ~ E:CD73+、CD90+、CD105+ 细胞比例)Figure 1 Phenotype characterization of hAdMSCs through flow cytometry (A: Total particles scatter diagram; B: Negative control; C-E: CD73+, CD90+, CD105+ cells ratio)
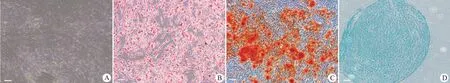
图2 hAdMSCs 成脂、成骨、成软骨分化潜能鉴定(A:正常 hAdMSCs 细胞形态;B:油红 O 染色;C:茜素红 S 染 色;D:阿利新蓝染色;标尺:100 μm)Figure 2 Adipogenic, osteogenic and chondrogenic differentiation capacities of hAdMSCs (A: Normal hAdMSCs cell morphology; B: Oil red O staining; C: Alizarin red S staining; D: Alcian blue staining; Scale: 100 μm)
2.4 PEG 6000 和差速离心分离出的外泌体的 miRNA 的表达情况
使用 qRT-PCR 检测差速离心法和 PEG 6000 沉淀法分离出的外泌体中 miR-133b 和 miR-124-3p 的表达情况(引物序列见表 1)。从实验数据来看(图 4),PEG 6000 沉淀法获得的外泌体表达 miR-133b 和 miR-124-3p 的量比差速离心法获得的外泌体多。
2.5 成纤维细胞摄取外泌体
使用 PKH-67,将差速离心法分离出的外泌体和 PEG 6000 分离出的外泌体进行标记(图 5B 和图 5C)。使用成纤维细胞摄取两种分离方法的外泌体。从图 5 可以发现,PEG 6000 分离出的外泌体并不影响成纤维细胞对外泌体进行摄取,而且在相同蛋白量(3 μg)的条件下,PEG 6000 富集的外泌体要比差速离心法分离出的外泌体更多。
3 讨论
在此次研究中,使用 12% PEG 6000 分离 P3 代 hAdMSC 产生的外泌体。该方法分离出的外泌体与金标准差速离心法分离出的外泌体高度相似,且产量远胜于差速离心法。hAdMSC 来源的外泌体表达四跨膜蛋白超家族的 CD63 和 CD81 以及肿瘤易感基因 TSG101,不表达内质网来源蛋白,如钙连接蛋白(calnexin,CANX)[23]。使用不同浓度的 PEG 6000 进行 hAdMSC 来源的外泌体分离,可以发现,12% 和 16% 浓度的 PEG 所分离出来的外泌体 CD63 表达量最多。但是,考虑到 PEG 的非降解性和免疫原性[24-25],后续实验使用 12% PEG 6000 进行分离外泌体。
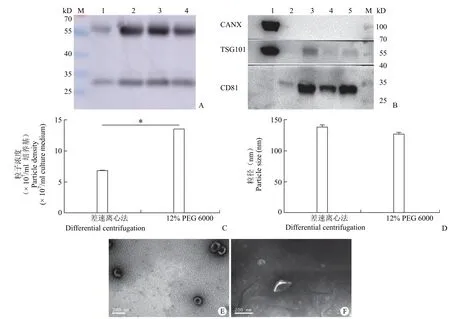
图3 Western blot 和 NTA 检测 PEG 沉淀法和差速离心法收集的外泌体的产量[A:M:Marker;1 ~ 4:分别为 8%、12%、16% 和 20% PEG 6000 分离出的外泌体的 CD63 表达量(同蛋白量上样);B:M:Marker;1:hAdMSC;2 和 4:差速离心分离的外泌体的蛋白表达情况;3 和 5:12 % PEG 6000 分离出的外泌体的蛋白表达情况;C:NTA 检测 PEG 6000 和差速离心分离出的外泌体粒子浓度,*P < 0.05;D:NTA 检测 PEG 6000 和差速离心分离出的外泌体粒径大小;Error bars,S.D.;E:差速离心法分离出的外泌体透射电镜图;F:PEG 6000 分离出的外泌体透射电镜图]Figure 3 Western blot and NTA detection for exosome yield collected by PEG precipitation and ultracentrifugation [A: M: marker; 1-4: The CD63 expression of exosomes isolated respectively from 8% PEG 6000, 12% PEG 6000, 16% PEG 6000 and 20% PEG 6000 (the same quantity of the protein); B: M: marker; 1: hAdMSC; 2 and 4: The protein expression of exosomes isolated by differential centrifugation; 3 and 5: The protein expression of exosomes isolated from 12% PEG 6000; C: NTA was used to detect the concentration of exosomes separated by PEG 6000 and differential centrifugation, *P < 0.05; D: NTA was used to detect the size of exosomes separated by PEG 6000 and differential centrifugation; error bars, S.D.; E: TEM of exosomes isolated by differential centrifugation; F: TEM of exosomes isolated by PEG 6000]

表1 miRNA qRT-PCR 引物序列Table 1 miRNA primer sequences for qRT-PCR
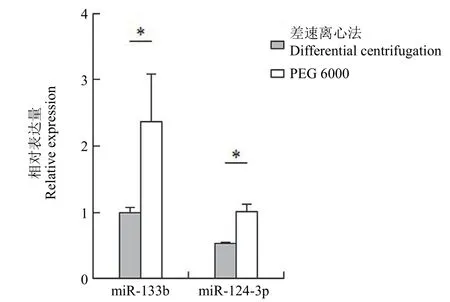
图4 差速离心法和 PEG 6000 沉淀法分离出的外泌体的 miRNA 表达量(*P < 0.05)Figure 4 miRNA expression of exosomes isolated by ultracentrifugation and PEG 6000 precipitation (*P < 0.05)

图5 成纤维细胞摄取差速离心法和 PEG 6000 沉淀法分离出的外泌体(A:没有摄取外泌体的成纤维细胞;B:成纤维细胞摄取 3 μg 差速离心法分离的外泌体;C:成纤维细胞摄取 3 μg PEG 6000 分离出的外泌体;蓝色:Hochest 染色的细胞核;绿色:PKH-67 标记的外泌体;标尺:100 μm)Figure 5 Fibroblasts uptake exosomes isolated by ultracentrifugation and PEG 6000 precipitation (A: Fibroblasts uptake no exosome; B: Fibroblasts uptake 3 μg exosomes isolated by differential centrifugation; C: Fibroblasts uptake 3 μg exosomes isolated by PEG 6000; Blue: Hochest; Green: PKH-67 labeled exosomes; Scale: 100 μm)
通过 Western blot 可以发现,不管是同体积上样还是同蛋白量上样,PEG 6000 分离出的外泌体 CD81 和 TSG101 的蛋白表达量都高于差速离心法,且两种方法分离出的外泌体都不表达 CANX。从粒径大小和浓度来看,PEG 6000 捕获的囊泡数量更多;从 miRNA 水平和成纤维细胞摄取外泌体的情况来看,PEG 6000 并不影响外泌体的 miRNA 的表达水平以及成纤维细胞摄取外泌体的能力,相反效果更好。
PEG 6000 分离法与差速离心法相比具有很大的优势,它所分离出的外泌体的纯度和数量都超过金标准,而且 PEG 6000 远比商业外泌体分离试剂更便宜。同时,PEG 6000 分离法也可以很容易地被改变一些参数用于其他样品的分离。比如,通过添加超滤步骤或者施加较大或较小的离心力,可以获得较大或较小的颗粒。目前,细胞外囊泡作为疾病的生物标志物受到了广泛的关注,因此 PEG 6000 法也可以被用于临床。有数据表明,在某些情况下,用聚乙二醇孵育 1 h 就足以浓缩囊泡[26]。如果不需要高纯度的制剂,临床样品可以在 1 h 左右被检测。

