小麦颗粒宏量组分分层定向酶解的研究
苗春雷,朱新贵(华南农业大学食品学院,广东广州 510642)
小麦是世界上种植最广的谷物,其产量和消费量约占世界谷物消费量的30%[1]。作为全世界多数国家和民族的主粮,小麦以及以小麦为基础的食物为人类提供了大量的碳水化合物和蛋白质[2]。小麦籽粒因富含淀粉,使其除直接用做人类口粮外,也作为发酵工业中常用的淀粉质原料[3]。将小麦淀粉水解后,产生的水解糖广泛用作多种发酵产品的原料,如用于发酵生产酒类、调味品、有机酸、药物等。
小麦作为发酵原料时,首先通常会被粉碎[4-5],然后进行糖化处理产生糖化液用于发酵,小麦中其他宏量成分,如蛋白质及膳食纤维很少或几乎不被利用[6],最终以残渣的形式留存下来,造成产品分离困难。小麦一般含有蛋白质8%~15%、膳食纤维10%~13%[7-8],是较为优质的植物蛋白和膳食纤维。由于现有小麦的发酵过程只注重其淀粉质的利用,在工艺设计上以快速高效转化淀粉进行糖化为主[9],蛋白质和膳食纤维往往很难被回收和有效利用[10],从而造成浪费。
随着技术的发展,高酶活性及稳定性的酶制剂成本降低,因此被广泛应用于农作物及其副产物中宏量组分的水解及回收[11-13]。本研究试图使用完整的小麦颗粒作为原料,分层水解其宏量组分,并分离回收水解产物,用于几种相关产品的同步分制,避免小麦中各主要宏量组分的浪费。材料全过程保持颗粒状态,有利于分层水解产物的分离。
1 材料与方法
1.1 材料与仪器
小麦颗粒(龙94-4083) 购自黑龙江洪波农产品有限公司;高温α-淀粉酶(180000 U/mL,来自地衣芽孢杆菌) 购自宁夏夏盛实业有限公司;葡萄糖淀粉酶AG 300L®(260 AGU/mL,来自黑曲霉) 购自诺维信(中国)生物技术有限公司;风味蛋白酶Flavourzyme®(15000 U/g,来自米曲霉) 购自北京索莱宝科技有限公司;其他试剂 均为分析纯。
HWS26型电热恒温水浴锅、F-10L型单层玻璃反应釜 上海盟昆仪器设备有限公司;pH计 梅特勒-托利多仪器有限公司;759紫外线可见分光光度计 上海仪电分析仪器有限公司;DZF系列真空干燥箱 上海一恒科学仪器有限公司;S-433D型氨基酸分析仪 德国赛卡姆公司;TGL-16GR型高速台式冷冻离心机 上海安亭科学仪器有限公司;ME204E型分析天平 上海微川精密仪器有限公司;手持折光仪 上海力辰仪器科技有限公司。
1.2 实验方法
1.2.1 原料预处理及成分测定 使用机械法脱去小麦颗粒的表皮,获得脱皮后的小麦颗粒,并测定其淀粉、蛋白质、水不溶性膳食纤维、脂肪、灰分含量。
1.2.2 小麦颗粒分层定向水解的流程 小麦颗粒中各宏量组分的水解及各级产物回收的工艺流程图如图1所示。

图1 小麦颗粒分层定向水解流程图Fig.1 Process of wheat grain gradual hydrolysis
1.2.2.1 小麦颗粒淀粉的液化 称取小麦颗粒100 g置于1000 mL锥形瓶中,按料液比1∶4的比例加入蒸馏水,将锥形瓶置于95 ℃的水浴中,按15 mmol/L的浓度加入氯化钙,以在高温下维持淀粉酶的稳定性[14]。使用1 mol/L氢氧化钠将溶液pH调节至6.0并在整个反应过程中维持。待料液温度达到95 ℃时,加入高温α-淀粉酶,酶添加量30 μL/100 g(基于原料干重)。在反应过程中,每0.5 h摇匀料液,吸取水解液测定可溶性固形物含量,同时取样适量的小麦籽粒进行研磨,根据碘显色法判断麦粒中淀粉残留情况[15]。
1.2.2.2 小麦颗粒淀粉液化产物的糖化 将液化完成后的料液迅速用冷水浴冷却至糖化反应所需温度(60.0 ℃)并维持。用1 mol/L柠檬酸调节料液pH至4.0并维持。根据初始小麦颗粒的干物质含量以12 μL/g添加葡萄糖淀粉酶进行水解,每小时取样测定糖化液中的还原糖含量。反应结束后,过滤分离得到小麦糖化液,滤渣用水按照料液比1∶3的比例洗涤数次,直至洗涤后洗涤液的pH为中性。将滤出固体在65 ℃下干燥后即得脱淀粉小麦残渣,测定其蛋白质、水不溶性膳食纤维、脂肪、灰分、还原糖含量。
1.2.2.3 脱淀粉麦粒蛋白质的水解 称取40 g干燥后的脱淀粉麦粒置于1000 mL锥形瓶中,按料液比1∶10的比例加入蒸馏水,使用包含内肽酶及外肽酶的风味蛋白酶[16]进行水解。水解条件根据Choi等[17]水解面筋蛋白的方法稍作修改,将水浴温度设定为50 ℃,待料液达到温度后根据脱淀粉麦粒的干物质含量,以60 U/g添加风味蛋白酶,反应期间使用1 mol/L氢氧化钠将料液pH维持于7.0。反应期间每2 h测定一次氨基酸态氮含量。反应结束后,过滤分离蛋白质水解液分析其氨基酸组成。将滤渣用水按料液比1∶5的比例洗涤5次,获得的小麦残渣在65 ℃干燥后测定其总氮、水不溶性膳食纤维、脂肪、灰分含量。
1.3 指标测定
1.3.1 小麦宏量组分及其他化学成分的测定 蛋白质含量的测定根据中国国家标准《食品中蛋白质的测定》(GB 5009.5-2016)中自动凯氏定氮法进行(N×5.7)[18];淀粉含量测定根据中国国家标准《食品中淀粉的测定》(GB 5009.9-2016)中酸水解法进行[19];水不溶性膳食纤维含量的测定根据Van Soest的洗涤方法进行[20];脂肪含量的测定根据中国国家标准《食品中脂肪的测定》(GB 5009.6-2016)中的方法进行[21];灰分含量的测定根据中国国家标准《食品中灰分的测定》(GB 5009.4-2016)中的方法进行[22]。
1.3.2 可溶性固形物的测定 使用手持折光仪进行测定。
1.3.3 还原糖含量的测定 根据赵凯等的DNS法进行[23]。
1.3.4 糖化液的葡萄糖当量(DE)的测定 根据中国国家标准《淀粉水解产品还原力和葡萄糖当量测定》(GB/T 22428.1-2008)中的方法进行[24]。
1.3.5 氨基酸态氮的测定 根据中国国家标准《食品中氨基酸态氮的测定方法》(GB 5009.235-2016)中乙酰丙酮-甲醛比色法进行[25]。
1.3.6 蛋白质水解度(DH)的测定 根据厉望等的方法[26]进行。
1.3.7 蛋白酶水解产物的全氮利用率的计算 根据陈怡均等的方法进行[27]。
1.3.8 蛋白酶水解产物中氨基酸态氮转化率的测定 使用比色法测定水解液中氨基酸态氮含量[22],凯氏定氮法测定水解液中总氮含量[15],按式(1)计算氨基酸态氮转化率。
氨基酸态氮转化率(%)=水解液中氨基酸态氮含量/水解液中总氮含量×100
式(1)
1.3.9 水解产物氨基酸组成分析 过滤分离残渣后,吸取2 mL蛋白质水解液与4 mL磺基水杨酸溶液(6 wt%)混合,静置1 h后以12000 r/min离心10 min。将上清液稀释5倍,通过0.22 μm膜过滤,使用自动氨基酸分析仪进行分析。
HPLC柱:LCA K07/Li,流动相:柠檬酸锂A=pH2.90;m/z 295。B=pH4.20。C=pH8.00,温度:梯度温度38~74 ℃,流速:洗脱泵0.45 mL/min+衍生泵0.25 mL/min。分析时间:130 min。氨基酸组成结果表述为每毫升水解产物中的毫克氨基酸。
1.4 数据处理
所有实验均重复进行3次,结果表示为三次实验数据的平均值。数据处理及绘图采用Origin 8.5软件。
2 结果与分析
2.1 小麦颗粒中的主要组分
图2为脱皮后的小麦颗粒外观形态,其主要组分及含量由表1所示。测得小麦颗粒中的宏量组分有淀粉、蛋白质及膳食纤维,其中淀粉占小麦颗粒干重70%以上。因此本研究首先针对淀粉进行水解回收,以使颗粒内部暴露更大接触面积便于后续蛋白酶的水解。

图2 脱皮后的小麦颗粒Fig.2 Peeled wheat grains

表1 小麦颗粒的主要组分及含量(干重,%)Table 1 Main components and contents of wheat grains(dry weight,%)
2.2 小麦颗粒淀粉的水解
2.2.1 淀粉的液化 在pH为6.0,温度95 ℃,高温α-淀粉酶添加量30 μL/100 g的水解条件下,经过5.5 h反应后在小麦颗粒中已检测不到淀粉,证明完整小麦颗粒作为底物时,其内部淀粉仍可被水解完全。此时料液中可溶性固形物含量达到15.15%(图3),且继续反应可溶性固形物含量不再增加。由于底物与料液及酶的接触面积不同,颗粒状原料中淀粉的液化时间长于粉状原料所需的约40~70 min[28-29]。但液化5.5 h后料液DE值达到28.44%,高于短时间液化所得到的19.01%~23.61%[28-29],这是因α-淀粉酶随机作用于α-1,4葡萄糖苷键将淀粉水解,所以在长时间的水解过程中葡萄糖得到积累,这对于本试验以糖化液作为目标产物是有利的。
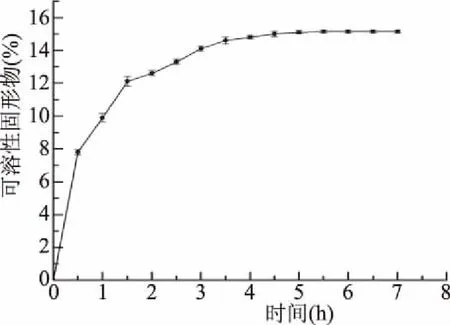
图3 高温α-淀粉酶水解过程中料液可溶性固形物变化趋势Fig.3 Trend of soluble solids in feed liquid during thermostable α-amylase hydrolysis
2.2.2 淀粉液化产物的糖化结果 在pH为4.0,温度60 ℃,葡萄糖淀粉酶添加量12 μL/g的水解条件下,糖化液中还原糖含量逐渐增加并在6 h达到最大值(图4),此时还原糖含量已达到14.01 g/100 g,DE值为92.48%。在继续反应过程中,料液中还原糖含量并未继续增加且有略微下降。这可能是产生的葡萄糖发生了复合反应[30],或与原料中的含氮物质发生美拉德反应所消耗。由此确定最佳糖化反应时间为6 h。糖化结束后迅速冷却样品并将残渣滤出。本试验所得糖化液的DE值接近纯小麦淀粉或糊精制糖所能达到的94.8%~99.5%[31-32],并确定完整小麦颗粒中的淀粉可以被彻底水解并得到充分的回收,同时小麦颗粒可以维持完整的团粒结构,且所得糖化液较纯,可直接用做食品原料或发酵工业碳源所需。

图4 葡萄糖淀粉酶处理下糖化液中还原糖含量随时间变化趋势Fig.4 Trend of reducing sugar content in saccharification liquid treated with glucoamylase
2.2.3 脱淀粉残渣中的主要组分 分离小麦糖化液后回收到22.81%的脱淀粉残渣(水分含量为4.27%),其形态如图5所示。脱淀粉残渣主要成分由表2所示,其蛋白质含量为46.72%(回收率为90.06%),粗纤维含量为38.92%(回收率为87.06%)。存在少量蛋白质及纤维碎屑混合于糖化液中在实验室条件下不易回收,但总体回收率较高。同时得到的脱淀粉麦粒中还原糖含量仅为2.11%,可直接用做普通或特医食品的原料或作为食品添加剂以降低食物GI及强化营养等[33]。

表2 脱淀粉残渣中的主要组分(干重,%)Table 2 Main component in de-starch residue(dry weight,%)

图5 脱淀粉残渣Fig.5 De-starch residue
2.3 脱淀粉麦粒蛋白质的水解
2.3.1 风味蛋白酶水解结果 在pH为7.0,温度50 ℃,酶添加量60 U/g的水解条件下,反应22 h后水解液中氨基酸态氮含量达到0.33 g/100 mL(图6),此时蛋白质水解度为53.58%,全氮利用率达到80.29%,氨基酸态氮转化率为63.12%。随后反应中氨基酸态氮含量虽仍有上升趋势,但产生速度明显放缓。这可能是由于溶液中游离氨基酸的增多对酶形成了产物抑制作用[34],或酶活力随时间下降所致。继续进行低效率的反应将导致过多的能源消耗,同时过长的反应时间也增加了料液被微生物污染的风险。因此,在水解22 h后终止反应,分离蛋白质水解液,回收剩余残渣。

图6 风味蛋白酶作用下溶液中氨基酸态氮含量变化趋势Fig.6 Trends of amino acid nitrogen content in solution during the hydrolysis of flavourzyme
2.3.2 蛋白质水解液中游离氨基酸组成及分析 水解液中游离氨基酸组成及含量由表3所示。总游离氨基酸含量为2.693 mg/mL,其中亮氨酸及异亮氨酸含量较高,由于它们是造成产物抑制的主要氨基酸[35],因此这可能是18 h后氨基酸态氮产生速率降低的主要原因。小麦中较高含量的谷氨酸和脯氨酸[36]在风味蛋白酶的水解下没有被大量释放,这与Choi等[17]水解面筋蛋白所得的结果一致。虽亮氨酸和异亮氨酸为具有苦味的疏水性氨基酸[37],且总含量多于水解液中呈鲜味及甜味的氨基酸,但水解液无明显苦味。这可能因苦味氨基酸刺激阈值较高于鲜味及甜味氨基酸[38]。因此,此法回收得到的蛋白质水解液可直接用做调味品添加剂或氨基酸补充剂等食品原料。
在水解液中未检测到胱氨酸、赖氨酸及精氨酸。其中胱氨酸在小麦中的含量较低可能未被大量释放,赖氨酸作为小麦中的第一限制性氨基酸且对热较为敏感[39],同时它与精氨酸同为发生美拉德反应速率较快的碱性氨基酸,这可能使其在较长时间的反应过程中被破坏或消耗。
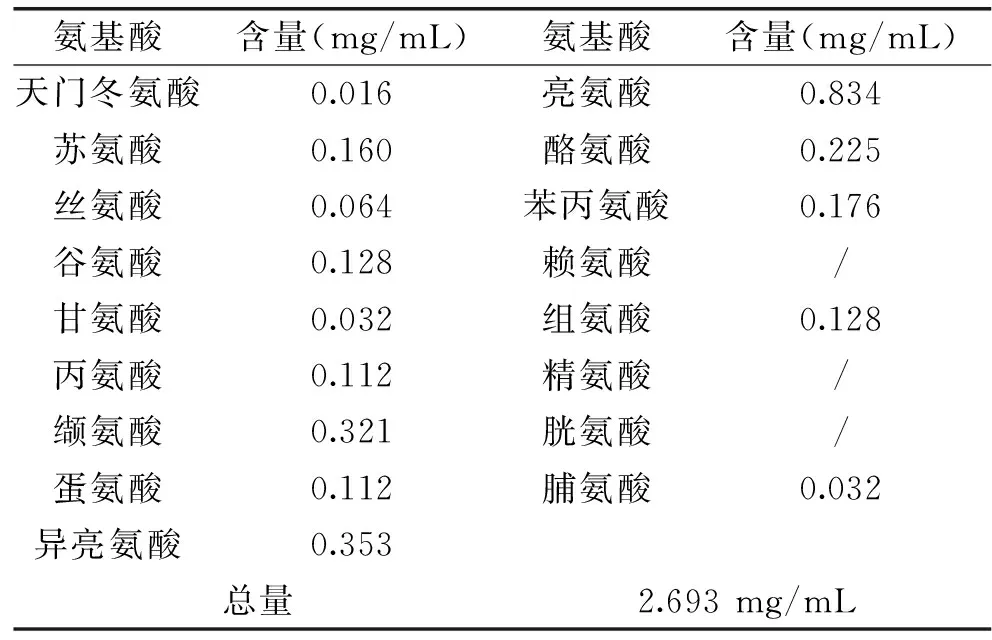
表3 脱淀粉小麦残渣蛋白质水解液游离氨基酸组成Table 3 Free amino acids composition in protein hydrolysate of de-starched wheat residue
2.3.3 脱淀粉及蛋白的残渣中主要成分 水解后最终回收到43.55%的残渣(水分含量7.43%),其形态如图7所示,主要成分由表4所示。残渣中粗纤维含量可达80.09%、灰分含量为6.85%、脂肪含量为6.24%。此外,检测到1.17%的总氮残留,可能为植物中存在的一些非蛋白质氮[40]或少量难以被水解的蛋白质。剩余残渣拥有较高的膳食纤维含量,使其可以直接作为膳食纤维补充剂食用,或作为添加剂增强食物饱腹感以及加工成食品改良剂改善食品品质等。

图7 脱淀粉及蛋白后的残渣Fig.7 De-starch and deproteinized residue

表4 脱淀粉及蛋白后的残渣中主要组分(干重,%)Table 4 Main components in the de-starch and deproteinized residue(dry weight,%)
3 结论
本研究采用酶对完整小麦颗粒的宏量组分进行分层水解并充分利用。结果表明,使用完整小麦颗粒作为底物进行淀粉及蛋白质分离是可行的,各阶段产物的水解度及各组分的回收率均较高。做到了对原料宏量组分的全利用,无废弃物及废液产生,对环境友好。直至全部宏量组分被分离及回收,麦粒的完整性仍可以得到维持并呈坚实的团粒结构,这极大降低了分离难度并利于高纯度产物的回收。分离得到的各组分不仅可以作为食品工业原料也可直接用于调味品、食品添加剂或特医食品的开发,具有良好的应用价值及市场潜力。但最终剩余的残渣中检测到少量脂肪残留,这可能不利于产品的长期保存,未来将致力于对剩余脂肪的回收制定研究方案。

