黏液性卵巢癌的诊治进展
马旭兰 综述 付凤仙 审校
(航天中心医院妇产科,北京 100049)
卵巢癌的发生率位于妇科恶性肿瘤第2位,但致死率却居妇科恶性肿瘤首位,严重危害女性健康[1]。上皮性卵巢癌是卵巢癌中最常见的组织学类型,分为浆液性、黏液性、子宫内膜样、透明细胞、移行细胞和浆黏液性肿瘤,但每种类型在流行病学、遗传异质性、病理分子改变和治疗反应等各方面都存在显著差异,本质上均为不同的疾病[2]。黏液性卵巢癌(mucinous ovarian carcinoma,MOC)是上皮性卵巢癌中相对少见的一种亚型,占3%~5%[3],好发于20~40岁,肿瘤通常体积相对较大,可以占满整个盆腔。病因尚不明确,吸烟可能是发病相关的危险因素之一[4]。多数MOC患者可早期诊断,预后良好,5年生存率80%~90%,但晚期MOC患者预后非常差,远低于其他类型,可能与其对以铂类为基础的化疗存在严重耐药性有关[5]。本文从病理特征、基因组改变、诊断、治疗进展以及未来研究方向等方面对MOC进行文献总结。
1 病理特征
2014年WHO引入新版MOC分类[2],建议根据生长方式将其分为膨胀型(融合型)和浸润型。膨胀型无明显间质浸润,表现为背靠背或复杂的恶性腺体增生;浸润型的特征是间质被明显的小腺体、巢或单个细胞浸润,且常伴有促进间质结缔组织增生反应。检测到间质浸润范围最大直径>5 mm或面积>10 mm2即可诊断为浸润性癌。明确2种病理类型的区别对MOC患者的手术分期具有非常重要的临床意义。膨胀型MOC具有较低的转移潜力,超过95%的该型患者肿瘤分期均为Ⅰ期。
此外,MOC在免疫组化的分子表达中也存在特异性改变。Bassiouny等[6]报道36例MOC表现为CK7+++,CK20+和CDX2+,均为弥漫性阳性表达,而SABT2、WT1、雌激素和孕激素受体(通常在高级别浆液性卵巢癌中呈阳性)表达均为阴性。免疫组化在鉴别原发性与转移性MOC起非常重要的作用,如CK7在结直肠癌来源的转移性MOC通常不表达,但在MOC中却多呈阳性表达(80%)。
2 基因组改变
MOC的基因组分子特征目前尚未完全阐明,明确MOC的基因组分子改变,有助于MOC的靶向治疗研究。MOC存在典型的基因组改变特征[7]。KRAS突变是MOC中最常见的分子突变,约占43.6%。KRAS突变在MOC癌灶、周围交界性和良性区域均可检测到,说明在恶性转化早期即可发生KRAS突变这一分子事件。此外,约有25%的MOC存在TP53突变,约有18.8%的MOC存在HER2扩增,但二者只可在癌灶中检测到,说明TP53突变和HER2扩增常发生于恶性转化的后期。
Polo样激酶1(Polo-like kinase1,PLK1)是一类广泛存在于真核细胞中的丝氨酸/苏氨酸激酶,参与细胞的有丝分裂过程。Affatato等[8]在MOC细胞系中应用PLK1 siRNA和2种特异性PLK1抑制剂(Onvansertib和Volasertib)均能抑制细胞生长,诱导细胞凋亡,并将细胞阻滞在G2/M期,第一次观察到PLK1抑制在MOC中的有效性;该研究还通过体外和体内实验首次表明,PLK1抑制剂与抗有丝分裂药物紫杉醇等联合治疗可能是MOC患者的一种潜在的治疗方案。因此,PLK1有望成为MOC治疗的新靶点。
此外,Zhang等[9]首次报道应用加权基因共表达网络检测的MOC转录组图谱,基于4917个基因和99个上皮性卵巢癌样本检测MOC相关基因共表达模块,结果显示10个HUB基因(LIPH、BCAS1、FUT3、ZG16B、PTPRH、SLC4A4、MUC13、TFF1、HNF4G和TFF2)在MOC中存在高表达,有望作为MOC潜在的特异性生物标志物,有助于MOC的早期诊断。由于MOC组织样本数量较少,目前该研究结果尚未在临床样本中得到验证。
3 诊断
MOC的临床诊断标准尚未完全阐明,仍需进行深入研究。MOC具有特异性的临床表现,多发生于单侧卵巢,通常为一个体积较大、内含黏性液体的多房囊性盆腔包块,且常伴有肿块压迫导致的尿路梗阻和肠梗阻等症状。MOC的诊断检查分为详细的病史(了解家族史)及体格检查、实验室检查(肿瘤标志物、免疫组化等)、消化道内镜检查(食管、胃、十二指肠、结肠镜等)和影像学检查(超声、CT、MRI、PET-CT等),见图1。MOC诊断最重要的一步就是必须结合临床和病理特征对患者进行全面评估,以排除来源于胃肠道、子宫、胰腺的肿瘤或淋巴瘤等其他部位的转移瘤。
此外,MOC是典型的异质性肿瘤,良性、交界性、非浸润性癌和浸润性成分可以共存于单个肿瘤内,表明MOC的发生是一个逐步恶化的渐进过程,从良性到交界性黏液性卵巢肿瘤,最后逐渐进展成为高度恶性MOC。Cheasley等[10]通过对良性、交界性黏液性卵巢肿瘤和MOC三者的基因组分子改变对比也得出相同结论。因此,活检时需要对瘤体进行广泛取样以确保诊断的准确性。
3.1 原发性MOC与转移性卵巢黏液性肿瘤的鉴别
过去,来源于卵巢外不同部位转移至卵巢的黏液性肿瘤极易被误诊为原发性MOC,经不断修订诊断标准之后,MOC的患病率从占上皮性卵巢癌的10%以上下降至3%~5%[3]。原发性MOC患病率较低,临床常见的黏液性卵巢恶性肿瘤大约80%以上是转移性的,其原发肿瘤部位最常来源于胃肠道(45%)、胰腺(20%)、宫颈和子宫内膜(18%)、乳腺(8%)等[11],所以对患者进行全面评估以排除来源于其他部位转移至卵巢的黏液性肿瘤是原发性MOC诊断中最重要的一步。
原发性MOC通常表现为单侧且体积较大,而转移瘤多数较小且为双侧。对可疑患者必须进行全面检查以排除其存在原发癌灶而形成卵巢转移瘤,包括食管、胃、十二指肠镜、结肠镜、CT、MRI、PET-CT等。此外,前面病理特征中已介绍二者免疫组化存在的区别之处。区分原发性MOC与黏液性卵巢转移性肿瘤对于MOC的诊断和治疗至关重要,需引起重视。
3.2 肿瘤标记物
肿瘤标记物是可疑附件肿块的常规检查,主要包括CA125、CA199和CEA等。其中CEA是MOC最有价值的血清肿瘤标记物,有助于术前鉴别MOC及术后观察MOC患者的病情进展。虽然CEA与胃肠道肿瘤密切相关,但在大约1/3的卵巢癌中也存在显著升高,其中MOC患者占比高达88%,而非黏液性卵巢癌只占19%[12]。此外,美国国家综合癌症网络(NCCN)公布的最新《2020 NCCN卵巢癌临床实践指南(第1版)》[13]首次指出,MOC患者检查项目中应增加检测CA199,可见,CA199在MOC的诊断中也发挥着重要作用。值得注意的是,CA125在高级别浆液性卵巢癌中显著升高,在MOC中表达无明显意义。此外,如血清hCG等生物学标记物可能对MOC诊断也存在一定价值,但目前尚未完全阐明及应用,需进一步探索研究[14]。
4 治疗
手术是目前MOC的主要治疗手段,与其他上皮性卵巢癌不同, MOC患者大多数在确诊时为早期疾病,被归类为FIGOⅠ期,单纯手术治疗预后良好[15]。但是复发和晚期MOC患者预后往往极差,接受化疗的患者存活率略有提高[16]。值得注意的是,MOC患者对常规的以铂类为基础的化疗方案(紫杉醇/卡铂等)存在耐药性,反应较差[17]。此外,靶向治疗是目前MOC治疗研究的热点,但研究仍处于初级阶段,需进一步大量的临床前和临床研究数据支持。原发性MOC的诊疗流程见图1。
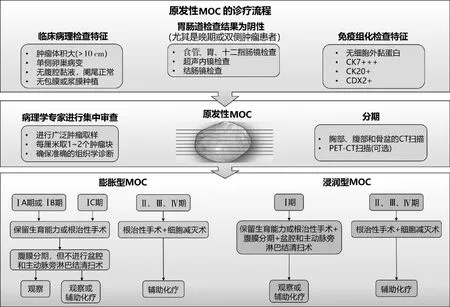
图1 原发性MOC的诊疗流程[5]
4.1 手术治疗
MOC患者的手术治疗原则包括FIGOⅠ期患者可进行保留生育能力手术(fertility sparing surgery,FSS)或全面分期手术,ⅠA~ⅠB 期术后可观察,ⅠC期术后可选择观察或辅助化疗;FIGOⅡ、Ⅲ、Ⅳ期患者需进行根治性手术、肿瘤细胞减灭术、辅助化疗等全身系统性治疗[13]。
4.1.1 FSS 大多数MOC患者被确诊时处于育龄期,FSS对有生育需求的女性仍是一种需要考虑的治疗方案。FSS手术范围应包括患侧附件切除和全面分期手术,可保留子宫及对侧附件,这种手术比标准手术侵袭性小,既可满足育龄期患者的生育需求,也可降低子宫切除术后相关不良反应的风险,但必须保证FSS术前诊断筛查和术中腹膜全分期。FSS可用于Ⅰ期希望保留生育能力的MOC患者。Yoshihara等[18]进行的一项区域性多机构回顾性研究,纳入1986年1月~2017年3月的全部MOC患者。在4730例恶性卵巢癌中,存在185例Ⅰ期原发性MOC患者,平均年龄为47.6岁(12~87岁),其中56例(30.3%)接受FSS治疗,FSS组和非FSS组之间的生存结果差异无统计学差异。因此得出结论,FSS可作为Ⅰ期原发性MOC的一种治疗选择。
4.1.2 全面分期手术
MOC的全面分期手术包括子宫切除术、双侧输卵管卵巢切除术,并根据术中病理诊断进行分期,对腹膜和淋巴结进行评估[13]。
腹膜分期包括彻底评估腹膜腔,取样任何可疑区域、盆腔冲洗、腹膜活检和腹膜下网膜切除术。存在交界性或侵袭性成分的MOC患者都应该接受腹膜分期,以排除隐匿性卵巢外疾病的可能性,与患者预后和推荐辅助治疗等密切相关[19]。
淋巴结评估包括淋巴结清扫、取样、触诊及切除增大的淋巴结等。Ⅰ期膨胀型MOC患者淋巴结扩散率非常低(<2%),几乎没有淋巴结转移,因此,不建议早期MOC患者进行常规淋巴结清扫。Ⅰ期浸润型MOC中淋巴结转移率较高(17%~30%),建议进行盆腔和腹主动脉淋巴结清扫。此外,任何增大的淋巴结均应取样检测[13,20]。
关于MOC术中是否常规切除阑尾,一直存在争议。Rosendahl等[21]从丹麦妇科癌症数据库中检索269例MOC的数据,其中172例接受阑尾切除术。病理检查显示阑尾恶性受累10例(4%),其中2例阑尾外观正常。同时,所有阑尾受累的患者均有其他转移。因此,Rosendahl等强烈建议对所有疑似MOC病例进行阑尾切除术,因为外观正常的阑尾并不排除转移。Cheng等[22]对164例MOC进行评估,建议术中必须仔细检查阑尾,但外观正常的阑尾不应常规切除,而且阑尾切除术与发病率增加无关。《2020 NCCN卵巢癌临床实践指南(第1版)》[13]指出,怀疑或确诊MOC的患者初次手术时阑尾外观有异常才进行切除,正常阑尾无须切除。
肿瘤细胞减灭术即最大限度的切除肿瘤,尽可能切净。如果无法切净,需尽可能将残留的肿瘤最大直径缩小至1 cm以下。如果无法完全切除,对于有肠道梗阻患者可考虑进行肠切除等[13]。
因为MOC肿瘤体积较大,目前临床上主要采取开腹手术,但随着腹腔镜手术水平的不断提高和适应证范围的扩大,腹腔镜手术在卵巢肿瘤中逐渐应用,但需要由经验丰富的医生施行,用于早期MOC,评估初治和复发患者能否达到满意的肿瘤细胞减灭术等[23~25]。需要注意的是,MOC行腹腔镜手术应避免肿瘤破裂造成肿瘤播散或污染,术中操作不理想者必须中转开腹手术。
4.2 化疗
虽然化疗是绝大多数上皮性卵巢癌治疗中不可或缺的组成部分,但辅助化疗对于MOC患者的益处目前尚不清楚,而且MOC患者对常规的以铂类为基础的化疗方案(紫杉醇/卡铂等)存在耐药性,反应较差[17],因此,相关研究较少。目前,《2020 NCCN卵巢癌临床实践指南(第1版)》[13]建议:ⅠC期术后进行观察或考虑辅助化疗;对于Ⅱ~Ⅳ期患者,倾向于采用胃肠型化疗(即结肠癌)或卵巢癌方案进行化疗(卡铂和紫杉醇、奥沙利铂联合氟尿嘧啶/卡培他滨)。
MOC患者对常规以铂类为基础的化疗方案(紫杉醇和卡铂等)存在明显耐药性,反应较差[26]。Nasioudis等[27]将美国国家癌症数据库中4242例接受辅助化疗的Ⅰ期MOC患者纳入生存分析研究,在1322例接受化疗和2920例未接受化疗的患者中,总体生存率无统计学差异(5年总体生存率分别为86.8%和89.7%)。因此,辅助化疗对早期MOC的益处目前尚不清楚。
鉴于原发性MOC与胃肠道的组织学特征具有相似性,胃肠型化疗方案已被提出作为标准妇科方案的替代方案进行MOC的化疗。近期美国一项回顾性队列研究[28]纳入1994年1月~2018年12月两家大学癌症中心接受初级手术治疗和术后辅助化疗的52例原发性MOC,根据化疗方案不同分为2组,每组26例,化疗方案中如包括5-氟尿嘧啶、卡培他滨、奥沙利铂或伊立替康,则认为其接受过胃肠型化疗方案;如接受了含有卡铂或顺铂的方案,则被认为接受了妇科卵巢癌化疗方案。2组患者均允许接受靶向抗血管生成抑制剂贝伐单抗的治疗。此外,需排除接受腹腔热灌注化疗(hypertherm intraperitoneal chemotherapy,HIPEC)作为主要治疗的患者。与妇科化疗方案相比,胃肠型化疗方案可明显改善MOC患者的无进展生存期和总生存期,建议新诊断的高危Ⅰ期和所有Ⅱ~Ⅳ期MOC患者可接受伴或不伴贝伐单抗的胃肠型化疗方案。
HIPEC已成为治疗不同原发部位腹膜癌的一种选择,近年来在上皮性卵巢癌治疗中的有益作用不断显现[29,30],但在MOC治疗中研究较少,且存在争议[31,32]。
4.3 靶向治疗
MOC对常规以铂为基础的化疗方案存在较强的耐药性,疗效较差,迫切需要新的有效治疗方案。多腺苷二磷酸核糖聚合酶抑制剂(poly adenosine diphosphate-ribose polymerase inhibitors,PARPi)是第1个被批准用于原发性和复发性卵巢癌治疗的有效靶向药物,但因MOC的分子改变与BRCA突变或同源重组缺陷无关,导致PARPi在MOC的治疗中不起作用[33]。目前,MOC的基因组特征性分子改变已成为研究热点,如KRAS突变、TP53突变、HER2扩增等[7],有望为MOC的靶向治疗提供新靶点。目前,MOC的靶向治疗仍处于初级阶段,是未来MOC治疗的研究方向。
4.3.1 抗血管内皮生长因子(vascular endothelial growth factor,VEGF)药物治疗 VEGF在卵巢癌肿瘤组织或血清中存在高表达,与患者的预后不良关系密切。以贝伐单抗为代表的抗VEGF药物联合一线化疗常应用于卵巢癌的治疗。贝伐单抗单药或联合化疗是复发患者的首选(特别是合并腹水者),在铂类敏感或铂类耐药的患者中均有效[34]。因此,贝伐单抗在卵巢癌的初始治疗和复发治疗中均发挥重要的作用。但在所有Ⅲ期临床试验中,MOC仅占卵巢癌患者中的一小部分[35]。关于抗VEGF药物仅应用于MOC的临床试验目前几乎尚未开展,有待进行深入研究。
4.3.2 抗表皮生长因子受体(epidermal growth factor receptor,EGFR)单克隆抗体治疗 EGFR在上皮性卵巢癌中存在过表达,可促进肿瘤细胞的生长、侵袭和转移等,与患者不良预后关系密切。KRAS基因突变是MOC最常见的基因突变,在病变早期即可发生,该突变导致EGFR异常激活Ras/RAF/MAPK通路,该通路在调节细胞增殖方面起关键作用[36]。目前,KRAS突变已经被确立为可靠的预测MOC患者生存的生物标志物,并通过使用抗EGFR单克隆抗体介导的治疗而成为治疗靶点。西妥昔单抗是一种针对EGFR的嵌合单克隆抗体。Sato等[37]分析5株MOC细胞株中EGFR蛋白表达和KRAS基因突变,并评价西妥昔单抗在MOC体内外的作用,结果提示西妥昔单抗靶向治疗缺乏KRAS基因突变MOC的可能性。目前,西妥昔单抗应用于MOC的治疗还处于体外试验阶段,尚无临床试验数据研究。
4.3.3 抗HER2治疗 HER2基因扩增是在MOC中发现的另一种肿瘤特异性基因异常。值得注意的是,MOC中KRAS突变和HER2扩增几乎都是互斥的,66%的肿瘤表达KRAS突变或HER2扩增,33%的肿瘤既不表达KRAS突变,也不表达HER2扩增[38]。曲妥珠单抗通过与HER2结合阻止表皮生长因子与HER2的结合,从而阻断肿瘤细胞的增殖,还可介导抗体依赖的细胞毒作用从而直接杀伤肿瘤细胞。但是关于抗HER2治疗MOC的临床数据很少,仅限于病例报道。McAlpine等[39]对33例MOC和16例交界性上皮性卵巢癌的HER2状态进行研究,其中6例MOC和3例交界性癌HER2阳性(分别为18%和19%),3例HER2阳性复发性MOC患者接受曲妥珠单抗治疗,其中1例对化疗与曲妥珠单抗联合治疗有显著反应。因此,抗HER2药物存在治疗MOC的可能性,但还需要更多的研究支持。
4.3.4 其他 针对P53基因突变治疗[40]、SRC信号通路抑制剂[41]、PI3K/Akt/mTOR信号通路抑制剂[42]、免疫检查点抑制剂[43]等均有望用于MOC的分子靶向治疗,但目前相关临床前和临床研究较少,需进一步深入研究。
5 总结与展望
MOC是一种特殊亚型的上皮性卵巢癌,具有独特的临床表现、病理、基因组特征以及生物学特性,导致与其他型上皮性卵巢癌的诊断和治疗上存在较大差异。因此,需要对MOC进行独立研究,制定针对性诊疗指南,以期更好地指导临床工作。
由于MOC发病率很低,卵巢部位的黏液性肿瘤大多都源于其他器官肿瘤的转移[11],二者的治疗方式存在很大差别。因此,原发性MOC的诊断至关重要,仍需进一步探究其分子生物学特性,提高诊断准确率。
手术是MOC治疗的基础,早期术后预后良好,但晚期MOC患者预后极差,存在以铂类为基础的化疗耐药性,给MOC的治疗带来了很大挑战[15-17]。近年来研究显示,MOC具有很多特征性的分子改变[7-9],为MOC的靶向治疗提供可能。考虑到MOC的罕见性,开展国内外多中心联合的研究,可以更好地开展MOC的科学研究及临床试验,是未来发展的方向。此外,也可考虑对MOC患者进行相关遗传分子学检测,有助于做到精准治疗,以期提高患者的生存率,有效改善其预后。

