纳豆多糖的硫酸化改性工艺
杨 波, 杨 光, 陈远娇, 杨文丽
(上海理工大学 医疗器械与食品学院,上海 200093)
纳豆起源于中国古代豆豉,是日本的发酵产品[1],它是天然的抗生物,富含多种营养素,有助于调节血压和血脂,降低胆固醇,综合提高人体免疫力等[2-3]。近年来,对纳豆功能性成分的研究越来越多,纳豆多糖是由纳豆菌发酵大豆所得的副产物,其抗氧化、改善免疫学机制以及提高免疫力的作用已经被证实[4-6]。多糖的生物活性与其复杂的空间结构相关,硫酸酯化多糖是一种酸性多糖,是单糖结构中的羟基被硫酸基团取代而形成的一类多功能生理活性物质[7]。多糖经硫酸化修饰后,蛋白质构象被改变,使其生物活性功能发生改变,有利于增强硫酸酯化多糖的抗氧化、抗癌、免疫调节和抗凝血活性等多种生物功能[8]。朱丽丹等[9]对硫酸酯化米糠多糖的研究中发现,硫酸酯化米糠多糖在体外条件下可抑制肿瘤细胞的增殖。目前,多糖的硫酸酯化方法主要有浓硫酸法、三氧化硫–吡啶法、氯磺酸法,但这些方法均有缺陷,其中浓硫酸和氯磺酸属于强酸,反应条件难以控制,效果不甚理想。
因此,本研究选择氯磺酸–吡啶法来对纳豆多糖进行硫酸化修饰,单因素试验和正交试验确定了最佳工艺;采用傅立叶红外光谱观察分析硫酸酯化纳豆多糖(以下简称酯化多糖)的官能团变化;同时探究了酯化多糖与纳豆多糖对阪岐杆菌(Bntorobater sakazakii)、嗜水气单胞菌(Aeromonas hydrophila)及大肠杆菌 O157(Escherichia coli)的抑制作用,为纳豆多糖的硫酸酯化改性提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
原料:纳豆多糖由本实验室利用购自连云港粮油工业有限公司的大豆豆粕提取得到。
试剂:氯磺酸、吡啶、N,N–二甲基甲酰胺、牛肉膏、蛋白胨、氯化钠、琼脂、营养肉汤(国药集团化学试剂有限公司)、大肠杆菌、阪岐杆菌、嗜水气单胞菌(上海一研生物科技有限公司)。
1.2 仪 器
精密增力电动搅拌器(JJ-1):常州朗越仪器制造有限公司;数控升降水浴锅:上海振捷设备有限公司;pH计(pHS-3TC):上海天达仪器有限公司;超净工作台(Vs-840-2):上海博讯实业有限公司医疗设备厂;生化培养箱(LRH-250):上海慧泰仪器制造有限公司;可见分光光度计(WFJ 7200):优尼柯仪器有限公司;数显水浴恒温振荡器(SHZ-82B):常州人和仪器厂;红外光谱仪(NICOLET5700):美国热电公司。
1.3 方 法
1.3.1 酯化纳豆多糖的制备
硫酸酯化试剂的制备:参照Qian等[10]的方法。将带有冷凝和搅拌装置的三颈瓶置于盐水–冰浴中,取适量预冷的吡啶,按照一定比例缓慢加入氯磺酸,边加边搅拌,使两者充分反应。控制反应温度在10 ℃以内,反应时间为30~40 min即可得到淡黄色酯化试剂。
酯化多糖的制备:称取适量纳豆多糖,使其溶于一定体积的N,N–二甲基甲酰胺中,并加入装有酯化试剂的三颈瓶中。调节水浴锅温度,搅拌一定时间后,倒入装有适量冰水的烧杯中,用4 mol/L的NaOH调节溶液pH值至中性。加入95%乙醇,使溶液中乙醇浓度为75%后放入4 ℃冰箱中醇沉过夜。离心得到多糖沉淀流水透析48 h,再蒸馏水透析12 h,浓缩、冻干即可得硫酸酯化纳豆多糖。
1.3.2 硫含量的测定
硫酸根含量测定方法采用氯化钡–明胶法[11]。以硫酸钾的含量为横坐标,以吸光度为纵坐标绘制标准曲线,如图1所示。由图1可以得到,以K2SO4为标样所做的标准曲线方程为y=1.848x+0.016 6,相关系数R2=0.998 9。
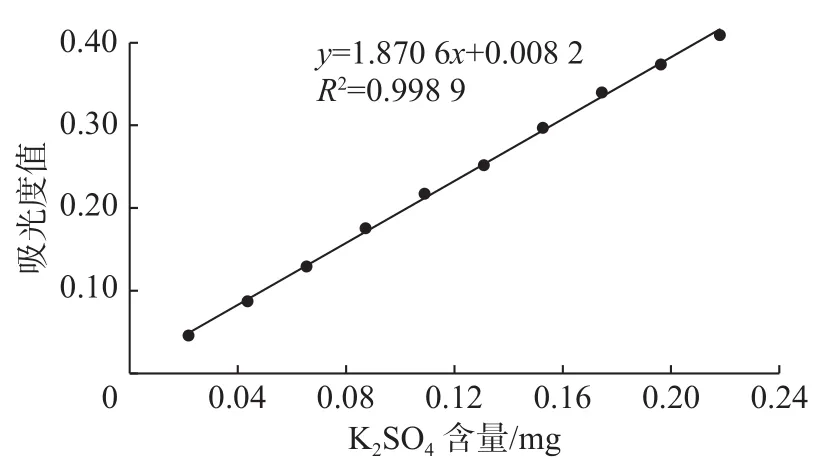
图 1 硫酸根测定标准曲线Fig.1 Standard curve for the determination of sulfate
样品中硫酸根提取:准确称取样品0.05 g于样品瓶中,加入1 mol/L的盐酸溶液2 mL,摇匀后密封,105 ℃ 水解 3 h。冷却后用 1 mol/L 的盐酸溶液定容至50 mL。按照标准曲线的制作方法测定吸光度。每个样品测定3次,取平均值。根据标准曲线计算酯化多糖中硫酸根离子含量,根据公式计算其取代度。
取代度计算公式为
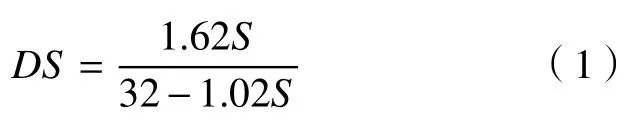
式中:DS为取代度;S为硫酸根离子质量分数。
1.3.3 酯化多糖制备单因素试验设计
a. 氯磺酸与吡啶的体积比V氯磺酸∶V吡啶对取代度的影响
按照1.3.1中的方法,设置V氯磺酸∶V吡啶分别1∶1,1∶2,1∶3,1∶4,1∶5,探究在V酯化试剂∶V多糖为4∶3、酯化温度70 ℃、酯化时间为2 h的条件下,测定V氯磺酸∶V吡啶对酯化多糖取代度的影响。
b. 酯化试剂与纳豆多糖溶液的体积比V酯化试剂∶V多糖对取代度的影响
按照1.3.1中的方法,设置V酯化试剂∶V多糖分别为 4∶1,4∶2,4∶3,4∶4,4∶5,探究在V氯磺酸∶V吡啶为 1∶3、酯化温度 70 ℃、酯化时间为2 h的条件下,测定V酯化试剂∶V多糖对酯化多糖取代度的影响。
c. 多糖酯化温度对取代度的影响
按照1.3.1中的方法,设置酯化温度分别为50,60 ,70,80 ,90 ℃,探究在V氯磺酸∶V吡啶为1∶3、V酯化试剂∶V多糖为 4∶3、酯化时间为 2 h的条件下,测定酯化温度对酯化多糖取代度的影响。
d. 多糖酯化时间对取代度的影响
按照1.3.1中的方法,设置酯化时间分别为1,2,3,4,5 h,探究在V氯磺酸∶V吡啶为1∶3、V酯化试剂∶V多糖为4∶3、酯化温度为70 ℃的条件下,测定酯化时间对酯化多糖取代度的影响。
1.3.4 正交试验优化
为了探究各单因素之间的相互作用,在单因素试验的基础上,采用软件minitab 17.0对V氯磺酸∶V吡啶、V酯化试剂∶V多糖、酯化温度和酯化时间制定四因素三水平的正交优化试验,以酯化多糖取代度为指标,确定最适酯化工艺。
1.3.5 酯化多糖的红外光谱分析
参考马小双等[12]的测定方法,取2 mg纳豆多糖样品及200 mg干燥的溴化钾放入玛瑙研钵中,在红外灯照射下将其混匀并研细。用压片机将混合物压成 0.3~0.5 mm 的透明薄片,在 400~4 000 /cm红外波长范围内进行扫描,观察并分析谱峰情况。
1.3.6 抑菌试验方法
参考陈致印等[13]的方法,固体培养基:分别称取牛肉膏 5 g、蛋白胨 10 g、氯化钠 5 g、琼脂 15 g,加热溶解于1 000 mL蒸馏水中,灭菌后备用。液体培养基:粉状营养肉汤7.2 g,加热溶解于400 mL蒸馏水中,低浓度NaOH溶液调节其pH值为7.2~7.4,高压灭菌后备用。
菌悬液制备:选用活化后的大肠杆菌、阪岐杆菌和嗜水气单胞菌,用接种环挑取单菌落至液体培养基中,根据各菌种的最适宜生长温度,分别在150 r/min转速下震荡培养,定时取样计数,使菌悬液浓度为106cfu/mL(每毫升待检样品中含有的菌落总数)。
抑菌作用测定:采用滤纸片法。将酯化多糖与纳豆多糖配制成不同浓度梯度的溶液,过0.45 μm滤膜备用。使用十字交叉法测定抑菌圈直径。抑菌圈大小可表示抑菌活性大小。
2 结果与分析
2.1 酯化反应条件对酯化多糖取代度的影响
2.1.1V氯磺酸∶V吡啶对酯化多糖取代度的影响
取纳豆多糖 0.1 g,在V酯化试剂∶V多糖为 4∶3、酯化温度70 ℃、酯化时间2 h的条件下,测定V氯磺酸∶V吡啶对酯化纳豆多糖取代度的影响,结果如图2所示。

图 2 V氯磺酸∶V吡啶对酯化多糖取代度的影响Fig.2 Effect of volume ratio of chlorosulfonic acid and pyridine on degree of substitution of sulfated polysaccharide
由图2可知,在制备酯化试剂时,随着吡啶体积的增加,酯化多糖的取代度逐渐升高,在V氯磺酸∶V吡啶为1∶4时达到最高,这可能由于氯磺酸为强酸;当V氯磺酸∶V吡啶<1∶4时,过量的氯磺酸使部分纳豆多糖分解,小分子糖类羟基基团即使被硫酸基取代,也会被透析除去;当V氯磺酸∶V吡啶>1∶4时,吡啶过量,与氯磺酸反应的吡啶环上的磺酰氯基团达到饱和,取代羟基的硫酸基团不会增多。因此,利用氯磺酸和吡啶制备硫酸化试剂的最佳比例为1∶4。
2.1.2V酯化试剂∶V多糖对酯化多糖取代度的影响
取纳豆多糖 0.1 g,在V氯磺酸∶V吡啶为 1∶3、酯化温度70 ℃、酯化时间2 h的条件下,测定V酯化试剂∶V多糖对酯化纳豆多糖的多糖取代度的影响,结果如图3所示。
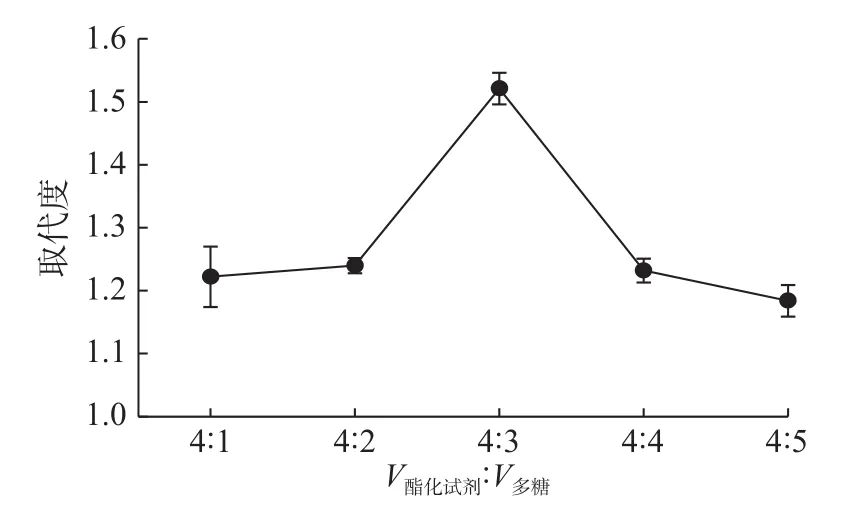
图 3 V酯化试剂∶V多糖对酯化多糖的多糖取代度的影响Fig.3 Effect of volume ratio of sulfate reagent and natto polysaccharide on degree of substitution of sulfated polysaccharide
由图3可知,随着V酯化试剂与V多糖比例的增加,酯化多糖的取代度先增加后降低。原因可能为以N,N–二甲基甲酰胺为分散剂,配制不同体积的纳豆多糖溶液,当V酯化试剂∶V多糖<4∶1时,分散剂的量较低,不足以使全部纳豆多糖与酯化试剂反应,部分纳豆多糖被碳化,导致取代度降低。此外,酯化试剂较多时,也会使纳豆多糖出现板结碳化现象;当V酯化试剂∶V多糖>4∶3时,分散剂太多,使纳豆多糖中的C位被硫酸基充分取代。刘捷等[14]对皱皮木瓜多糖的硫酸酯化研究发现,氯磺酸与多糖的比例大于30(mL)∶1(mg)时,酯化木瓜多糖的取代度不再增加,因为酯化试剂添加量增大时,酯化溶液粘稠性增强,搅拌不均匀,使酯化多糖产率降低。因此,V酯化试剂与V多糖的最佳比例为4∶3。
2.1.3 酯化时间对取代度的影响
取纳豆多糖 0.1 g,在V氯磺酸∶V吡啶为 1∶3、V酯化试剂∶V多糖为 4∶3、酯化温度为 70 ℃的条件下,测定酯化温度对硫酸化纳豆多糖取代度的影响,结果如图4所示。
由图4可知,酯化多糖取代度随着酯化时间的延长先升高后降低,酯化时间为2 h时达到最高。原因可能为酯化时间较短,硫酸基对纳豆多糖羟基的取代反应不完全;酯化时间过长,纳豆多糖长时间处于酸性条件下会被水解,不利于酯化多糖的提取回收。因此,纳豆多糖最佳的酯化时间为2 h。高爽等[15]采用浓硫酸法修饰甜玉米芯多糖,反应温度为30 min,取代度为1.14。多糖样品与浓硫酸直接接触,很容易被碳化和降解,反应时间不能太长,氯磺酸–吡啶试剂相对温和,反应时间延长才能提高硫酸基取代度。
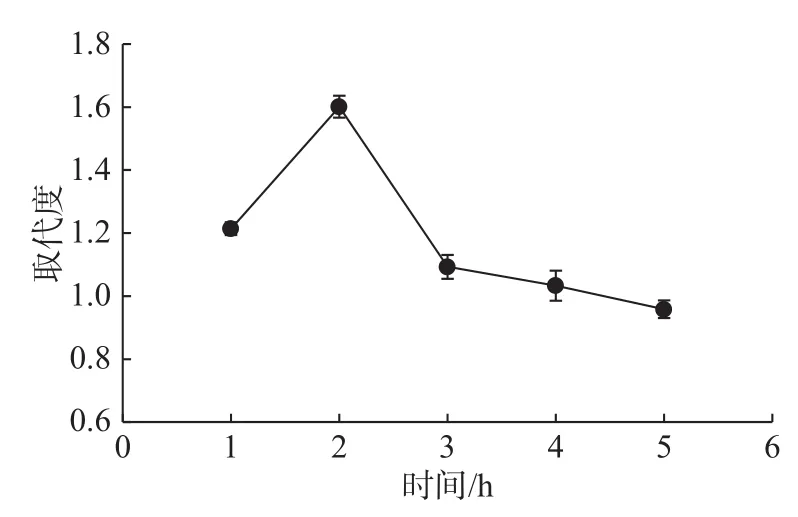
图 4 酯化时间对酯化多糖取代度的影响Fig.4 Effect of sulfated time on degree of substitution of sulfated polysaccharides
2.1.4 酯化温度对取代度的影响
取纳豆多糖 0.1 g,在V氯磺酸∶V吡啶为 1∶3、V酯化试剂∶V多糖为 4∶3、酯化时间为 2 h的条件下,测定酯化温度对硫酸化纳豆多糖取代度的影响,结果如图5所示。
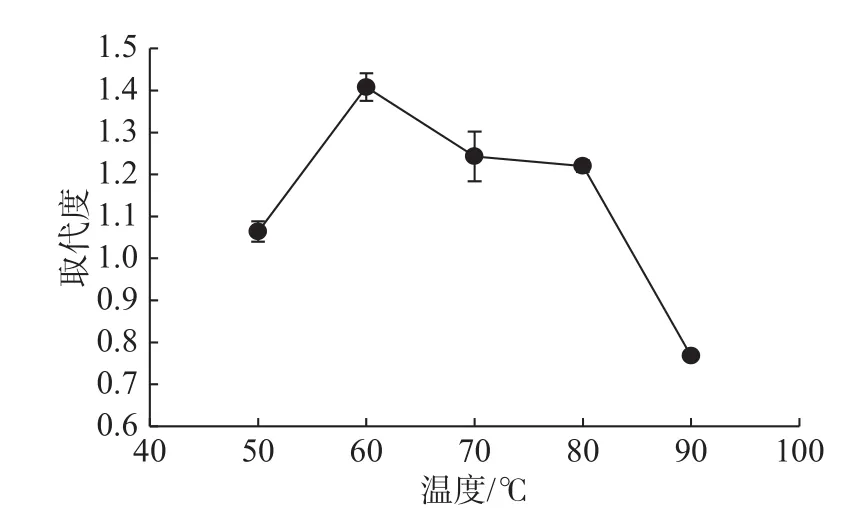
图 5 酯化温度对酯化多糖取代度的影响Fig.5 Effect of sulfated temperature on degree of substitution of sulfated polysaccharides
由图5可知,随着酯化温度的升高,酯化纳豆多糖的取代度先增加后降低,在温度60 ℃时达到最高。当温度低于60 ℃时,纳豆多糖与酯化试剂反应速度较慢,原因可能为在一定时间内,纳豆多糖基团中硫酸根离子较少,取代度小,随着温度的升高,高分子多糖活性增强,反应速度加快,取代度逐渐升高;酯化温度大于60 ℃并且反应体系为酸性时,纳豆多糖会被高温降解,导致酯化纳豆多糖回收率低,取代度下降。阚国仕等[16]采用三氧化硫–吡啶法硫酸化修饰胡萝卜多糖,反应温度为70 ℃时取代度最高。三氧化硫与吡啶的结合率比氯磺酸低,升高温度可以提高硫酸基团取代羟基的能量。因此,在氯磺酸–吡啶法中,酯化反应的最适温度较低,为60 ℃。
2.2 酯化反应条件的优化
设置V氯磺酸∶V吡啶、V酯化试剂∶V纳豆多糖、酯化温度与酯化时间四因素的正交试验条件,其试验设计及结果如表1所示。
由表 1可知,利用V氯磺酸∶V吡啶、V酯化试剂∶V纳豆多糖、酯化温度与酯化时间4个因素进行正交优化试验得出,各因素影响酯化多糖取代度的主次顺序为酯化时间>V氯磺酸:V吡啶>V酯化试剂:V多糖>酯化温度,即酯化时间对取代度的影响最大,其中最佳酯化条件是V氯磺酸∶V吡啶为1∶4、V酯化试剂∶V多糖为4∶3、酯化时间为 1 h、酯化温度为 60 ℃,此最适条件不在正交表中,需做验证试验。验证结果表明,正交试验得出的最佳工艺条件下,酯化多糖的取代度可达1.613,相比单因素试验最优试验结果,取代度提高了1.19%。陈小红[17]采用氨基磺酸为改性试剂,对茯苓多糖进行硫酸酯化,经过单因素试验与响应面试验优化得出,酯化温度为85 ℃、酯化时间达4.0 h、氨基磺酸与多糖质量比为3.77∶1时,酯化茯苓多糖的取代度为1.041,并且与氯磺酸–吡啶法的结果相似。证明了氯磺酸–吡啶法在合适的酯化条件下,可以有效地对多糖进行硫酸化改性。
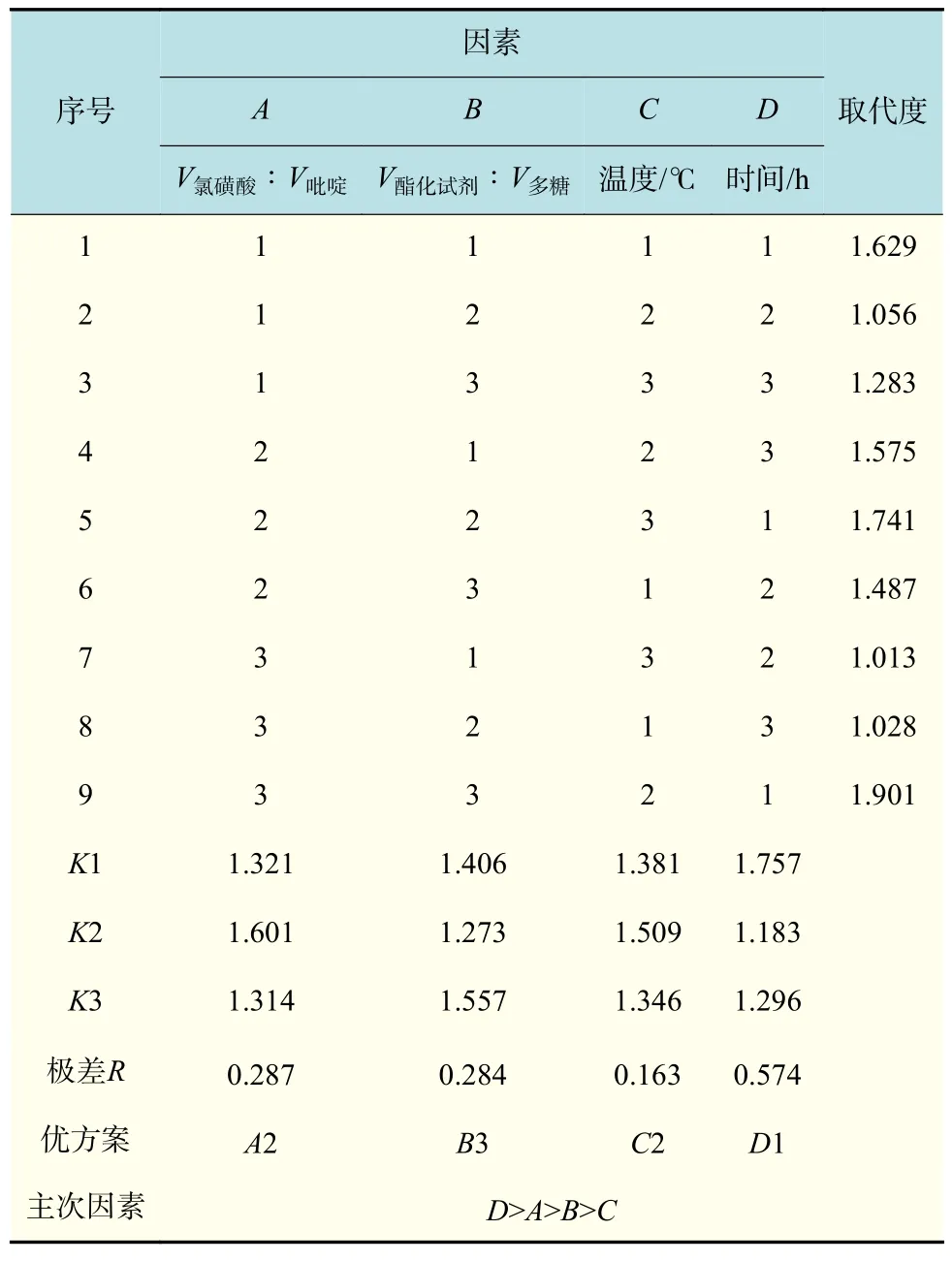
表 1 正交试验设计与结果Tab.1 Design and results of orthogonal experiment
2.3 红外光谱分析
采用溴化钾压片法,测得酯化多糖红外光谱图,如图6所示。
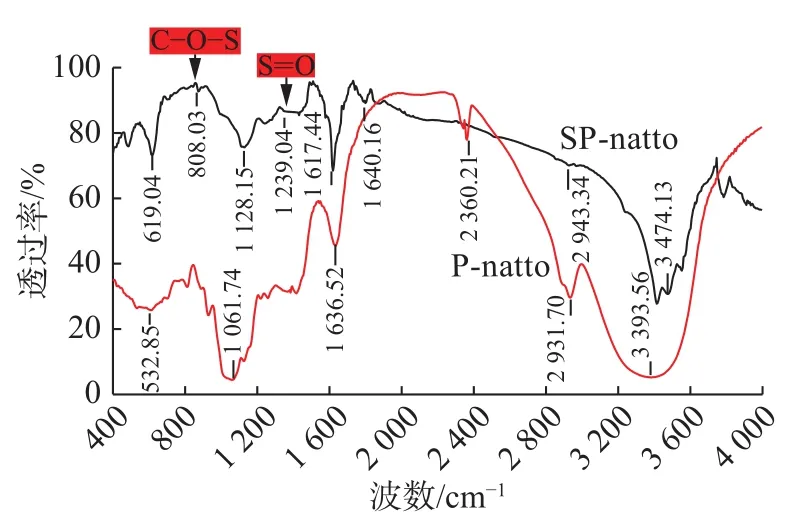
图 6 纳豆多糖和硫酸酯化多糖的红外光谱图Fig.6 Infrared spectra of nattopolysaccharidesand sulphated polysaccharides
图6为纳豆多糖(P-natto)和硫酸酯化多糖(SP-natto)的红外光谱图。在酯化纳豆多糖色谱图中,在3 474.13 /cm处的两个吸收峰为O—H及N—H的伸缩振动峰,在2 943 /cm处的吸收峰为C—H的伸缩振动,在1 640.16 /cm处吸收峰是C=O的伸缩振动,在1 128.15 /cm处的吸收峰是C—O—C的伸缩振动,以上均为多糖的特征吸收峰。相比纳豆多糖的振动吸收峰,酯化多糖在1 239 /cm处的吸收为 S=O的伸缩振动峰,808.03 /cm处吸收为C—O—S的伸缩振动峰,两者是硫酸酯的特征吸收峰[18],说明纳豆多糖经硫酸酯化后,硫酸基已与纳豆多糖结合成多糖硫酸酯。
2.4 酯化多糖的抑菌作用研究
2.4.1 酯化多糖与纳豆多糖对阪岐杆菌的抑制作用
分别配制一定浓度的硫酸酯化多糖与纳豆多糖,探究相同浓度的两种多糖对阪岐杆菌的抑制作用,抑制效果如图7所示。纳豆多糖与酯化多糖随着浓度的增加,其抑菌圈直径逐渐变大。质量浓度为1 mg/mL时,酯化多糖的抑菌圈直径小于纳豆多糖,说明酯化多糖抑制阪岐杆菌的效果低于纳豆多糖;随着浓度的增高,酯化多糖的抑菌圈直径均大于纳豆多糖,表明了在高浓度条件下,酯化多糖抑制阪岐杆菌的效果将逐渐高于纳豆多糖。
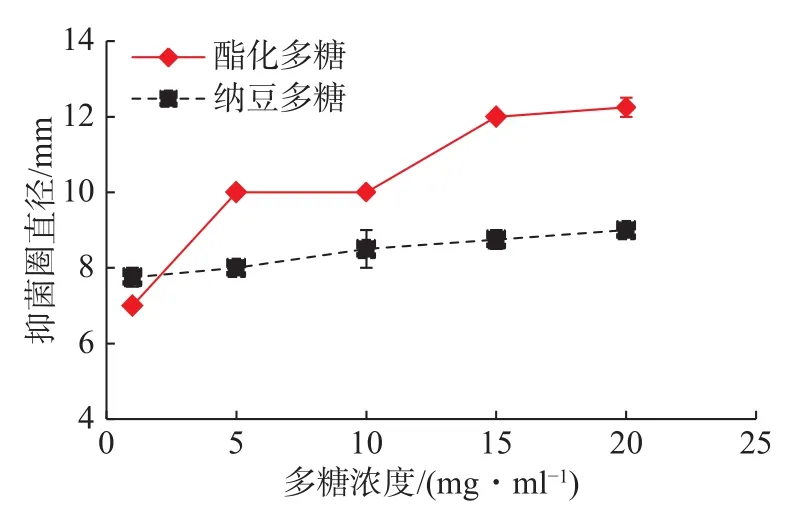
图 7 酯化多糖和纳豆多糖对阪岐杆菌的抑制作用Fig.7 Inhibition of Bntorobater sakazakii by sulphated polysaccharides and natto polysaccharides
2.4.2 酯化多糖与纳豆多糖对嗜水气单胞菌的抑制作用
在相同浓度下,酯化多糖与纳豆多糖对嗜水气单胞菌的抑制作用如图8所示。随着浓度的增高,硫酸酯化多糖的抑菌圈直径一直大于纳豆多糖,结果表明,纳豆多糖经硫酸酯化提高其硫酸根含量后,相同浓度下,酯化多糖对嗜水气单胞菌的抑制作用高于纳豆多糖。
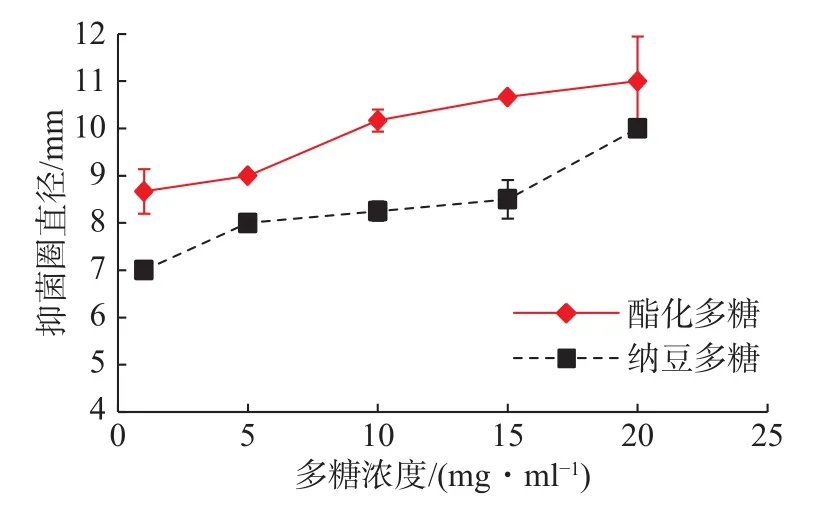
图 8 酯化多糖和纳豆多糖对嗜水气单胞菌的抑制作用Fig.8 Inhibition of Aeromonas hydrophila by sulphated polysaccharides and natto polysaccharides
2.4.3 酯化多糖与纳豆多糖对大肠杆菌的抑制作用
在相同浓度下,酯化多糖与纳豆多糖对大肠杆菌的抑制作用如图9所示。随着多糖浓度的增加,酯化多糖和纳豆多糖的抑菌圈直径也在增大,但在1~10 mg/mL的质量浓度范围内,酯化多糖的抑菌圈直径小于纳豆多糖,当多糖质量浓度大于10 mg/mL时,两种多糖的抑菌圈直径均增大,而酯化多糖增加的幅度更大。结果表明,酯化多糖和纳豆多糖对大肠杆菌都有抑制作用,但在质量浓度在1~10 mg/mL范围内,纳豆多糖的抑制效果高于纳豆多糖;多糖质量浓度在15~20 mg/mL中,两种多糖的抑制效果相似;李公斌[19]探究了黑木耳多糖经硫酸酯化后的抑菌功能,研究表明:随着培养时间的延长,对大肠杆菌的抑制作用为硫酸酯化黑木耳多糖大于黑木耳多糖。本试验的培养时间为24 h,若培养时间延长,酯化多糖对大肠杆菌的抑制效果有可能超越纳豆多糖。
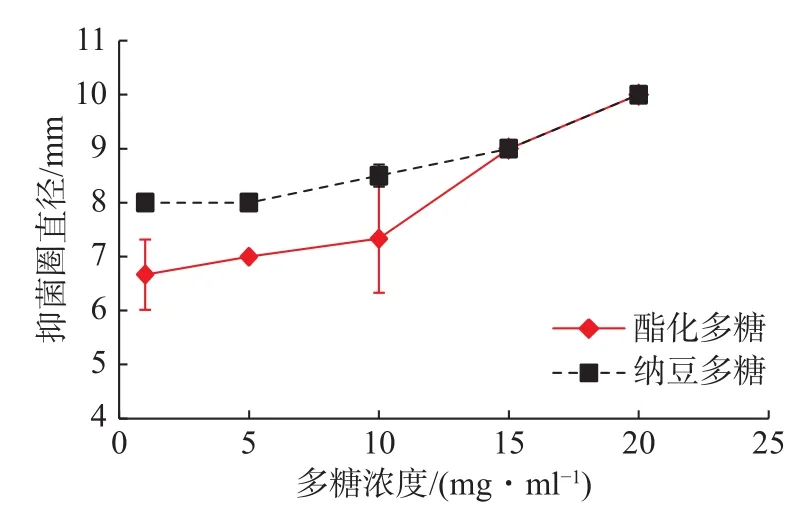
图 9 酯化多糖和纳豆多糖对大肠杆菌O157的抑制作用Fig.9 Inhibition of Escherichia coli O157 by sulphated polysaccharides and natto polysaccharides
3 结 论
a. 通过单因素试验和正交试验确定了硫酸酯化的最佳工艺条件:V氯磺酸∶V吡啶为1∶4,V酯化试剂∶V纳豆多糖为 4∶3,酯化时间为 1 h,酯化温度为60 ℃。在此工艺条件下,硫酸化纳豆多糖的取代度为1.613。
b. 红外光谱结果证实了纳豆多糖经硫酸酯化后,硫酸基已与纳豆多糖成功结合成多糖硫酸酯。
c. 硫酸化纳豆多糖对阪岐杆菌与嗜水气单胞菌的抑制作用比纳豆多糖高,且呈现剂量依赖性,而对大肠杆菌的抑制作用接近纳豆多糖。

