氨法浸出锌冶金渣尘提锌工艺及动力学研究
马爱元,郑雪梅,李 松
(六盘水师范学院化学与材料工程学院,贵州六盘水553004)
锌作为自然界资源分布较广的金属元素,主要以镀锌、锌基合金、氧化锌等形式广泛应用于汽车、建筑、船舶、航天等诸多领域。锌矿资源主要以硫化矿、氧化矿及其混合矿等形式存在。近年来,中国锌资源呈现富矿少,低品位矿多;大型矿少,中小型矿多;开采难度大等总体特征。目前世界上70%的锌来自锌矿产资源,而30%的锌来源于锌二次资源[1-3]。
中国的含锌二次资源来源广泛、种类多,包括:1)热镀锌渣、锌灰;2)铜铅锌等冶炼行业产生的冶炼渣(泥)及含锌烟尘;3)钢铁行业电弧炉烟尘和瓦斯灰(泥);4)载锌废催化剂;5)废旧锌锰电池、电路板等[4-9]。其中二次锌资源回收的锌超过200万t/a以上,同时锌金属、合金及锌化合物循环利用量的增长速度为原生锌产量增长速度的3倍,说明二次锌资源的回收在循环经济中占重要地位[10-11]。
目前,大宗量的二次锌资源属钢铁渣尘和锌冶炼渣尘,回收处理工艺主要有火法工艺和湿法两大类。火法工艺主要有烧结球团工艺、回转窑挥发工艺、转底炉直接还原工艺等。火法处理具有工艺流程简单、回收率高等优势,但存在设备维护成本高、工艺能耗大、易造成二次污染及对低含量锌粉尘回收效果不理想等缺点[12-13]。湿法处理工艺主要有酸浸法、碱浸法、氨浸法。酸法浸出工艺是目前锌冶炼企业回收锌的主流工艺,但含锌二次资源具有成分复杂、多类锌矿物相共存、碱性脉石成分高、氟氯杂质高等特点,获得较高的锌回收率需消耗大量的酸,酸耗的增加会导致设备腐蚀性加剧、碱性脉石难以处理、氟氯等杂质组元进入浸出液影响电锌质量等问题。碱法浸出和氨法工艺相对酸法浸出具有一定的选择性,能有效进行锌铁分离,碱性脉石成分及氟氯杂质组元不进入浸出液,且对设备的腐蚀性小,但现阶段工业应用的可行性较低[14-17]。
本文以含锌冶金渣尘为研究对象,研究其在NH3-CH3COONH4-H2O体系中的浸出行为,以期为二次锌资源的高效利用提供良好的技术途径。
1 实验原料及表征
1.1 原料成分分析
实验所用原料来自某锌二次资源综合回收企业,原料在85℃XTDQ-101-2A型恒温干燥箱中干燥至恒重后做成分分析,结果见表1。该原料成分复杂,锌、铁含量高,含有一定量的稀散伴生金属In,具有较高的回收利用价值。另外,该物料含有大量的Cl和碱性脉石成分。

表1 样品主要化学元素含量分析
将2 kg样品过筛分级,得到9个不同粒径样品,分别对样品做锌化学元素分析,结果见表2。由表2可以看出,有价金属Zn在不同粒径下分布均匀。
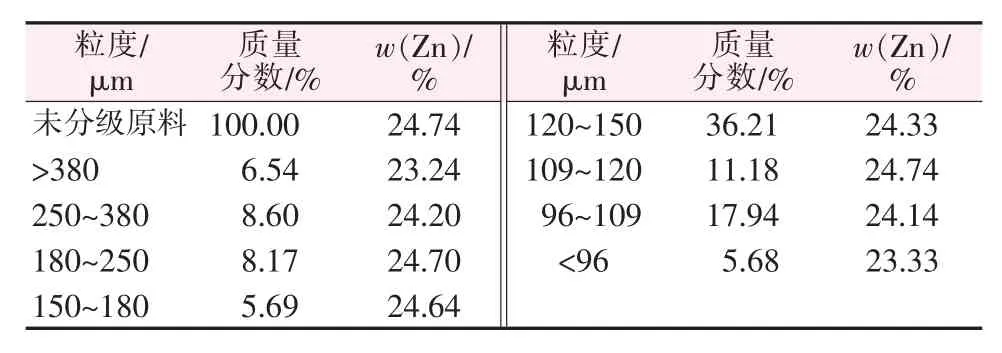
表2 各粒级锌含量及分布
1.2 矿物相及粒度分析
为确定冶金渣尘中各金属离子及杂质离子存在形式,对矿样做了XRD、SEM表征分析,结果分别如图1、图2所示。

图1 样品的XRD谱图

图2 样品的SEM照片
由 图1可 见,锌 主 要 以ZnO、Zn2SiO4、ZnS、ZnFe2O4和Zn5(OH)8Cl2·H2O形式存在,铁主要以Fe3O4和Fe2O3的形式存在。由图2可见,矿物体颗粒紧密,且颗粒间镶嵌了大量无定型絮状包裹物。
1.3 实验方法
实验在一个300 mL相对密闭的玻璃反应容器中进行,采用CJJ-6型双数显六联磁力加热搅拌器对样品及溶剂进行搅拌。浸出液中锌的浓度采用EDTA滴定法测定,测定过程中可能存在Cu2+、Al3+、Fe2+等对Zn2+产生干扰。为此,在加入二甲酚橙指示剂前添加饱和硫脲、抗坏血酸和氟化钾溶液以掩蔽干扰。锌提取率(ηZn,%)计算式:

式中,ρZn为浸出液中Zn的质量浓度,g/L;V为浸出液的体积,L;m为所称取样品的质量,g;wZn为样品中Zn的质量分数。
2 实验结果与分析
2.1 浸出实验研究
2.1.1 粒度对锌浸出率的影响
在总氨浓度为4 mol/L、液固比(体积质量比,下同)为3 mL/g、搅拌转速为300 r/min、n(NH3)/n(NH4+)=1∶1、温度为25℃、浸出时间为60 min的条件下,考察了不同粒度对锌浸出率的影响,结果见图3。从图3可见,粒度较小时锌浸出率相对较大,当粒度>380μm时锌浸出率为62.26%,当粒度为80~96μm时锌浸出率为68.75%;相同条件下未分级原料锌浸出率为67.23%,不同粒度的锌浸出效果差别不大,说明物料粒度对锌浸出率影响不大。为最大限度利用含锌二次资源,后续实验采用未分级处理的含锌冶金渣尘作为原料。
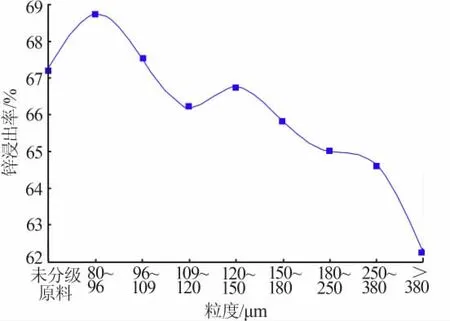
图3 不同粒度对锌浸出率的影响
2.1.2 时间对锌浸出率的影响
在总氨浓度为4 mol/L、液固比为3 mL/g、搅拌转速为300 r/min、n(NH3)/n(NH4+)=1∶1、温度为25℃条件下,考察了不同浸出时间对锌浸出率的影响,结果见图4。从图4可见,锌的浸出率随着时间的延长而增加。浸出时间在5~30 min,锌的浸出率增加较为明显;30~60 min时锌浸出率增加缓慢;60 min以后变化不是太明显。综合考虑,浸出时间为60 min时能实现锌的高效溶出。

图4 不同浸出时间对锌浸出率的影响
2.1.3 转速对锌浸出率的影响
在总氨浓度为4 mol/L、液固比为3 mL/g、n(NH3)/n(NH4+)=1∶1、温度为25℃、浸出时间为60 min的条件下,考察了不同搅拌速度对锌浸出率的影响,结果见图5。从图5可见,随着搅拌速度的增加锌浸出率不断升高,因为提升搅拌速度可加快浸出剂的扩散,从而强化锌的浸出;而当搅拌速度超过300 r/min时,继续增加搅拌速度则对锌浸出率影响不大。

图5 不同搅拌转速对锌浸出率的影响
2.1.4 液固比对锌浸出率的影响
在总氨浓度为4 mol/L、搅拌转速为300 r/min、n(NH3)/n(NH4+)=1∶1、温 度 为25℃、浸出时间为60 min的条件下,考察了不同液固比对锌浸出率的影响,结果见图6。从图6可见,随着液固比增大锌浸出率增加,液固比较小时锌浸出率相对较低,液固比从2 mL/g增至4 mL/g,锌浸出率从47.35%提升至77.21%,继续增大液固比对锌的浸出效果明显减弱,液固比大于5 mL/g时,锌浸出率增加不明显,控制液固比为5 mL/g锌浸出率可达79.88%。

图6 不同液固比对锌浸出率的影响
2.1.5 总氨浓度对锌浸出率的影响
在液固比为5 mL/g、搅拌转速为300 r/min、n(NH3)/n(NH4+)=1:1、温 度 为25℃、浸 出 时 间 为60 min的条件下,考察了不同总氨浓度对锌浸出率的影响,结果见图7。从图7可见,总氨浓度对锌浸出率的影响较为显著,锌溶出率随总氨浓度的增加而升高,总氨浓度为2 mol/L时,锌的浸出率较低仅为49.49%;总氨浓度为5 mol/L时,锌浸出率可达到83.86%,锌浸出率提升近30%;当总氨浓度高于5 mol/L时,锌的浸出速率明显降低。综合考虑,实验选择适宜的总氨浓度为5 mol/L。
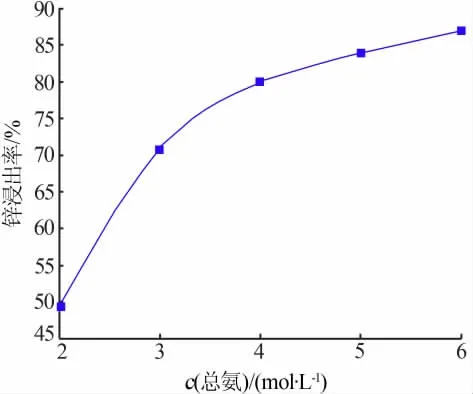
图7 不同总氨浓度对锌浸出率的影响
2.1.6 氨/铵比对锌浸出率的影响
在总氨浓度为5 mol/L、液固比为5 mL/g、搅拌转速为300 r/min、温度为25℃、浸出时间为150 min的条件下,考察了不同氨/铵比(纯氨水与乙酸铵物质的量比)对锌浸出率的影响,结果见图8。从图8可见,采用纯氨水作为浸出剂时锌浸出率较低(32.45%),采用乙酸铵作为浸出剂时锌浸出率相对较高(77.40%),另外,NH3浓度的增加有利于锌浸出率的提高,当n(NH3)/n(总氨)=0.5时,即n(NH3)/n(NH4+)/n(RCOO-)=1∶1∶1时,能实现锌的最大溶出,锌的浸出率达83.86%,说明添加CH3COONH4作为浸出剂可强化锌的溶出。

图8 不同n(NH3)/n(总氨)对锌浸出率的影响
2.1.7 温度对锌浸出率的影响
在总氨浓度为5 mol/L、液固比为5 mL/g、搅拌转速为300 r/min、n(NH3)/n(NH4+)=1∶1、浸出时间为60 min的条件下,考察了不同温度对锌浸出率的影响,结果见图9。从图9可见,当温度从25℃升至35℃时,锌浸出率从83.86%降至73.96%,而当温度高于35℃后,随着温度的升高锌浸出率呈升高趋势,55℃时锌浸出率为84.14%。出现这种规律的原因主要是在35℃以下时,NH3的蒸发减少了浸出剂的含量,从而降低了锌的浸出率;当温度高于35℃时,温度的升高大幅度改善了浸出剂与锌颗粒之间的反应速率及扩散速率,加速浸出剂分子的运动,NH3挥发对锌浸出率的影响同时得到了削弱。因此,温度的升高强化了锌的高效溶出。
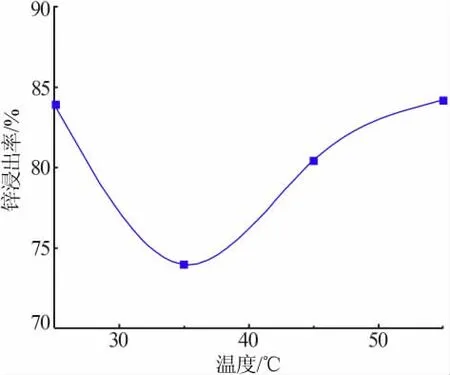
图9 不同温度对锌浸出率的影响
综合上述实验结果,得到含锌冶金渣尘在NH3-CH3COONH4-H2O体系下浸出的较佳工艺条件:浸出温度为25℃、总氨浓度为5 mol/L、液固比为5 mL/g、n(NH3)/n(NH4+)=1∶1、搅拌速度为300 r/min、浸出时间为60 min,在此条件下锌的浸出率可达84%。
2.2 浸出过程动力学分析
含锌冶金渣尘颗粒成分复杂,有单一的铁颗粒、铁氧化物颗粒、钙镁脉石颗粒,Zn物相镶嵌于惰性脉石和铁氧化物颗粒中,浸出过程浸出剂扩散到脉石的空隙或裂缝与含锌矿物发生反应,随着反应的进行,反应界面不断地向含锌矿物颗粒中心内收缩,副产物或残留固体层不断地变厚,从而增大浸出剂反应物或产物的扩散通径,有可能阻碍浸出剂反应物或产物的扩散速率,另外惰性的脉石固体残留物易包裹未反应的收缩核,进而成为含锌矿物颗粒浸出率的控制因素,类似的研究也鲜有报道[18],因此尝试采用收缩核模型来探索锌冶金渣尘浸出的动力学行为。其浸出过程的反应模型如图10所示。
假设含锌颗粒为近似球型的几何体,且浸出过程受固体产物膜层的扩散控制,含锌冶金渣尘的浸出动力学方程式[18]:

图10 浸出过程示意图
如果浸出过程受界面化学反应控制,则含锌冶金渣尘含锌颗粒的浸出动力学方程式[18]:

如果含锌冶金渣尘浸出过程的锌浸出速率同时受边界界面反应和扩散混合控制,则其动力学方程式[19]:
式(2)、(3)、(4)中,kd为固-液相反应扩散速率常数;kr为固-液相界面化学反应速率常数;k0为固-液相混合控制反应速率常数;x为含锌冶金渣尘锌浸出率;t为浸出时间。
进行不同反应温度、不同浸出时间对含锌冶金渣尘锌浸出率的影响实验,并将实验数据分别带入方程(2)、(3)和(4),作1-2/3x-(1-x)2/3、1-(1-x)1/3和1/3ln(1-x)-1+(1-x)-1/3对时间t的变化曲线,结果分别如图11、12和13所示。从图11~13可以发现,锌的反应过程均呈两段式变化,一段浸出过程反应速率较二段反应速率大,说明同一温度下,20 min内时间的变化对锌的浸出效果影响显著,这与图4的浸出效果相吻合。
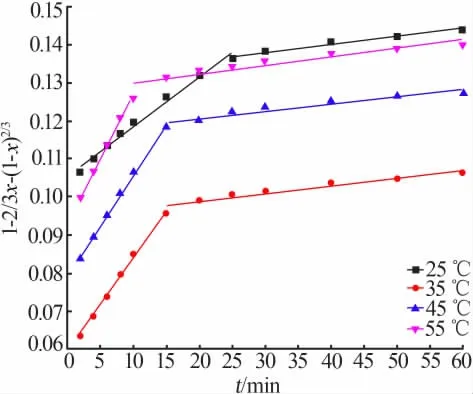
图11 不同温度下1-2/3x-(1-x)2/3与t的关系图
另外,根据图11、12及13得到不同温度下锌浸出过程接近平衡前(即一段拟合方程)的反应速率常数k,分别带入Arrhemus经验方程[20]:

式中,Ea为反应活化能,kJ/mol;A为频率因子常数;T为温度,K;R为气体常数,8.314×10-3kJ/(mol·K)。
对式(5)两边取对数,得到ln k与1/T的关系式:

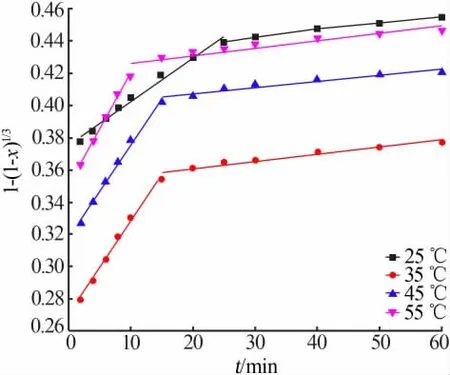
图12 不同温度下1-(1-x)1/3与t的关系图
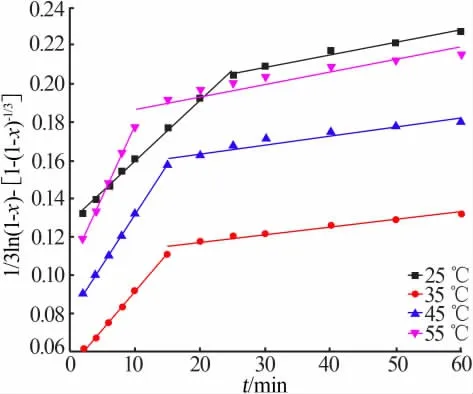
图13 不同温度下1/3ln(1-x)-1+(1-x)-1/3与t的关系图
以ln k对1/T作图,结果见图14。由图14可见,采用混合控制拟合得到ln k对1/T曲线的相关拟合度(R2=0.981 2)明显高于扩散控制(R2=0.787 7)及界面化学反应控制(R2=0.657 1),进一步说明含锌冶金渣尘在NH3-CH3COONH4-H2O体系中浸出过程的锌浸出速率受混合控制影响,初始反应表观活化能为22.66 kJ/mol。
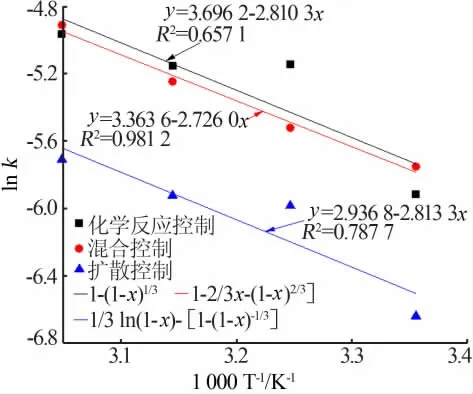
图14 1-2/3x-(1-x)2/3、1-(1-x)1/3和1/3ln(1-x)-1+(1-x)-1/3模型ln k与1 000/T的关系图
在不同总氨浓度、搅拌速度及液固比条件下作1/3ln(1-x)-1+(1-x)-1/3与t的关系曲线,结果见图15。得到不同浸出条件下的表观速率常数k1、k2及k3,以ln k1对ln c(总氨)、ln k2对ln(转速)及ln k3对ln(液固比)作图,如图16所示,拟合得到的直线方程斜率即为表观速率方程中总氨浓度、搅拌速度及液固比的表观反应级数,分别为3.224 0,-1.362 5及3.142 5。
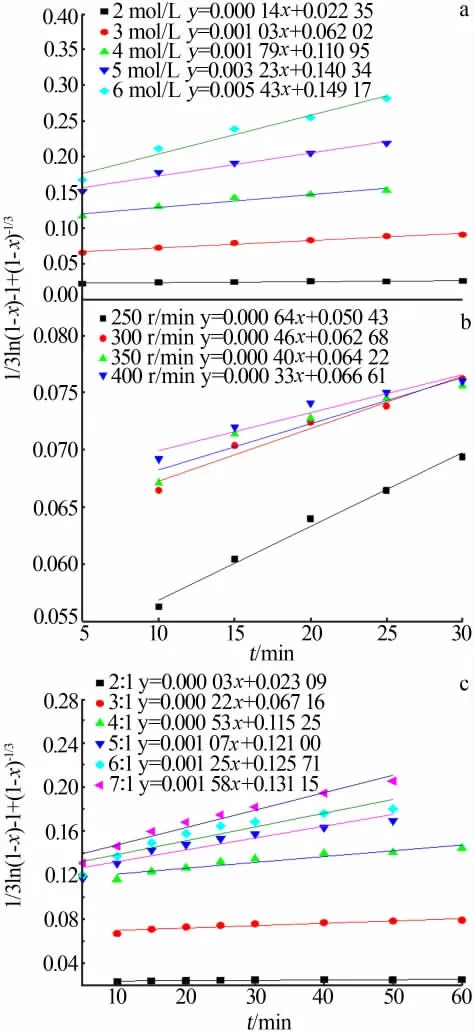
图15 不同单因素条件下1/3ln(1-x)-1+(1-x)-1/3与时间的关系图
建立含锌冶金渣尘在NH3-CH3COONH4-H2O体系中锌浸出过程的动力学速率方程:

将与总氨浓度、搅拌速度、液固比的表观反应级数及与温度相关的反应初始活化能带入方程(7)中,即可得到含锌冶金渣尘在NH3-CH3COONH4-H2O体系中浸出锌的动力学速率方程:
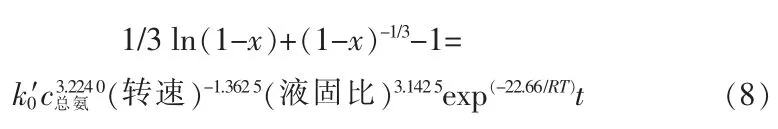
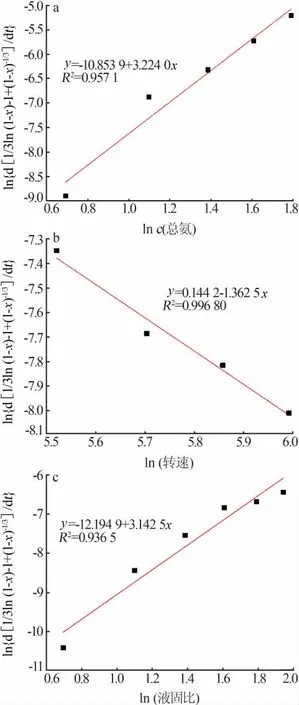
图16 ln{d[1/3ln(1-x)-1+(1-x)-1/3]/dt}分别与ln c(总氨)、ln(转速)及ln(液固比)的关系曲线
3 结论
1)探索实验研究发现,控制浸出温度为25℃、总氨浓度为5 mol/L、液固比为5 mL/g、n(NH3)/n(NH4+)=1∶1、搅拌速度为300 r/min、浸出时间为60 min,在此条件下锌的浸出率可达84%。2)进行NH3-CH3COONH4-H2O体系浸出含锌冶金渣尘动力学分析,浸出反应表观活化能为22.66 kJ/mol,锌浸出过程的浸出速率受扩散及界面化学反应混合控制,浸出锌的动力学速率方程:


