α-NETA 在上皮性卵巢癌细胞中功能研究
乔联桥,吴晓梅,席晓薇
作者单位:上海市第一人民医院妇产科,上海 200080
卵巢恶性肿瘤是全世界女性生殖器官最常见的恶性肿瘤之一,有研究显示,化疗耐药是卵巢癌高死亡率的重要原因之一[1]。因此,寻找研发更加有效敏感的化疗药物,开发新的治疗手段,对广大卵巢癌病人有着深刻意义。
α-NETA(N,N,N-trimethyl-y-oxo-1-naphthalenepropanaminiumiodide)作为小分子化学药物,是一种乙酰胆碱转移酶抑制剂(Choline Acetyl Transferase,ChAT)(IC50=9 µmol/L),一般用于神经细胞功能实验的实验室研究[2],2017年有报道发现化疗药物与细胞凋亡之间存在相关关系[3]。研究发现其有发挥杀灭肿瘤细胞的新功能。β-arrestin2 是一类Arrestin家族成员,它不仅参与调节G蛋白偶联受体(G protein-coupled receptors,GPCRs)的脱敏和内化,还可以作为支架蛋白转导细胞信号通路[4-8]。有研究证实,β-arrestin 2 以及β-arrestin 1 具有抗细胞焦亡作用,同时β-arrestin 2 可以通过多种途径调节免疫反应,如抑制NF-KB 活化、调节趋化因子受体介导的免疫细胞趋化等,同时还与免疫系统疾病、炎症、肿瘤等相关[4-8]。本研究自 2015年 1月至 2016年1月研究α-NETA 在上皮性卵巢癌细胞中的功能。
1 材料与方法
1.1 材料 上皮性卵巢癌细胞株:HO8910 和Hey细胞株购买自美国ATCC 公司。Moody 从本实验室获取。裸鼠BALB/c 经上海市第一人民医院动物实验动物中心申请获取。细胞培养液采用DMEM(Dulbeccoo’s Modification of Eagle’s Medium Dulbecco)(购买于Gibco)加10%FBS 加1%双抗生素。抗体anti-β-arrestin2,anti-GAPDH,α-NETA 购买于Abcam公司。
1.2 CCK8(Cell Counting Kit-8) 培养皿中培养细胞至融合度约90%。胰酶消化细胞,配制细胞悬液,约2×104~2×105/mL 左右。在96 孔板中铺板,培养箱培养24 h。用DMEM空白培养基配制α-NETA 药物浓度梯度液(5,25,12.5,6.25 µg/mL),更换细胞培养液,加入药物浓度梯度液,每孔100 µL。将培养板在培养箱孵育24 h。向每孔加入10 µL CCK8溶液。将培养板在培养箱内孵育1~4 h。用酶标仪测定吸光度。
1.3 流式细胞死亡检测 配制细胞悬液六孔板铺板,保持细胞密度约70%,培养箱(37 ℃,5%二氧化碳)培养 24 h。根据 IC50(half maximal inhibitory concentration)使用空白 DMEM 稀释 α-NETA 母液,实验组三孔更换加入药物的空白培养液,使用空白培养基设立三孔对照组。培养箱内孵育24 h 后分别消化两组细胞配制细胞悬液。按表1 设计加入Annexin V 与核酸染料。轻轻混匀,室温避光放置15 min,1 h内上机操作检测。
记录相应数据后统计分析作图。

表1 流式细胞死亡检测过程中加入试剂名称
1.4 体内动物实验 取15 只雌性免疫缺陷裸鼠(BALB/c)用于异种移植研究。每5只小鼠圈养在一个笼子中,每天12 h 昼夜交换模式,可以随意获取食物和无菌水。将α-NETA 溶于99.5%甲醇(上海世益化学品有限公司),用Opti-MEM(Gibco 31985070,USA)配制溶液为12.5µg/mL。使用PBS配制HO8910 细胞悬液,每只小鼠在左腋窝皮下注射约1×107HO8910 细胞。每日称重小鼠并每隔一天测量肿瘤。肿瘤体积计算:瘤体积(mL)=长×(宽)2×0.5。2周后,将15只小鼠随机分成三组,(对照组,实验组1 和实验组2)。当肿瘤达到≥0.15 mL的体积时,用药物治疗小鼠。实验组1(n=5)每只小鼠每天注射50µLα-NETA工作溶液,对照组(n=5)皮下注射与实验组相同浓度的载体液体。实验组2(n=5)在1 周前以与对照组相同的方式进行治疗,并且在1 周后进行与实验组1 相同的治疗。根据伦理准则,当肿瘤达到2 mL体积或直径超过2 cm时,处死动物,然后切除肿瘤。将肿瘤在冰箱中于-80 ℃冷冻。密切监测小鼠的体重减轻和其他毒性迹象。通过Kruskal-Wallis检验将三组的统计学(肿瘤体积,肿瘤重量和小鼠体质量)用于比较分析。
1.5 统计学方法 使用SPSS 和GraphPad Prism 软件进行统计分析和制作图表。数据采用表示。两组间比较采用t检验。多组间比较采用Kruskal-Wallis检验。P<0.05被认为差异有统计学意义。
2 结果
2.1 α-NETA 诱导上皮性卵巢癌细胞死亡 图1A所示为100 倍显微镜下杀灭效果。使用CCK8 对HO8910,Hey 和正常卵巢细胞株Moody 细胞系进行细胞毒性测定(图1B)。同时,进行IC50 计算:HO8910=6.28 µg/mL,Hey=26.34 µg/mL,Moody=45.29 µg/mL(1 µm α-NETA=369.24 mg;1 mg α-NETA=0.27 µmol)。用浓度为12.5 µg/mL α-NETA 的空白培养基处理HO8910 24 h(与对照相同浓度的甲醇),并使用流式细胞仪进行死亡率测定(图1C)。α-NETA 组的死亡率46.8%远高于对照组的2.8%。所有实验进行了3次以上的独立重复实验。
2.2 α-NETA 可抑制体内肿瘤生长 在免疫缺陷小鼠BALB/c 异种移植模型中检测α-NETA 在体内作用效果。HO8910细胞用于皮下肿瘤形成。通过瘤内注射方式给药。图2A 为动物实验周期图。图2B示,与对照组相比,实验组1(治疗1周)和实验组2(治疗2 周)的肿瘤体积(P=0.007)和肿瘤重量(P=0.004)都有所减少。Kruskal-Wallis 检验三组间比较,P<0.01。α-NETA 使用浓度未观察到小鼠中毒或者死亡现象。
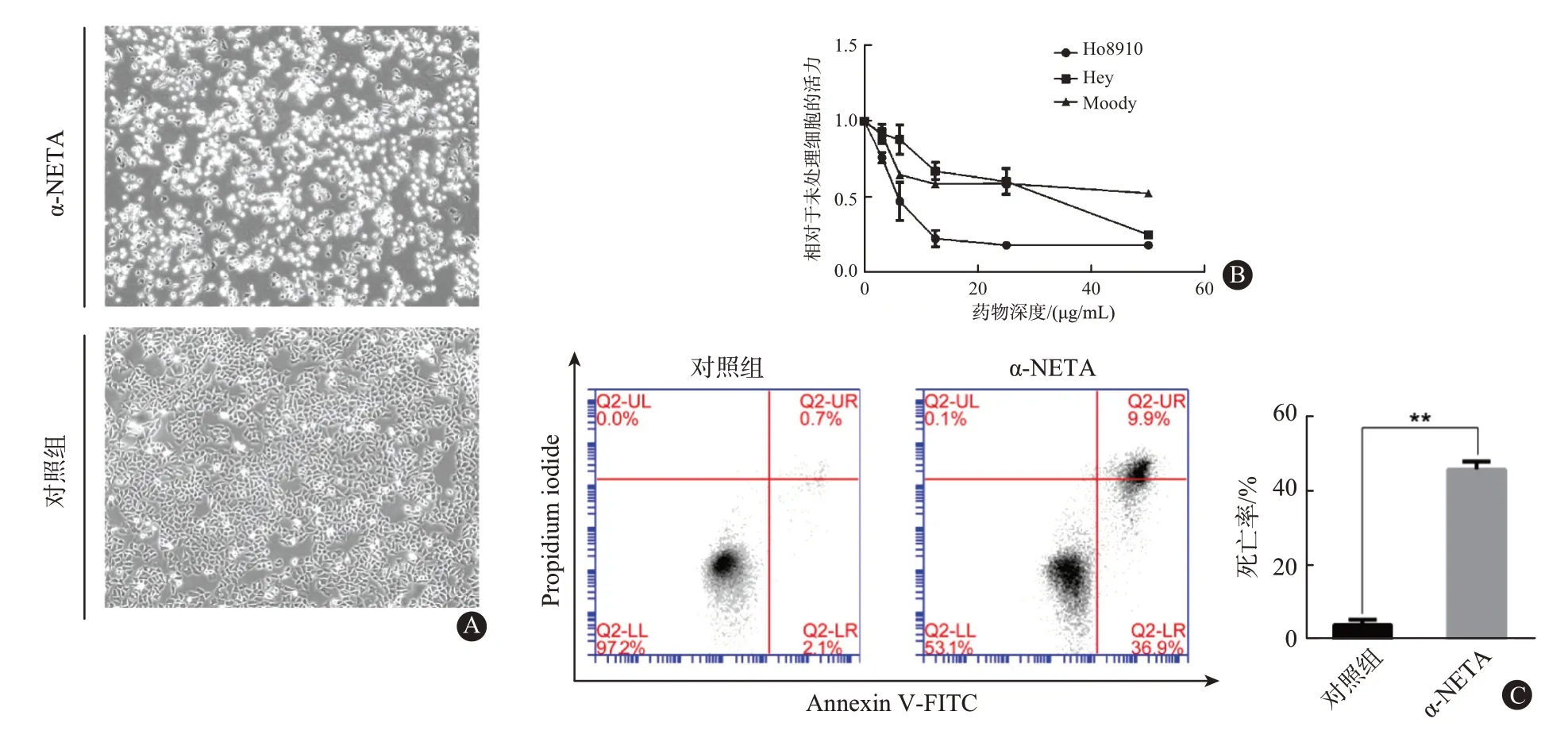
图1 α-NETA细胞学药物毒性检测:A为100倍显微镜下浓度12.5µg/mL α-NETA作用HO8910细胞24 h后实验组与对照组效果图,B为对HO8910,Hey卵巢癌细胞株以及正常卵巢细胞株Moody进行CCK8毒性检测,C为流式细胞仪进行死亡率测定
2.3 α-NETA 通过β-arrestin 2 介导杀死肿瘤细胞 将α-NETA 处理后的HO8910 细胞与对照组细胞进行WB 检测,结果发现处理组HO8910 细胞βarrestin 2 表达增加(图3A)。同样检测CMKLR1 的表达情况,结果差异无统计学意义(数据未展示)。这表明β-arrestin 2作为一个与细胞膜表面的G蛋白偶联受体CMKLR1 密切相关的蛋白参与了杀死肿瘤细胞的过程。同时,根据之前化疗药物与细胞焦亡相关的报道[3],对α-NETA 处理后的上皮性卵巢癌细胞HO8910 进行显微镜下观察,发现产生有细胞焦亡相关的特征性大泡(图3B)。
3 讨论
本研究的开端起源于一个偶然的发现。α-NETA 是CMKLR1的一个新型抑制剂可以通过调节βarrestin2 抑制 CMKLR1 活性[2]。起初我们推测,CMKLR1被α-NETA处理后会可能会抑制上皮性卵巢癌细胞迁移,于是我们进行了细胞划痕实验,但是我们发现用α-NETA 处理卵巢癌细胞后,发现细胞停止生长,甚至死亡。经过反复实验验证之后,发现这并非一个偶然现象。
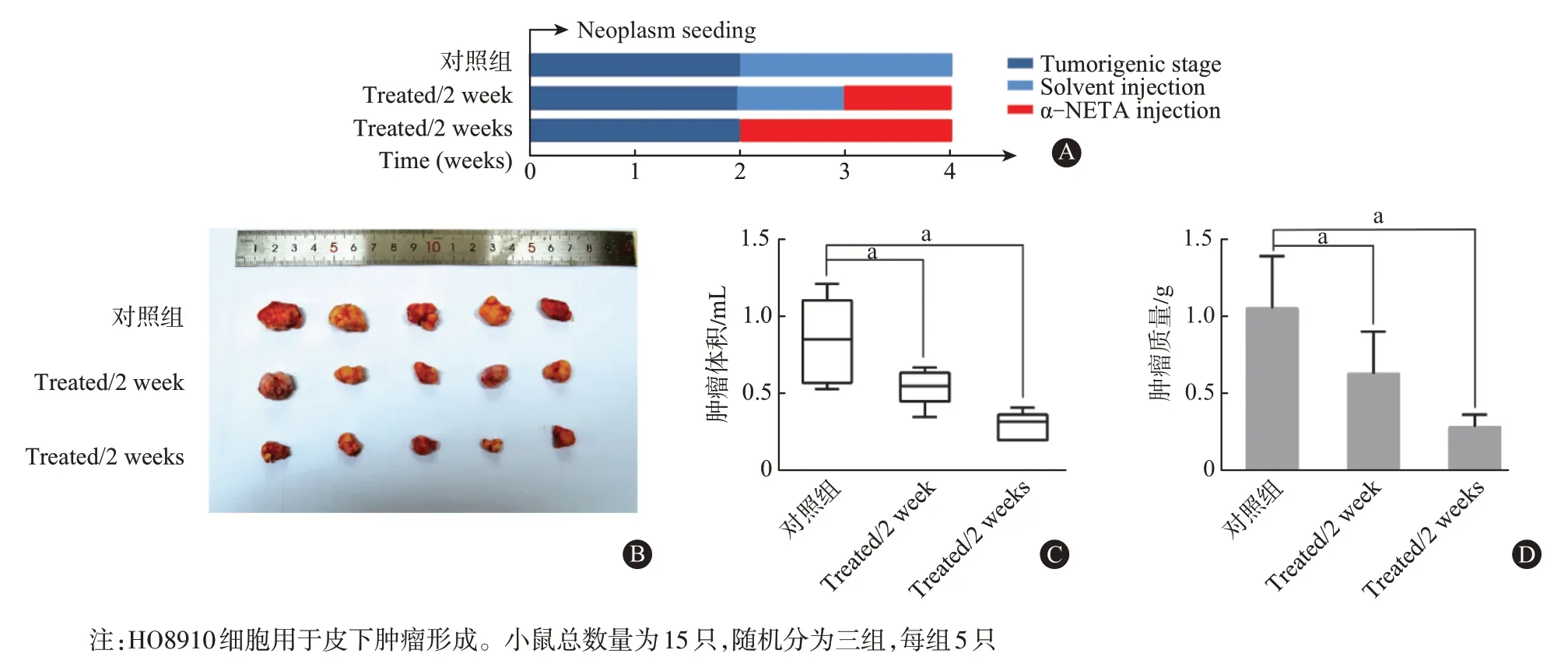
图2 α-NETA体内动物实验:A为体内实验周期图表。B为小鼠肿瘤离体照片,从上到下分别为对照组,治疗组1(Treated/1 week),治疗组2(Treated/2 week)。C为三组肿瘤体积的统计分析(P=0.007)。D为三组肿瘤质量的统计分析(P=0.004)。Kruskal-Wallis检验三组间比较,aP<0.01
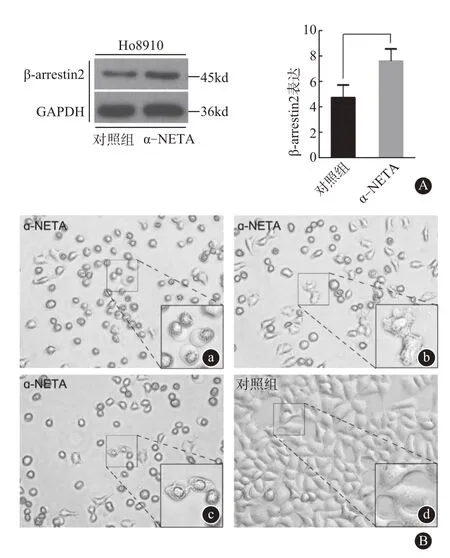
图3 α-NETA杀灭肿瘤细胞相关通路探究:A为对α-NETA处理后细胞蛋白进行3次独立重复WB检测结果发现处理组HO8910细胞较对照组β-arrestin 2表达增加,aP<0.05,B为显微镜下200倍镜像观察,可见α-NETA处理组中有与细胞焦亡相关特征性大泡产生,见图a,b,c右下角所示。对照组无相关现象(见图d)
随后,我们进行了体内动物实验,发现了特定浓度下α-NETA的抗肿瘤作用。但是对于每一个小分子化疗药物,不可避免地一个问题就是药物的副作用表现,即毒性表现。我们通过小鼠活动力,体重等指标观察发现,与对照组相比,α-NETA治疗后的小鼠体重上升不明显,而且实验组小鼠有弓背表现,虽然并未发现影响小鼠活力,但是我们推测α-NETA 还是存在一定的毒性或者是神经性毒副作用。但是这并不能否定α-NETA作为一个新型抗肿瘤小分子化学药物的可能性。
更进一步地,我们在细胞死亡通路研究检测中发现了β-arrestin2 的差异表达,在之前文献报道中有提及,α-NETA可以通过调节β-arrestin2在细胞膜内富集与CMKLR1细胞膜内羧基末端结合,从而导致CMKLR1,G蛋白偶联受体的失活。α-NETA在此过程中扮演了G 蛋白偶联受体的配体,替代chemerin 与其产生竞争与CMKLR1 结合发挥作用。该细胞通路被此前文献证明确实是存在的[9],但是该通路的作用仅仅是被证明是抑制肿瘤细胞迁移,抑制肿瘤细胞增殖的作用。总之,本课题研究发现了β-arrestin2 可能参与了细胞死亡,之前有文献报道过Arrestin家族蛋白参与抑制细胞凋亡[4-8]。但同时也有文献报道化疗药物所致细胞死亡属于细胞焦亡[3]。所以,本课题要完全确定α-NETA 介导细胞死亡是哪种细胞死亡方式,还需要后续深入研究。但是,α-NETA作为小分子化学药物,其发挥的抗肿瘤细胞的新功能,是具有一定的临床意义与研究价值的。

