腹腔镜与开放手术治疗结直肠癌的临床效果及预后分析
吴 军,贾成功,史传文
(1.阳谷县人民医院普通外科,山东 聊城,252300;2.山东省泰山疗养院外科)
结直肠癌是常见的消化道恶性肿瘤之一,严重危害人类健康。在西方发达国家,结直肠癌是发病率仅次于肺癌的恶性肿瘤[1]。随着生活水平的不断提高,人们生活习惯也发生了较大改变,长期摄入高蛋白高脂肪食物,运动量与体力活动减少,使得近年结直肠癌的发病率逐年递增[2]。手术是结直肠癌首选且疗效较佳的方法,传统开腹根治术创伤较大、术后康复较慢、疼痛明显等一系列问题困扰着患者与术者[3]。在保证治疗安全性及有效性的前提下,最大可能减少由手术带来的创伤是学者共同追求的目标之一。进入21世纪后,科学技术水平不断进步,腹腔镜手术器械的研发应用,为结直肠良恶性疾病的治疗开创了新天地。然而结直肠癌患者腹部戳孔是否增加复发风险的疑虑使得腹腔镜结直肠癌根治术的有效性与安全性受到质疑[4]。本研究回顾分析2012年5月至2014年10月收治的118例结直肠癌患者的临床资料,根据手术方式进行分组,观察两种手术方式的治疗效果,并通过COX比例风险模型对患者预后进行多因素分析,旨在为结直肠癌临床手术方式的选择及生存、预后提供理论依据,现将结果报道如下。
1 资料与方法
1.1 临床资料 回顾分析2012年5月至2014年10月我院收治的118例结直肠癌患者的临床资料,依照手术方式分为腹腔镜组(n=60)与开腹组(n=58)。两组患者一般资料差异无统计学意义(P>0.05)。见表1。

表1 两组患者临床资料的比较
1.2 纳入标准 (1)在本院进行手术治疗,术前行电子肠镜检查,并通过病理证实为原发性结直肠癌;(2)未发现远处脏器转移;(3)术前未接受放疗或化疗;(4)术后病理诊断结果为腺癌或黏液腺癌;(5)美国麻醉医师协会分级为Ⅰ~Ⅲ级。
1.3 排除标准 (1)术前进行放疗、化疗;(2)有腹部手术史;(3)由于肠梗阻、穿孔、出血等进行急诊手术;(4)术中发现存在腹腔广泛粘连或肿瘤广泛转移;(5)复发肿瘤;(6)有其他消化系统肿瘤;(7)术后病理证实为良性病变;(8)临床资料不全。
1.4 手术方法 两组患者均进行常规的术前准备,完善各项相关检查,遵循肿瘤根治原则。
1.4.1 开腹组 采用气管插管静脉复合全身麻醉,患者取平卧位或截石位,依照病灶部位与病灶大小选择切口部位与大小,乙状结肠切除术切口位置为中下腹部旁正中;左半与右半结肠切除术手术切口为中腹部旁正中或经腹直肌旁。探查腹腔,包括腹膜、胆囊、肝脏、大网膜、胃、健侧大肠、小肠、胰腺、盆腔、血管、淋巴结,如果肿瘤下缘与肛门的距离在5 cm以上,则行Dixon术;如果5 cm以下,则行Miles术。清扫边缘淋巴结、中间淋巴结、主淋巴结。
1.4.2 腹腔镜组 全麻下患者取头低脚高截石位,建立气腹,脐下、下腹部做4个操作孔,置入腹腔镜、超声刀、操作钳。探查腹腔,如果肿瘤侵出浆膜层,则改行开腹手术。术中常规纤维结肠镜检查,精确定位病灶。使用超声刀切开后腹膜与肠系膜,分离肠系膜下血管至根部,通过血管切割器离断。(1)结肠癌:超声刀扇形切除结肠系膜,上至肿瘤上缘10 cm,下至肿瘤下缘10 cm,切割缝合器切断,闭合下段肠管,左腹Trocar孔延长为小切口,置入切口保护器,将近端肠管与被切除的系膜一并拖出,距近端肠管10 cm处切断。移除标本,将腹腔内的远端肠管拖出,与近端肠管吻合,关闭系膜裂孔。(2)直肠癌:于肿瘤上15 cm拟定切断部位用超声刀分离乙状结肠系膜直至肠系膜下血管,切断,超声刀盆腔锐性解剖清扫,切开两侧后腹膜,显露双侧输尿管。沿患者腹主动脉前方向下剥离,进入直肠后间隙,骶前筋膜前通过超声刀锐性分离,最远达肛尾韧带上方,分离距离根据肿瘤下缘位置决定,一般为肿瘤下缘5 cm,如果肿瘤下缘与肛缘距离为5~10 cm,则行全直肠系膜切除术,肛提肌上可保留3~5 cm无瘤肠段,行结直肠吻合,肿瘤标本经左下腹小切口取出。如果肿瘤下缘与肛门缘距离小于5 cm,取会阴部切口,肿瘤上方15 cm处切断肠管,标本由会阴部取出,近端肠管拖至左下腹造瘘。清扫边缘淋巴结、中间淋巴结、主淋巴结。
1.5 观察指标 (1)围术期指标:详细记录两组手术时间、术中出血量、术后引流量、肛门排气时间、留置尿导管时间、总住院时间。(2)术后并发症:比较两组吻合口漏、切口感染、肺部感染、泌尿系统感染、肠梗阻等发生率。(3)对两组患者进行5年的随访,随访方式为电话随访与门诊复查,随访截至2019年10月,随访率100%,比较两组患者术后3年、5年累计生存率。(4)Cox比例风险模型回归分析:通过Cox比例风险回归模型分析影响结直肠癌手术患者预后的危险因素。
1.6 统计学处理 采用SPSS 22.0软件进行数据分析,组间计量资料的比较采用t检验,计数资料比较采用χ2检验,采用Kaplan-Meier法计算生存率,通过Log-rank检验进行单因素分析,筛选出的变量进行多因素分析,建立预后Cox模型,P<0.05为差异有统计学意义。
2 结 果
2.1 两组围术期指标的比较 腹腔镜组手术时间长于开腹组(P<0.05);腹腔镜组术中出血量、术后引流量少于开腹组,肛门排气时间、留置尿导管时间、总住院时间短于开腹组(P<0.05)。见表2。
2.2 两组术后并发症的比较 腹腔镜组术后并发症发生率(8.33% vs. 24.14%)低于开腹组,差异有统计学意义(P<0.05)。见表3。
2.3 两组术后3年、5年无瘤生存率与总生存率的比较 腹腔镜组3年累计生存率为68.33%,开腹组为65.52%,两组相比差异无统计学意义(P>0.05);腹腔镜组5年累计生存率为55.00%,开腹组为53.45%,两组相比差异无统计学意义(P>0.05)。见图1、图2。

表2 两组患者围术期指标的比较

表3 两组患者术后并发症发生率的比较[n(%)]
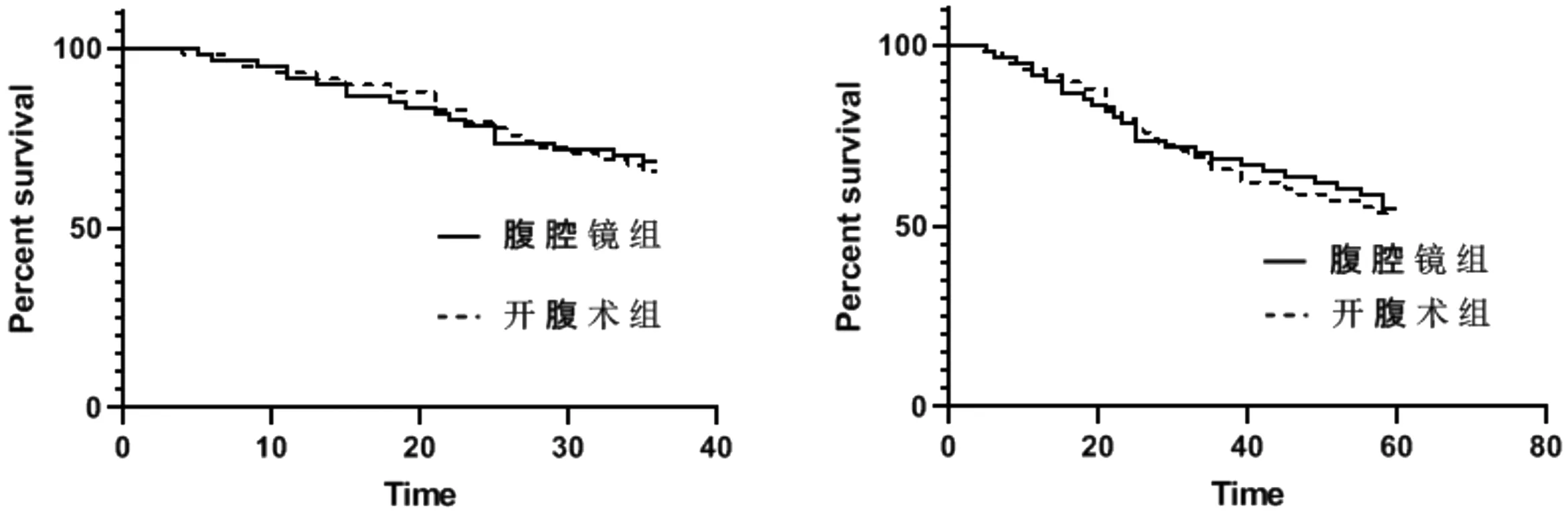
图1 两组3年累计生存分析 图2 两组5年累计生存分析
2.4 影响结直肠癌患者预后的单因素分析 单因素分析显示,年龄、并发疾病、肿瘤大小、肿瘤大体分型、肿瘤分化程度、TNM分期、淋巴结转移数量是影响结直肠癌患者预后的重要因素,见表4。
2.5 影响结直肠癌患者预后的COX模型多因素分析 将单因素分析有意义的因素引入COX模型进行多因素分析,结果显示并发疾病、TNM分期、肿瘤分化程度、淋巴结转移是影响结直肠癌患者预后的独立因素。见表5。
3 讨 论
自1990年施行首例腹腔镜右半结肠切除以来,近年随着超声刀、腔内切割吻合器、LigaSure的出现及腹腔镜技术水平的不断提高,腹腔镜已广泛应用于结直肠外科[5]。结直肠癌发病年龄早,危害性较大,尽早进行治疗对提高患者生存率、改善患者生存状态具有重要价值。腹腔镜手术是否符合临床肿瘤根治性切除原则是其最大争议,病灶切除范围及淋巴结清扫情况是影响结直肠癌手术根治性的主要因素[6]。腹腔镜下手术视野放大,解剖结构易辨认,更容易找准组织间隙进行锐性分离,随着腹腔镜技术的成熟,多数学者认为,只要严格遵循根治原则,腹腔镜手术能达到与开腹手术一致甚至更好的治疗效果[7]。
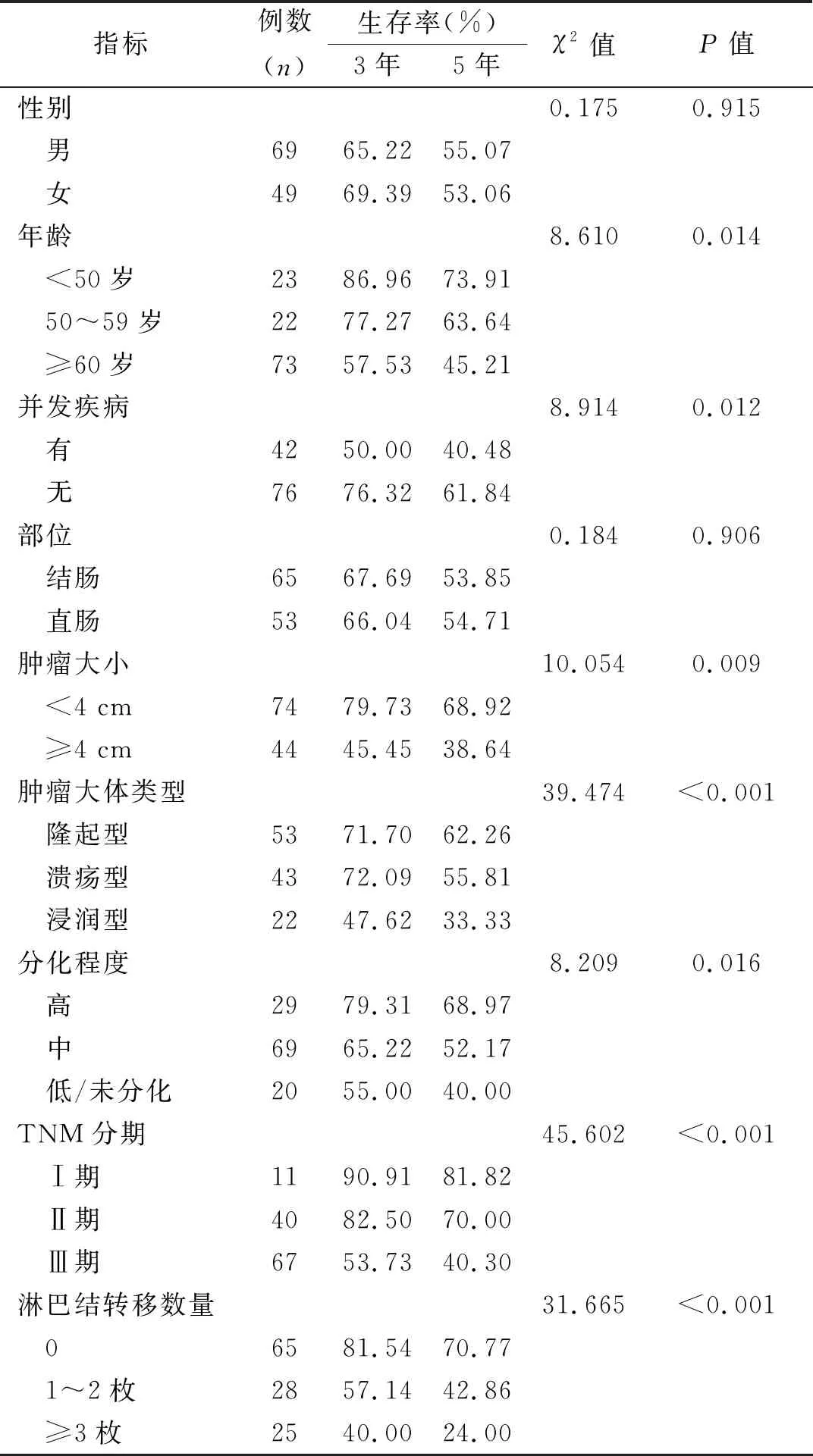
表4 影响结直肠癌患者预后的单因素分析
本研究结果显示,腹腔镜组手术时间长于开腹组,与刘伟等[8]的研究结果一致,这主要因腹腔镜下操作完全依靠腔镜器械,不如开腹手术直观。腹腔镜组术中出血量少于开腹组,腹腔镜下手术视野清晰,通过放大影像,沿直肠周围间隙进行锐性分离时损伤周围大血管的几率降低,利于精细解剖操作,方便准确找到间隙,减少了术中损伤血管,同时术中可借助超声刀分离,增强了止血效果,减少了术中出血量。本研究中腹腔镜组术中出血量、术后引流量少于开腹组,肛门排气时间、留置尿导管时间、总住院时间短于开腹组,表明腹腔镜手术在术后恢复时间方面具有明显优势。相较开腹手术,腹腔镜手术对患者肠道屏障功能的损伤较小,一方面腹腔镜手术视野好,解剖游离相对精细、准确,减少机体损伤,对肠道血液动力学影响小,不易造成屏障损伤;另一方面腹腔镜手术创伤较小,创伤的大小与肠道屏障损伤程度呈正相关,腹腔镜手术较常规开腹手术对肠道屏障的影响小。与此同时,腹腔镜手术后患者康复快,进食更早,足够的肠道内营养供给更能促进患者肠道功能的恢复,帮助改善肠道菌群,更利于肠道屏障的恢复[9-10]。直肠癌根治术后常见并发症主要包括切口感染、吻合口漏、肠梗阻等[11]。临床上关于腹腔镜手术能否降低术后切口感染率存在一定争议。本研究中,腹腔镜手术后切口感染率低于开腹组,这主要与腹腔镜手术切口小、术后康复较快有关;也有研究表明,腹腔镜手术对患者自主免疫系统的影响较小,可有效保护患者免疫功能。本研究对两组患者进行了长期随访,结果表明两组3年、5年累计生存率差异无统计学意义。评价患者远期预后的关键因素是满足无瘤生存原则,本研究不足之处在于未对其无瘤生存情况进行比较,后续可通过前瞻性的多中心随机对照临床试验进行进一步研究。
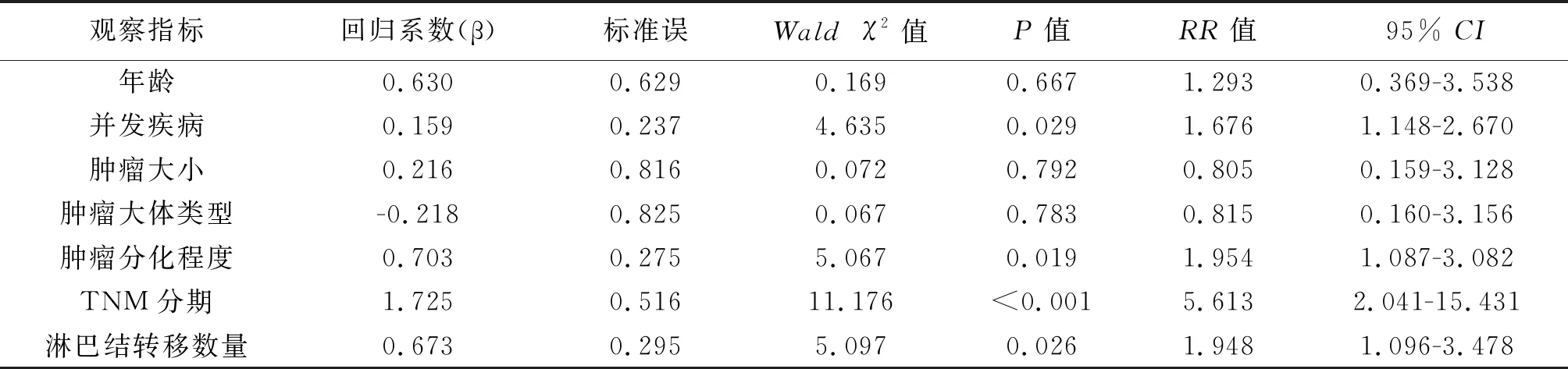
表5 影响结直肠癌患者预后的COX模型多因素分析
本研究通过COX比例风险模型回归分析影响结直肠癌患者预后的因素,结果显示年龄不是结直肠癌预后的影响因素,这可能是由于本研究纳入病例年龄多集中在50岁以上,年轻病例较少,年轻人往往对疾病症状的严重性不加以重视,行结直肠镜检查的患者较少,确诊时晚期病例较多。并发疾病情况是影响结直肠癌患者预后的危险因素,并发其他疾病患者身体较差,免疫功能较低,预后较差。既往研究表明[12],高分化的肿瘤生存期较长,而低分化的肿瘤预后较差,本研究结果与其一致,不同肿瘤分化程度的患者预后存在差异。Croft等[13]的研究结果表明,肿瘤分期是影响结直肠癌预后生存的重要因素之一,本研究结果也表明TNM分期是影响结直肠癌患者预后的独立指标,TNM分期早,患者预后较好,分期晚,则预后较差。有学者认为[14],肿瘤大小也是结肠癌预后的影响因素。本研究单因素分析显示肿瘤大小有意义,但多因素分析未发现其与预后有关,这可能因肿瘤大小与分期相关,在多因素变量校正时修正了其影响。本研究中淋巴结转移数量是影响结直肠癌患者预后的危险因素,是否发生转移患者的生存预后状况不同,Kimura等[15]的研究结果支持本结论。因此要提高结直肠癌患者术后3年、5年生存率,需加强区域淋巴结的处理。
综上所述,腹腔镜结直肠癌根治术创伤小,相较传统开腹手术,患者术后胃肠功能恢复较快,可有效缩短住院时间,减少术后并发症,术后生存率与开腹手术无明显差异。采用COX比例风险模型进行多因素分析,结果显示并发疾病、TNM分期、肿瘤分化程度、淋巴结转移均可影响结直肠癌患者的预后。

