流式细胞术检测精液细胞异质性与精子质量的相关性研究
王家雄,刘彩钊,韩慕天,邢时雨,沈丽燕,马勇,李红,杨慎敏
(南京医科大学附属苏州医院生殖与遗传中心,苏州 215002)
男性不育一直困扰着许多育龄家庭,临床上对男性生育力的检测指标多种多样,但诸多指标仍然存在不确定性[1]。目前临床上最常见的评价精液质量的参数是精子浓度分析、精子活动力分析与精子形态分析等。进行精子浓度与活动力分析时,无论是采用计算机辅助精液分析系统(CASA)还是人工计数,都无法看到一份精液中精子的全貌;同理,精子形态观察时亦只能取部分视野观察几百条精子,虽然可以有效体现精子特异性畸形,但也难以概括精子的全貌。流式细胞术由于其高通量和重复性好的优势,可以在短时间内分析成千上万个细胞,配合特异抗体时还可以捕获每个细胞的多方面特征,因此流式细胞术在精液质量分析中的应用越来越广泛[2];且流式细胞术可以在单一细胞水平进行分析,可以克服目前大多数技术仅提供整体精液平均值的弊端,但是流式细胞术的检测价格不菲[3],增大了医疗成本。
目前,流式细胞术在男科临床检验中主要用于检测精子DNA碎片[4]、顶体反应[5]、线粒体状态[6]、凋亡标志物[7]、活性氧[8]等。精液内不仅有精子,还有不成熟的生精细胞、各类圆细胞以及细胞碎片等,它们与精子的大小存在明显差异。受到临床血液学检测中红细胞分布宽度(RDW)用于贫血鉴别诊断[9]的启发,这个思路是否可以用于精子质量的判断?即精液内细胞直径大小异质性越大,精子质量越差。本研究采用流式细胞术分析患者精液内细胞大小的异质性与精子浓度、活动力、形态及DNA碎片等质量参数之间的关系,试图引入一个新的、简便高效的精子质量参数指标,并探究其作为一个检验参数,对精子质量是否存在一定的预测价值。
资料与方法
一、研究对象
收集2019年3~4月在本中心行精液检查的男性不育患者的241例精液样本。精液采集方式为:要求患者禁欲2~7 d,手淫方式取精。纳入标准:患者染色体正常,无遗传性疾病家族史,近期无泌尿生殖系统感染史,无慢性代谢性疾病。排除精液体积过小(<1 ml)、精液pH异常、精子凝集异常、精液中出现大量圆细胞的样本。
二、研究方法
1.精液常规分析:精液取出后置于37℃温箱进行保存,待精液完全液化后,采用CASA系统(上海北昂医药科技)进行精液常规分析,记录精子浓度、活动精子百分率、前向运动精子百分率等。
2.精子形态分析:按照《世界卫生组织人类精液检查与处理实验室手册》第5版(WHO手册第5版)标准进行精子湿片制备,采用改良巴氏染色液(南京欣迪生物)进行精子涂片染色后,使用1 000倍光学显微镜对精子涂片进行观察,并两两比对,记录精子头部异常、中段异常、主段异常和正常形态精子百分率。
3.精子DNA碎片检测:采用精子染色质结构分析实验(sperm chromatin structure assay,SCSA)检测精子DNA完整性。先使用染色试剂盒(浙江星博生物)对精子进行吖啶橙染色,荧光信号通过Navios流式细胞仪(Beckman Coulter,美国)进行分析;流式分析的结果通过DFI Viewer软件进行处理,最终得出DNA碎片指数(DNA fragment index,DFI)和高DNA着色性(high DNA stainability,HDS)数据。
4.流式细胞检测精液内细胞大小异质性:采用Navios流式细胞仪检测精子DNA碎片的同时,记录前向散射光(forward scatter,FSC)通道反应的精液中细胞大小的整体变异系数(Coefficient of variation,CV)。在流式细胞检测中CV值表示的是检测数据的分布情况,分布的越散,CV越大;数值越集中,CV越小。在流式图形中峰看起来越宽,相对应的CV值也比较大,说明检测的细胞大小差异大;反之,CV就很小。并通过流式细胞仪FSC通道的正态分布图设门B、C、D区,分别对应大细胞区(大头精子、膨胀凋亡精子、红细胞、白细胞、巨噬细胞、生精细胞)、普通细胞区(形态正常精子)与小细胞区(圆形精子等形态异常精子、细胞碎片),记录C区内部CV值。
5.CV值预测精子质量评价:参考WHO手册第5版活动精子百分率(40%)、前向运动精子百分率(32%)以及正常形态精子百分率(4%)的正常参考值绘制受试者工作特征曲线(ROC曲线),用整体CV值评价活动精子百分率、前向运动精子百分率以及正常形态精子百分率这3个参数是否正常,进而评估整体CV值预测精子质量的可靠性。
三、统计学分析
结 果
一、一般资料
所纳入患者年龄24~55岁,平均年龄(31.9±5.0)岁。纳入样本的精液参数情况见表1。如图1所示,FSC通道图上从左到右是细胞大小递增,图像越是呈正态分布(图1A),精液中杂细胞越少,精子大小越趋于一致且正常(图1C);反之流式图像越不规则(图1B),光镜下精子畸形越严重,且出现不成熟的生精细胞以及细胞碎片(图1D)。

表1 精液质量参数与精液细胞异质性参数(-±s)
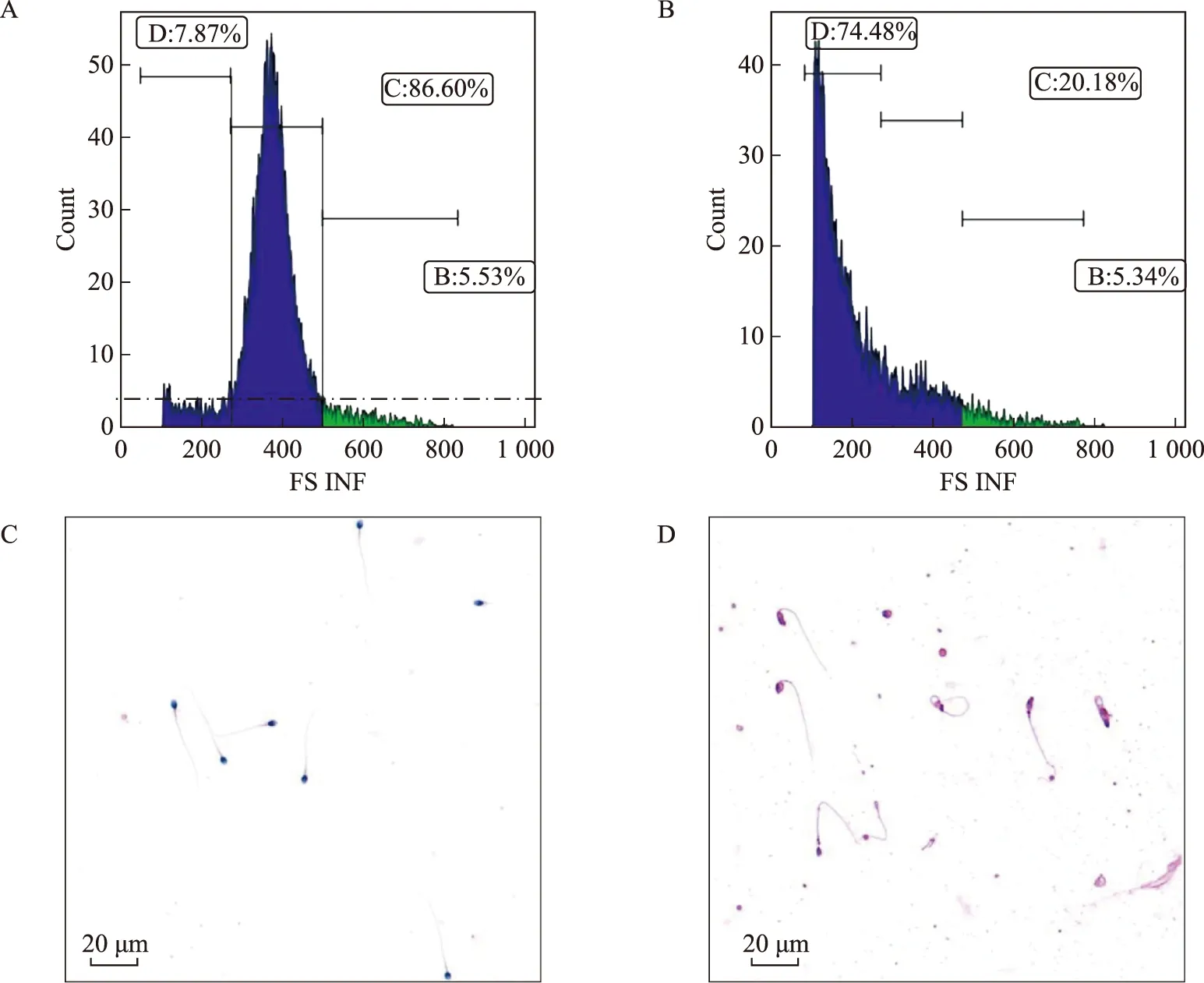
A:正态分布的流式图,按细胞大小分B、C、D三区;B:异常分布的流式图;C:正态分布的流式图对应的精子形态正常、大小均一;D:异常分布的流式图对应的精子畸形多、精液内细胞碎片多图1 精液细胞大小异质性与对应精子形态图片
二、精子大小异质性参数与精液质量相关性
相关性分析发现,精液内所有细胞分布的异质性(总CV值)以及多数精子分布的异质性(C区CV值)与精子浓度、活动精子百分率、前向运动精子百分率、正常形态精子百分率均呈显著负相关(P<0.01),而与DFI、HDS呈显著正相关(P<0.01)(表2),提示精液内细胞以及精子大小均一性越好,精子质量越好。
B区细胞所占百分率与精子浓度、头部畸形精子百分率和DFI呈显著正相关(P<0.01),与正常形态精子百分率呈显著负相关(P<0.05)(表2);B区为小细胞区,精子如果多数处于该区,即提示精子头部异常变多,从而影响精子质量。
C区细胞所占百分率与精子浓度、活动精子百分率、前向运动精子百分率、正常形态精子百分率均呈显著正相关(P<0.01),而与DFI、HDS呈显著负相关(P<0.01)(表2),提示精子大小越是集中在均值左右,精子质量越好。
D区细胞所占百分率与DFI、HDS呈显著正相关(P<0.01),与精子浓度、活动精子百分率、前向运动精子百分率、正常形态精子百分率呈显著负相关(P<0.01)(表2);D区为大细胞区,细胞如果多数集中在该区,即精液中大细胞多,提示可能存在精子头部膨胀、凋亡,圆细胞数量增多等情况,精子浓度、降低精子质量降低。

表2 精液细胞大小异质性参数与精液质量相关性
三、精子大小异质性参数作为衡量精液质量指标的可行性
参考WHO手册第5版中活动精子百分率(40%)、前向运动精子百分率(32%)以及正常形态精子百分率(4%)的正常参考值,采用整体CV值判断这3个参数的ROC曲线如图2。3个ROC曲线的曲线下面积分别为0.723、0.713、0.607,表明整体CV值对这3个参数有一定的预测价值,预测效果适中。
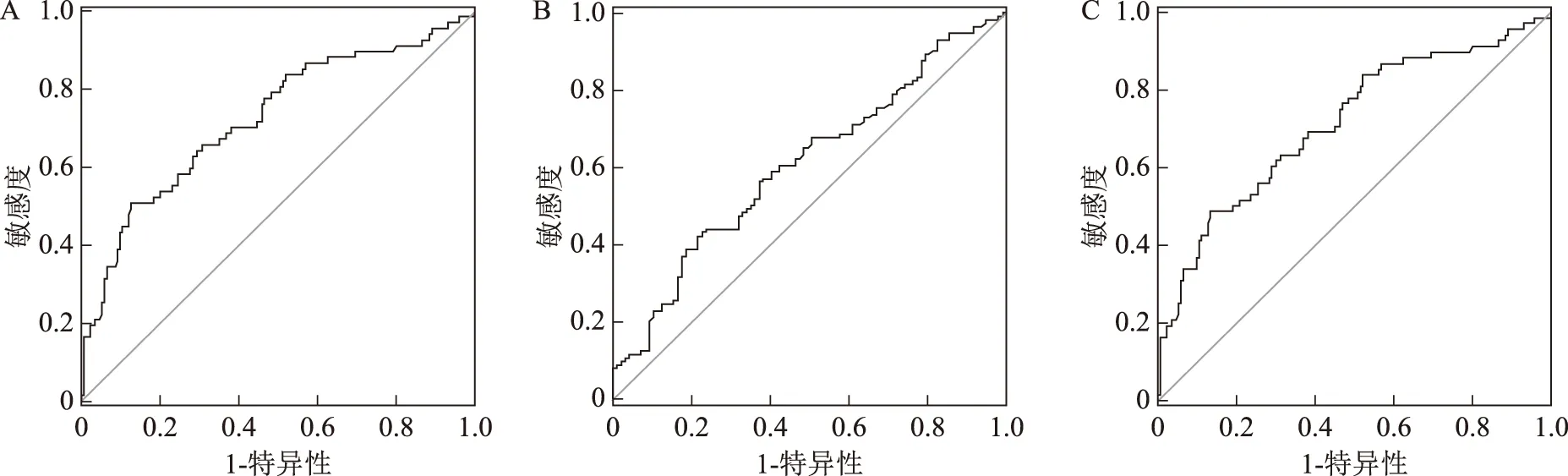
A:活动精子百分率;B:前向运动精子百分率;C:正常形态精子百分率图2 整体CV值评价活动精子百分率、前向运动精子百分率和正常形态精子百分率的ROC曲线
讨 论
精子质量评估是目前临床评价男性生育力最直观的手段,常用的指标有精子浓度、精子活动力、精子形态及精子DNA碎片。近年来,评估精子质量的指标层出不穷,然而由于受孕过程的多因素性,没有一个单一的指标可以完全预测男性生育力[10]。精子浓度、精子活力等指标,虽然提供了有价值的定量数据,但不能提供精子具体功能等信息,如精子穿透透明带的能力等[11]。精子形态分析虽然多年来一直被沿用,也有一定的指导价值,但是许多精子畸形并不是病理性的,而是生理性的,因此除了针对某些特定的精子缺陷,尤其是遗传病因导致的精子畸形(圆头精子、大头多尾畸形、无头精子和精子鞭毛多发性形态异常等)外,精子形态学评估对男性不育症诊断的敏感性和特异性都较差[12]。而且上述方法都存在低通量、低效率以及容易受主观影响的缺点。随着流式细胞术的发展,精子DNA碎片检测逐渐普遍。检测精子DNA碎片的方法有许多种,临床最常用的是精子染色体扩散实验(sperm chromatin dispersion,SCD)[13]和SCSA法[14],其中SCSA由于其高通量、高准确性而被广泛使用。本课题组的前期研究也证明了精子DNA碎片对精子质量均有较好的预测价值[15]。虽然国内外关于精子DNA完整性用于预测男性精子受精能力的研究越来越多,但其临床效用尚待确定[16],有待于完善实验设计的前瞻性研究加以探讨。
临床上采用SCSA检测DFI是通过吖啶橙染色,借助流式细胞仪检测荧光信号后计算结果。流式细胞仪可以同时给出很多信号,特定的荧光信号只是其中之一。FSC信号可以反映细胞的相对大小,但是想要直接测量细胞体积大小是不可靠的。有研究者曾试图通过数学算法将FSC信号用于分析精子形态学变化,但是将这些数据外推到真正的精子形态学上是比较困难的[17]。尽管我们无法给出每一个精子精确的大小数据,但是通过FSC通道的图像仍然可以看出精子大小分布的情况,从本研究结果看,整体CV值越小,精子大小分布越趋近,分布宽度越小,精子质量越好;反之,精子大小均一性越差,精子质量越低。流式细胞仪检测的精子大小主要为精子头部大小,巴氏染色的正常精子头部长度中位数一般为4.1 μm,宽度中位数一般为2.8 μm[18],头部过大或过小提示精子可能伴随着各种类型的畸形。有研究发现当一份精液中存在高百分比的小头精子时,患者辅助生殖的受精率降低且胚胎结局差[19]。部分小头精子还可能提示患者存在某种遗传缺陷,有研究发现1例患者精液中多为小头精子,测序发现其存在无名指蛋白220(ring finger protein 220,RNF220)编码基因的致病突变[20]。精子头部大提示可能存在精子减数分裂异常和染色质浓缩障碍,进而影响精子质量和受精能力。Guthauser等[21]通过测量精子大小与染色质浓缩程度,发现测量的所有精子染色质的平均解聚率为46%,而大头形式则达到了64%。与小头精子类似,部分大头精子病例也提示存在遗传缺陷,极光激酶C(aurora kinase C,AURKC)编码基因缺陷已经成为大头精子致病畸形基因筛选的重要位点[22]。流式细胞仪检测到精子偏大可能是由于大头缺陷,也有可能提示有过量胞浆残留,过量的胞浆残留对精子质量有着严重损害[23]。精子大小的异质性对于生育力的预测一直是大家关注的问题,早在上个世纪就有研究者对精子大小分布与生育力的相关性进行了研究,Aziz等[24]比较了生育组与未生育组之间的精子头大小分布,发现其存在显著差异:与未生育组相比,生育组的精子头面积和长轴均一性更高。Mossman等[25]对从500名男子中随机选择103名男子提供的精液进行研究,发现不仅是精子头部的长度,甚至其长度变化的均一性也对精子质量有预测作用。这些结论都与本研究结果相似,但是与以往研究采用光学显微镜观测相比,本研究采用流式细胞术检测的通量更高,更简便。
综上所述,采用流式细胞术检测精子大小异质性,继而反映精子质量是一种相对简便可行的方法。但本研究仍存在一些不足,由于特异性荧光抗体的缺乏,本研究检测的其实是精液中所有细胞的大小分布,并没有完全针对精子,虽然我们在筛选入组病例时排除了镜下杂细胞多的患者,而且红细胞、粒细胞、淋巴细胞等圆细胞体积均远大于精子,但目前的结果仍不是最精准的。近年来有部分研究探索了在流式细胞检测中采用精子特异性抗体,但都没有广泛使用[2],后续研究需要采用更好的抗体标记与更好的精子分离手段加以完善。

