氮磷肥料的添加对盐碱旱田有机碳矿化和激发效应的影响
汤 洁, 陈静书, 李昭阳, 王静静, 杨 平
(吉林大学新能源与环境学院, 长春130021)

有研究发现,在农田生态系统中,施肥会影响SOC的矿化速率,影响有机质结构的稳定性,进而影响有机质的降解和积累[7]。在农业生产中,依赖大量的无机氮肥投入来维持作物产量[8],磷肥的用量虽少,但必不可缺,也不能过量[9]。氮和磷是植物生长所需的基本元素,施加氮肥和磷肥能够改变植物多样性以及群落组成[10],提高微生物活性,促进碳循环过程[11],增加SOC积累。当前关于添加氮、磷对SOC矿化的影响研究仍有争议。有研究表明,氮添加会抑制原有SOC的分解[12]。而有些研究表明,氮添加会促进SOC分解或对SOC分解没有影响[13-14]。有研究发现,磷对微生物活动有直接影响,添加磷使得微生物群落规模增加[15],从而促进SOC矿化。而有研究发现,在低生产力森林土壤中,磷对微生物呼吸有抑制作用[16-17]。尽管氮、磷的利用可能是有机碳矿化的重要机制,但这种可能性仍然需要广泛实验研究[1]。
激发效应是加入外源物后SOC周转的强烈变化,加入外源物可能促进SOC的矿化,也可能抑制SOC的矿化[18]。这一现象是土壤元素、土壤理化性质与外源物质交互作用的结果。激发效应理论认为,在贫瘠的土壤中,添加外源物会增加天然有机碳的分解,从而为微生物提供所需的额外营养物质[19]。氮肥和磷肥是农田土壤中较为常见的外源添加物,SOC激发效应对不同氮、磷添加物的响应不同。基于此,通过实验室模拟实验,研究氮、磷添加对盐碱旱田SOC矿化和激发效应的影响,对揭示SOC矿化机制和了解碳循环过程有重要意义。
1 材料与方法
1.1 研究区概况
于2018年5月进行现场采集,研究区位于吉林省西部,采样点地理坐标如表1所示。吉林西部属于温带大陆性季风气候,夏季湿热多雨,冬季寒冷降雪少、冰冻期长,年平均气温为6.5 ℃,年平均降水量约为400 mm,年蒸发量远高于降水量,平均相对湿度约为60%[20],日照总时数为2 366.8~2 617.7 h。

表1 采样点位置及土壤基础性质Table 1 Sampling point location and basic properties
1989年和2018年的吉林西部土地利用变化如图1所示。研究区在历史上曾是丰美的大草原,游牧民族广泛居住在此。近30年来,在自然和人为因素的双重驱动下,土地利用类型发生了巨大变化,土地景观破碎[21],草地退化,耕地面积增加,土壤盐碱化严重,盐碱草地逐渐演变为盐碱旱田。研究区旱田以种植玉米为主,为满足粮食增产的需求,氮肥和磷肥的施用大大增加,SOC矿化作用增强,土壤环境进一步恶化。

图1 吉林西部1989年与2018年土地利用变化Fig.1 Land use change in Western Jilin from 1989 and 2018
1.2 土壤样品预处理
采集0~15 cm表层土壤,去除肉眼可见的动植物残体、混匀,一部分于4 ℃冷藏保存用于培养试验,另一部分在室温下自然风干,研磨过筛(2、0.15 mm),用于测量土壤理化性质。
1.3 培养实验设计
使用碱液吸收法测定SOC矿化产生的CO2含量[22]。称取定量的风干土样,调节含水量至40%,均匀铺于500 mL广口瓶底部。随后进行外6组添加处理,分别为200 mgN/kg干土的(NH4)2SO4(N1)、1 000 mgN/kg干土的(NH4)2SO4(N2)、200 mgN/kg干土的KNO3(N3)、200 mgP/kg干土的KH2PO4(P1)、1 000 mgP/kg干土的KH2PO4(P2)以及空白对照(CK)。其中,当地净氮输入量分别为200 mg/kg,与低浓度添加设置对应。将添加物用少量水溶解后,均匀加入广口瓶中,调节含水量至45%。再将盛有10 mL 0.1 mol/L NaOH溶液吸收瓶悬置于广口瓶中,密封广口瓶,于25 ℃恒温箱内培养。在试验开始后的第1、2、4、9、18、32 d时更换吸收瓶,吸收瓶中加入1 mol/L BaCl2溶液2 mL,加1滴酚酞指示剂,用标准酸(约0.05 mol/L HCl)滴定至褪色,测得NaOH吸收的CO2含量,同时用称量法进行土壤含水量的调整。将培养分为3个阶段,分别为培养前期(0~9 d)、培养中期(9~18 d)和培养后期(18~32 d)。在培养后期,CO2释放量大量增加,可适当调节吸收瓶中NaOH溶液浓度,避免CO2吸收不完全。
1.4 土壤盐碱程度的测定
选用电位法测量酸碱度(potential of hydrogen,pH)和电导率(electroconductibility,EC),EDTA-乙酸铵盐交换法测量阳离子交换量(cation exchange capacity,CEC),火焰光度法测量可交换性钠离子浓度(Na+),并通过式(1)计算碱化度(exchangeable sodium percentage,ESP):

(1)
1.5 SOC矿化指标的计算
1.5.1 SOC矿化量
CK组和添加组SOC矿化量计算公式为
MC=(V0-V)CHCl22m
(2)
式(2)中:MC为CK组SOC矿化量,mg/kg;CHCl为盐酸浓度,mol/L;V0为空白滴定值,mL;V为消耗盐酸的体积,mL;22为1/2MCO2,MCO2为CO2的物质的量;m是实际培养土样质量换算值。
Ma=(CNaOHV′-CHClV)22m
(3)
式(3)中:Ma为添加组SOC矿化量,mg/kg;V′为小烧杯NaOH体积,mL。
1.5.2 SOC矿化速率
SOC矿化速率计算公式为

(4)
式(4)中:Mr为矿化速率,mg/(kg·d);Md为培养期间有机碳矿化量,mg/kg;D为培养天数,d。
1.5.3 激发效应
激发效应计算公式为[23]
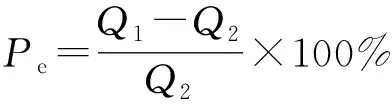
(5)
式(5)中:Pe为激发效应,%;Q1为来自加入外源物后SOC矿化释放的CO2量,mg/kg;Q2为空白的SOC矿化释放的CO2量,mg/kg。
2 结果与分析
2.1 土壤理化性质
H1、H2和H3表示研究区3个样地,土壤基础理化性质如表1所示。作为评价盐碱程度的重要指标,pH、EC和ESP在3个样地的大小分布均为H3>H1>H2。土壤总碳和总有机碳含量与盐碱程度成反比,其大小分布均为H2>H1>H3。H1、H2、H3样地土壤含水率分别为10.4%、15.7%、13.6%,土地开发年限分别为16、36、11 a。有研究认为,土壤盐碱程度随着开发年限的增加而减弱[24-25],这与本研究实验结果相同,3样地盐碱程度与开发年限呈反比。由此可见,研究选择样地土壤的理化性质完全不同。
2.2 表面形态结构分析
使用激光共聚焦扫描电镜,对土样进行扫描,土壤表面形态如图2所示,分别为H1、H2、H3样地土壤颗粒放大至40 μm时的形态。从整体来看,研究区土壤颗粒形状不规则,大小不一;从局部来看,H1、H2样地土壤颗粒较大,土壤结构呈块状,土壤颗粒表面粗糙,有细块状、薄片状颗粒物附着,附着物大多表现出一定的聚集;H3样地土壤颗粒较小,表面比较光滑,附着细小的层状或片状颗粒物较多。

图2 供试样地土壤的扫描电子显微镜图Fig.2 Scanning electron micrograph of soil samples
2.3 不同处理对SOC矿化量的影响
不同处理的SOC矿化累积随培养时间的变化规律如图3所示,添加氮、磷使得SOC矿化累积显著增加。随着培养时间延长,SOC矿化量逐渐增加。在培养前期,各样地不同添加处理的SOC矿化没有明显差距。在培养中期,SOC矿化累积迅速增加。在培养后期,CK组SOC矿化累积达598.7、373.5、538.33 mg/kg,添加氮、磷使得矿化累积增加了211.0%~876.5%,H1、H2样地N2组矿化累积略微降低,不同处理H1的矿化累积的大小为P2>N3>N2>P1>N1>NP>CK,H2为N3>P2>N2>P1>N1>NP>CK,H3为N2>P2>N3>NP>P1>N1>CK,N2、P2和N3组表现出明显优势。

图3 培养期间不同处理组SOC矿化累积Fig.3 Changes of SOC mineralization in different groups during incubation
2.4 不同处理对SOC矿化速率的影响
培养期间不同处理SOC矿化速率变化规律如图4所示。添加氮、磷强烈刺激了SOC的矿化速率,培养0~1 d,CK组的矿化速率为164.8、60.4、112.6 mg/(kg·d),添加组矿化速率增加了146.7%~786.3%。SOC矿化速率在培养前期迅速下降,P1组的矿化速率和斜率最大[图4(e)],但P2组在第2天略微升高[图4(f)],N2组随培养时间延长速率曲线略微波动[图4(c)]。随着培养时间延长,各组SOC矿化速率逐渐下降趋于平缓,培养结束后,CK组的矿化速率降至42.8、26.7、38.4 mg/(kg·d),各样地矿化速率仍增加了211.0%~770.5%。
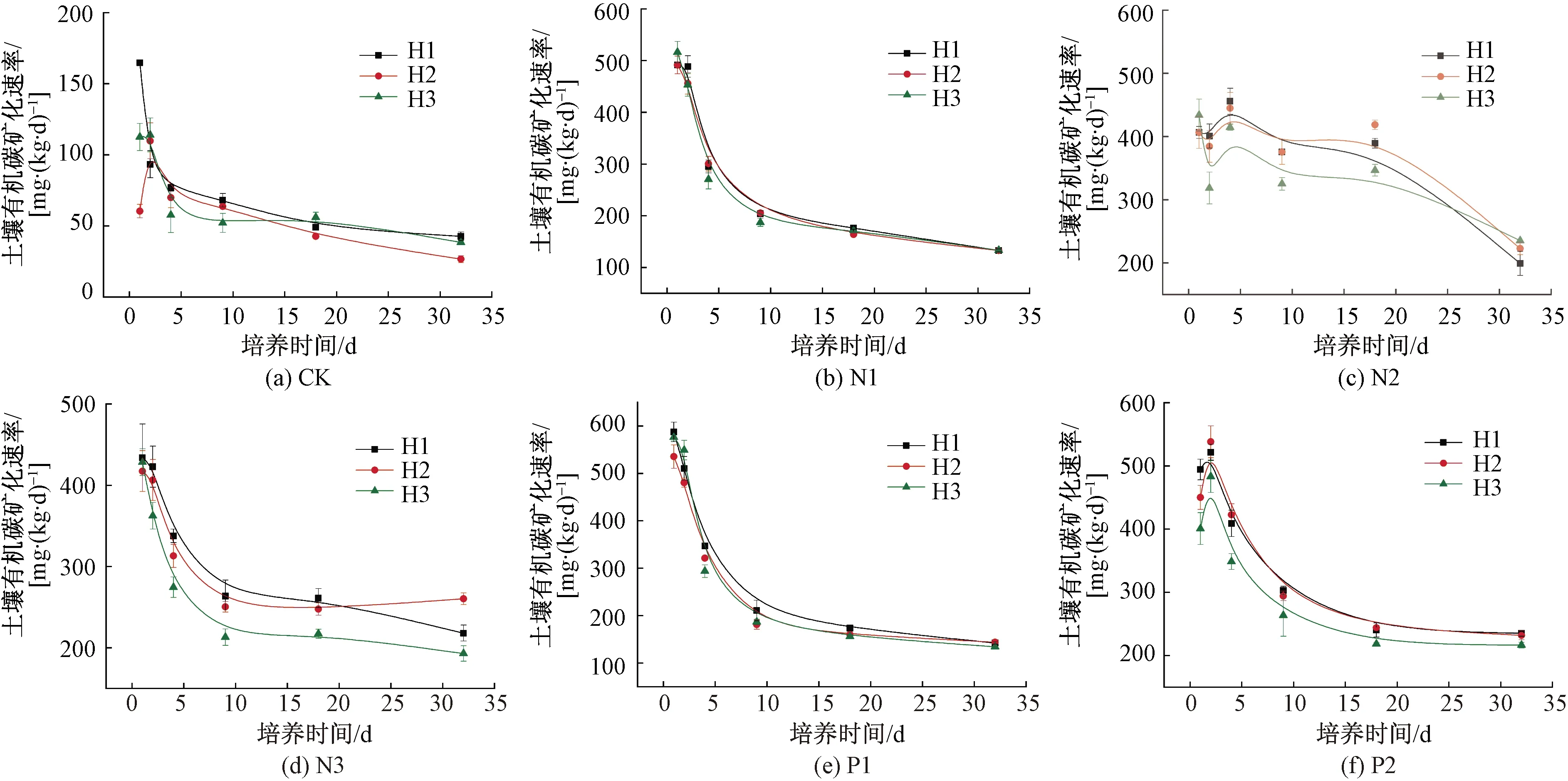
图4 培养期间不同处理组SOC矿化速率Fig.4 Changes of SOC mineralization rate in different groups during incubation
2.5 不同处理对激发效应的影响
通过定量化SOC矿化速率的大小和方向,得到激发效应的变化规律如图5所示。在培养期间,各样地不同添加的激发效应均产生了正激发效应。与培养前期相比,N1、P1组激发效应在培养后期略微减弱[图5(a),图5(d)],其他组略微升高无明显趋势。培养结束后,各处理组激发效应大小均为:H2>H3>H1。在培养期间内,各样地激发效应大小均为,N2组最大。说明添加N2对SOC矿化的激发效应响应更明显。

图5 培养期间不同处理组激发效应的变化Fig.5 Changes of priming effect of different treatments during incubation
各样地在不同添加下的激发效应变化规律相似,H1样地在培养的0~4 d迅速上升后趋于平缓;H2样地在培养的0~4 d迅速下降,随着培养时间延长,激发效应逐渐增加;H3样地在0~1 d略微下降,随培养时间延长逐渐上升趋于平缓。
2.6 盐碱程度对SOC矿化和激发效应的影响
通过相关性分析,研究原生土壤盐碱程度对SOC矿化作用和激发效应的影响,培养期间不同处理组SOC矿化作用与盐碱程度的显著相关性结果如表2所示,激发效应与盐碱程度的显著相关性结果如表3所示。
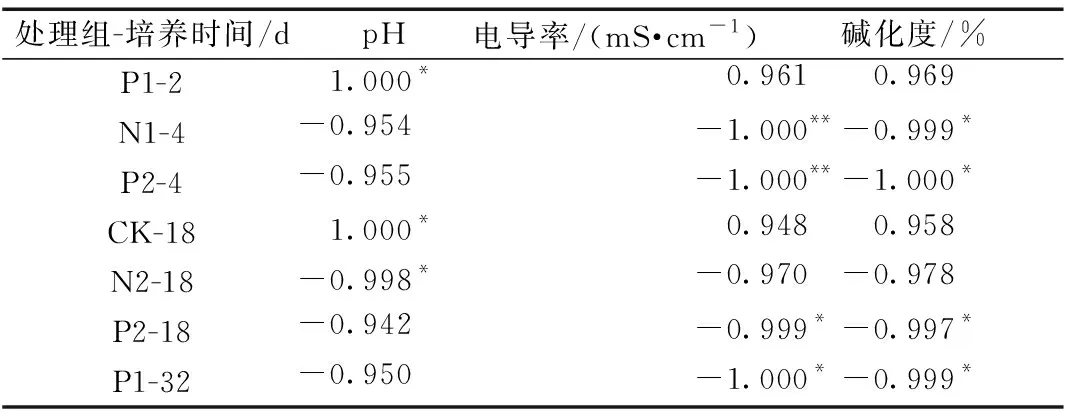
表2 各处理组SOC矿化与盐碱程度的显著相关性结果Table 2 The significance correlation between the SOC mineralization and soil salinization in different treatment groups

表3 各处理组激发效应与盐碱程度的显著相关性结果Table 3 The significance correlation between priming effect and soil salinization in different treatment groups
培养2~4 d,N1、P2组SOC矿化作用与EC、ESP显著负相关(P<0.05、P<0.01);在培养的9~18 d,N2组SOC矿化作用与pH显著负相关(P<0.05),P2组SOC矿化作用与EC、ESP显著负相关(P<0.05);在培养的18~32 d,P1组SOC矿化作用与ESP显著负相关(P<0.05)。激发效应与土壤盐碱程度的显著相关性结果集中于培养的9~18 d,N2、P2组激发效应与pH呈显著负相关(P<0.05、P<0.01),N3、P1组激发效应与EC、ESP呈显著负相关(P<0.05)。
3 讨论
近年来,随着人口增长,粮食需求大大增加。氮和磷是农作物生长的必要元素,为了提高作物产量,过量施用氮肥、磷肥的现象普遍存在。有研究发现,过量施用氮肥会刺激SOC产生大量矿化,导致SOC损失[26]。在本研究中,添加氮使得SOC矿化累积增加了2~8倍,这是因为氮的可利用性被增强,受氮限制的微生物活性提高,使得SOC矿化累积增加[26]。当前大多数研究认为,土壤缺磷会导致土壤矿化能力显著降低,添加磷有利于SOC矿化[27],这与本研究的结果一致。在本研究中,添加磷使得SOC矿化累积增加了2~7倍,这是由于添加磷使得土壤中磷的含量增加,可溶性有机碳含量提高,SOC矿化累积增加[26, 28]。添加氮比添加磷对SOC矿化累积的刺激更大,这是因为添加氮使得碱性土壤pH降低,改善了土壤环境,促进了有机碳的分解[19];此外,研究区土壤含有大量的碳酸盐(如Na2CO3、CaCO3等),磷添加后容易形成难溶的三钙磷酸盐,导致磷释放缓慢[27],对有机碳矿化的响应减弱。
有研究认为,少量氨态氮的输入会促进SOC矿化累积,而高浓度的氨态氮输入会抑制SOC的矿化累积[29]。在本研究中,高浓度的氮输入并没有抑制SOC矿化作用,虽然N2组矿化累积量略有降低,但这是由于高浓度的氮和硫酸根离子对微生物活性有抑制作用,在一定程度上削减了SOC矿化累积;此外,由于研究区土壤碱化程度高,在培养后期,(NH4)2SO4发生硝化反应,造成氮素损失,SOC>矿化累积略微降低。
在本研究中,各样地SOC矿化速率大体呈先快速降低,后缓慢下降趋于平缓的变化规律。在培养前期,土壤中易分解的组分含量较高,大量营养物质迅速释放,提高了土壤中微生物活性[30],SOC产生正激发效应,矿化速率增加;随着培养时间的延长,微生物开始利用惰性有机碳,CO2排放量减少,矿化速率随之减缓[31];在培养后期,活性有机碳消耗殆尽[32],矿化速率趋于平缓。
有研究表明,贫瘠的土壤更易产生激发效应[19]。当土壤氮、磷含量较高时,SOC矿化的激发效应增大[33-34]。在本研究中添加氮、磷产生了正激发效应,SOC矿化速率显著提高(图4、图5)。原因可能是:一方面,氮、磷作为作物生长的必要元素,添加氮、磷刺激了SOC分解,导致正激发效应明显;另一方面,由于研究区土壤盐碱程度大,有机碳含量低,一些微生物在维持“代谢警觉”的细胞状态方面投入的能量很低,它们对底物的反应比对休眠细胞的反应更快,添加营养物使细菌的更替加快,从而触发了正激发效应[35],SOC矿化速率增强。
水分通过影响微生物活性和微生物与有机质的有效接触,进而影响土壤SOC矿化作用[36]。N2和P2组矿化速率略微波动,这可能是由于土样重新加水后,增加了土壤通气性,细胞破裂,渗透物释放,SOC产生了激发效应,有机碳矿化速率短暂增强[37]。
已有研究证明,盐碱会抑制SOC矿化作用[38]。在本研究中,盐碱程度、SOC矿化作用和激发效应表现出显著负相关(P<0.05)。原因如下:①土壤盐碱程度越强,土壤表面越光滑(图3),土壤表面粗糙程度与吸附能力强弱有一定相关性[39],在一定程度上影响了土壤对氮、磷的吸附;②土壤有机质是土壤团聚化作用的主要影响因子,而研究区土壤盐碱程度大,土壤有机质含量低,土壤结构较差,不利于土壤团聚体的形成,阻碍了氮、磷水溶液与土壤的细小颗粒结合形成团聚体[40-41],SOC矿化作用减弱;③大量研究表明,pH是影响微生物群落结构的重要因子,pH过高或过低都会抑制微生物的活性[42],而EC过高可能对SOC矿化、微生物种群产生负面影响[43]。综上所述,当盐碱程度较高时(pH>8.5,EC>1.81 mS/cm,ESP>20%),会破坏土壤的物理性,土壤结构较差,微生物活性受到抑制,SOC矿化作用减弱。
添加氮、磷会提高盐碱土壤pH,改善土壤环境,增加SOC矿化作用,但大量施用氮肥和磷肥,会加速SOC的分解,导致土壤肥力降低,温室气体过度释放。因此,对于SOC含量较低、盐碱化程度较高的土壤CO2排放问题应被关注。
4 结论
(1)不同氮、磷添加处理,均促进了盐碱旱田SOC矿化累积,且同一添加物浓度越高,矿化累积越大,N2、P2和N3对SOC矿化作用的刺激更大。
(2)在培养前期,添加氮、磷使得盐碱旱田SOC矿化速率大大增加,正激发效应剧烈变化,随着培养时间延长,各样地矿化速率迅速降低后趋于平缓,矿化速率增幅降低,正激发效应趋于平缓。
(3)在不同培养阶段,不同处理组的SOC矿化、激发与盐碱程度显著负相关(P<0.05),pH、EC和ESP越大,SOC矿化作用越小,正激发效应越弱。
(4)添加氮肥和磷肥,改善了盐碱旱田的土壤环境,为作物生长提供了更多的养分,但过度施用氮肥和磷肥,会加速SOC矿化作用,导致SOC储量降低,土壤肥力下降,温室效应加剧。

