黄芪丹参配伍提取物对心肌缺血大鼠的心脏保护作用
张瓅方, 李梦华
(1.南阳理工学院河南省张仲景方药与免疫调节重点实验室, 南阳 473004; 2.南阳医学高等专科学校, 南阳 473061)
心血管疾病尤其是缺血性心脏病,是全球范围内占据疾病死亡率的主要原因[1]。虽然多数患有心肌梗死(myocardial infarction,MI)的病人依靠化学药物和经皮冠状动脉介入治疗(percutaneous coro-nary intervention,PCI)后症状得到改善,但仍有一部分患者因微血管病变、术后再狭窄和弥漫性病变等并发症而无法接受有效治疗。因此,探索新的治疗策略来缓解MI缺血和维持心脏功能显得尤为重要[2]。恢复缺血心肌的血供是治疗MI的关键。随着血管新生概念的发展,越来越多的研究证明治疗性血管生成能有效改善MI血供[3]。血管生成是一个复杂的过程,其中血管内皮生长因子(vascular endothelial growth factor,VEGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)等促血管生成因子能显著促进缺血区侧支血管的增殖,减少梗死面积[4-5]。然而,临床中关于基因治疗的效益仍然存在争议,例如有限的有效期、促进肿瘤生长和其他安全问题等[6-7]。除了生长因子外,干细胞也有助于新血管形成。已经证明,干细胞分泌可溶性旁分泌因子,并能够分化为内皮细胞[8-9]。
MI发病时典型临床表现为心前区不同程度疼痛,这与中医“胸痹”“真心疼”等病症中胸部闷痛,严重时胸痛彻背、背痛彻心的主要症状极其相似。中医治疗此类疾病采用“益气化瘀生新”理论和西医“治疗性促血管新生”概念有着异曲同工之处,课题组前期选用益气活血类代表药黄芪和丹参配伍提取物进行心肌梗死干预治疗,证实了黄芪、丹参配伍提取物的浓度剂量和治疗MI作用呈量效正相关关系[10],在VEGF/KDR信号通路介导下,可上调血管成熟肽类生长因子(angiopoietin I,AngI)和血管内皮特异性组织蛋白(endothelial nitricoxide sythase,eNOS),证实黄芪、丹参配伍提取物调控参与促血管生成因子作用明显[11]。中药配伍是中医药在临床应用相容性的基本表现形式,黄芪和丹参组合是中医治疗心血管疾病的常用药对。现以MI大鼠模型为研究对象,探讨黄芪丹参配伍提取物对缺血性心肌的保护作用及机制。
1 材料与方法
1.1 黄芪和丹参的制备
黄芪和丹参提取物在国家自然科学基金项目“黄芪丹参配伍提取物对心肌梗死后心室重构中PKD-AP-1/C-Jun-MMPs信号传导通路影响的研究(81173372)”基础上,由南阳理工学院方药研究所鉴定并提供蒙古黄芪干燥根经和唇形科植物丹参干燥根经,经水提和大孔吸附树脂纯化法提取黄芪总苷含量66.9%,每克含原生药32.21 g;丹参总酚酸含量63.7%,每克含原生药15.46 g。
1.2 建立MI大鼠模型
实验大鼠购自河南省实验动物中心,SD大鼠 8 周龄雄性,体重(220±20) g[动物生产许可证:SCXK(豫)2015—0005;动物质量合格证:1001297]。实验前,将大鼠置于SPF环境条件下,在(26±1) ℃和55%±10%湿度条件下进行12 h明暗交替饲养1周。所有动物程序和方案均按照《实验动物护理和使用指南》执行,并经南阳理工学院动物护理委员会的伦理准则批准进行(批准号:NYISTEEC—2017026)。参照经典MI造模方法,以4%水合氯醛注射液麻醉大鼠后,通过结扎左前降支建立心肌梗死模型[12]。
1.3 分组及药物管理
实验分批进行,每组8只。第一批大鼠分为 6组,为假手术组(Sham,等量生理盐水)、模型组(Model,等量生理盐水)、培哚普利组[PB,3 mg/(kg·d)]国药准字H20034053,施维雅(天津)制药有限公司)、黄芪提取物组[HQ,50 mg/(kg·d)]、丹参提取物组[50 mg/(kg·d)]和黄芪丹参配伍提取物组[HQ+DS,50 mg/kg·d)],以确定对心功能和MI区域百分比有最佳影响的中药组。采用Notch抑制剂RO4929097(s1575,Selleckchem,UK)探讨Notch1和NICD通路在中药干预的缺血心肌血管生成中的作用。将第二批大鼠分为假手术组、模型组、HQ+DS组和HQ+DS+RO4929097[HQ+DS-I,10 mg/(kg·d)]组,观察中药对CD31和vWF的左室射血分数(left ventricular ejection fractions,LVEF)和平均光密度(average optical densities,AODs)的影响。RO4929097以1%羧甲基纤维素和0.2%Tween80(C8621、T8360,北京索莱宝科技有限公司)配制为混悬液。从模型建立后第 2 d 开始,每天灌胃一次,自由活动和进食持续 21 d。第22天处死大鼠后将血清分离进行酶联免疫吸附试验(ELISA)。在冰台上快速取出心脏分为两部,一部分4%多聚甲醛中室温固定12 h后进行组织病理观察,另一部分保存于-80 ℃冰箱进行Western blot检测。
1.4 超声评价左室射血分数
用小动物超声成像仪(Vevo 3100,VisualSonics,Canda)检测大鼠心脏。4%水合氯醛麻醉后将 MS-250 探针放在大鼠左胸上并指向右侧,以获得左心室的长轴视图。每只大鼠测量3个连续心脏周期取平均值,并计算各组LVEF。
1.5 Masson染色法测定心肌梗死面积百分比
固定在4%多聚甲醛的大鼠心脏取出后在不同浓度的酒精中脱水。将脱水样品嵌入石蜡包埋切片,并用Masson操作说明(G1006,武汉谷歌生物科技有限公司)进行连续染色。染色后的心肌样本用数字切片扫描仪(Panoramic MIDI,3DHISTECH,Hungary)进行扫描。梗死心肌的像素以蓝色为特征,正常心肌的像素以红色为特征,采用ImageJ(Wayne Rasband,National Institutes of health,USA)计算。MI面积百分比计算为蓝色像素/(蓝色+红色像素)×100%。
1.6 免疫荧光法检测CD31和vWF
将上述切片后获得的组织切片依次与CD31(GB12063,武汉谷歌生物科技有限公司)、vWF(GB11020,武汉谷歌生物科技有限公司)和DAPI(G1012,武汉谷歌生物科技有限公司)抗体培养。通过显微镜(DMIL-RF1,Leica,Germany)获得梗死边界区(IBZ)和心肌梗死区(MI)的照片(200×)。利用ImageJ计算CD31和 vWF积分密度和面积。CD31和vWF的平均光密度(AODs)计算为综合密度/面积×100%。
1.7 测量VEGF和bFGF
ELISA法检测VEGF(KE10009,Proteintech,USA)和bFGF(ab100670, Abcam, UK),根据制造商提供操作步骤进行,全自动定量绘图酶标仪(Epo-ch2, Biotek, USA)分析光密度。
1.8 Western blot法检测HIF-1α、FGFR-1、Notch1/NICD、SDF-1、CXCR-4、CT-1
将RIPA蛋白提取试剂与蛋白酶抑制剂混合。用电动均质机将组织匀浆后冰上孵育20 min,14 000g离心5 min,BCA法测定样品的蛋白质浓度,用RIPA缓冲液调节至最低浓度。在95 ℃下 5 min 裂解蛋白质变性,预处理SDS聚丙烯酰胺凝胶,将样品加载到凝胶上,进行电刺激,并转移到PVDF膜上。用5%牛血清白蛋白进行封闭。与原发性抗体抗GAPDH(5174,CST,USA)孵育后,HIF-1α(36169,CST,USA)、FGFR-1(9740,CST,USA)、Notch1(3608,CST,USA)、NICD(4147S,CST)、SDF-1(3740,CST,USA)、CXCR-4(60042-1-1 g, Proteintech, USA)和CT-1(YT0638,ImmunoWay,USA)在4 ℃ 下,用二级抗体(115-035-003, Jackson, USA)室温下培养2 h。用凝胶成像仪(ChemicDoc XRS+, Bio-Rad, USA)对膜进行成像,ImageJ进行分析。
1.9 统计分析
2 结果
2.1 HQ+DS对心脏功能的影响
2.1.1 LVEF比较
左前降支结扎后左心室收缩功能下降,心室壁运动异常。模型组与假手术组相比,LVEF明显降低(P<0.001)。治疗后,与模型组相比,PB组和HQ+DS组的LVEF均显著升高(P<0.05或P<0.01)。模型组与HQ组(P>0.05)和DS组(P>0.05)无显著性差异[图1(b)]。
2.1.2 MI面积比
非接触区心肌细胞染色为红色,Masson染色后梗死区呈蓝色,梗死组织以胶原纤维和炎性细胞为特征。与假手术组相比,模型组和治疗组心肌梗死面积/左心室面积的百分比明显增加。治疗后,与模型组相比,PB组、DS组和HQ+DS组心肌梗死面积/左室面积百分比明显降低(P<0.05或P<0.01)[图1(a)、图1(c)]。
2.1.3 血清中VEGF和bFGF水平
模型组血清bFGF水平显著低于假手术组(P<0.01)。治疗后,PB组、HQ组、DS组和HQ+DS组中bFGF水平均升高,其中HQ+DS组bFGF水平较模型组明显升高(P<0.01)[图1(e)]。各组VEGF水平无显著性差异(P>0.05)[图1(d)]。HQ组、DS组和HQ+DS组的LVEF、心肌梗死面积百分比、VEGF和bFGF水平相比较,HQ+DS组对改善心脏功能的作用明显优于HQ组和DS组。
2.2 HQ+DS对心脏保护机制
2.2.1 抑制Notch信号后LVEF和MI面积测定及组织病理学观察
Notch受体分裂后释放NICD,NICD转运到细胞核并能启动基因转录,当分泌酶活性被RO4929097抑制时,NICD释放受阻。实验中,HQ+DS组LVEF与模型组相比有明显改善,HQ+DS-I组与模型组LVEF无显著差异[图2(c)]。与模型组相比,HQ+DS组和HQ+DS-I组心肌梗死面积百分比降低(P<0.01或P<0.05)[图2(d)]。这一发现表明Notch1/NICD通路可能在HQ+DS介导的心肌梗死后心脏功能保护中起重要作用,尽管它可能不是唯一通路。Masson染色显示假手术组心肌细胞排列整齐,心肌纤维结构清晰,仅有少量炎性细胞出现在HQ+DS组[图2(a)]。模型组梗死区心肌断裂溶解,伴有大量纤维增生紊乱,炎症反应明显,以大量浸润性炎性细胞为特征[图2(b)]。模型组和HQ+DS-I组炎症反应强于HQ+DS组。
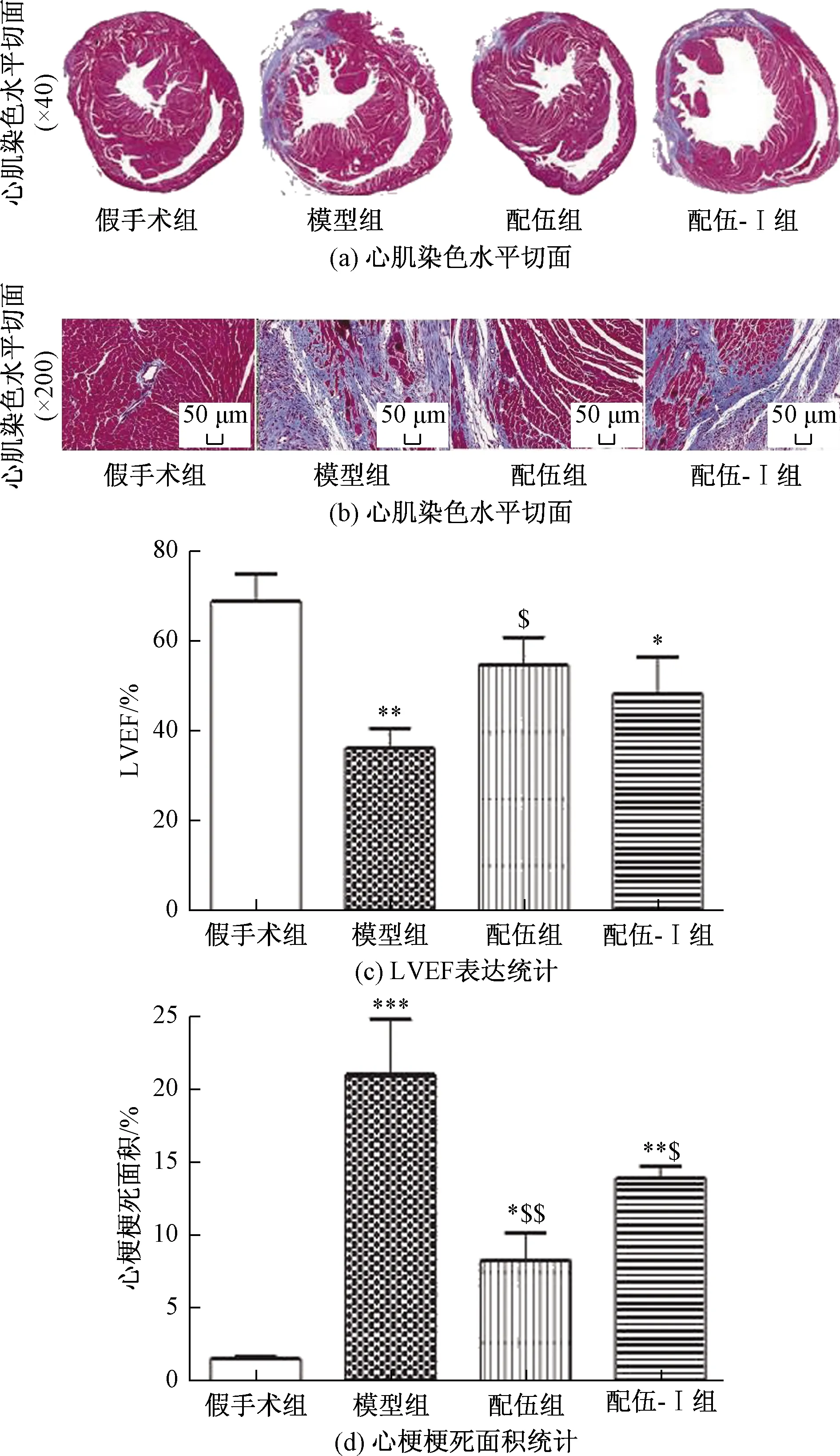
与假手术组相比,*为P<0.05,**为P<0.01,***为P<0.001;与模型组相比,$为P<0.05,$$为P<0.01;n=8图2 Notch1/NICD通路对MI心肌保护作用Fig.2 The protective effect of Notch1/NICD pathway on MI myocardium
2.2.2 IBZ中CD31和vWF的AODs值
CD31和vWF是血管内皮细胞的特异性标记蛋白,经免疫荧光染色后CD31、vWF和DAPI呈现绿色、红色和蓝色。由于血管管腔小或模糊,很难计算血管数目,因此用CD31和vWF的AODs来评价血管生成密度。染色显示新生血管呈绿点,细胞核呈蓝色,染色均匀分布[图3(a)、图3(b)中假手术组]。在模型组中,因梗死导致缺血心肌细胞代偿性肥大或部分溶解,细胞核和血管生成变得不规则或不均匀[图3(a)、图3(b)中模型组]。与假手术组相比,模型组和HQ+DS-I组中CD31的AODs显著降低(P<0.001),而HQ+DS组的CD31的AODs显著增加(P<0.05)[图3(c)]。IBZ中形成的毛细血管网络用于改善缺血心肌的血液供应,与模型组相比,HQ+DS组细胞核密度更高[图3(a)、图3(b)中配伍组]。HQ+DS-I组与HQ+DS组相比,CD31的AODs降低。这一结果表明,Notch通路可能在HQ+DS介导的IBZ血管生成中起到促进作用。

与假手术组相比,*为P<0.05,**为P<0.01;与模型组相比,$为P<0.05;与HQ+DS组相比,&为P<0.05;n=8图3 Notch通路在HQ+DS介导的IBZ血管生成中作用Fig.3 The role of Notch pathway in HQ+DS-mediated IBZ angiogenesis
2.2.3 MI中CD31和vWF的AODs值
MI区坏死组织不能完全溶解吸收,肉芽组织由新的毛细血管和成纤维细胞组成。MI区的病理过程与IBZ区不同,模型组CD31和vWF的AODs均显著高于假手术组(P<0.05或P<0.001)。模型组的细胞核比假手术组更致密,因为肉芽形成特点是血管生成、成纤维细胞增殖和炎症细胞浸润[图4(a)、图4(b)中模型组]。HQ+DS组和HQ+DS-I组与模型组相比,CD31和vWF的AODs降低(P<0.001)[图4(c)]。

与假手术组相比,*为P<0.05,***为P<0.001;与模型组相比,$$$为P<0.001;n=8图4 MI中CD31和vWF的AODs值Fig.4 AODs values of CD31 and vWF in MI
2.2.4 血清中VEGF和bFGF水平
与假手术组相比,模型组bFGF水平明显降低(P<0.001)。与模型组相比,HQ+DS组和HQ+DS-I组的bFGF水平显著升高(P<0.001)[图5(b)]。各组VEGF水平无显著差异(P>0.05)[图5(a)]。

与假手术组相比,***为P<0.001;与模型组相比,$$$为P<0.001;n=8图5 各组血清中VEGF和bFGF水平Fig.5 Serum levels of vascular endothelial growth factor and bFGF in each group
2.2.5 HIF-1α、FGFR-1、SDF-1、CXCR-4和CT-1的表达
血管生成涉及一系列生物学过程,干细胞动员也参与血管生成,因此实验中检测HIF-1α和FGFR-1的表达,此外还测定了SDF-1、CXCR-4和CT-1,以研究HQ+DS对干细胞动员的影响。模型组和HQ+DS组的HIF-1α表达明显高于假手术组(P<0.001或P<0.01)。HQ+DS组HIF-1α表达下降(P<0.05),而FGFR-1表达增加[图6(a)]。在任何一组中,参与干细胞动员的CXCR-4表达没有差异(P>0.05)。与假手术相比,模型组和HQ+DS组SDF-1和CT-1表达显著增加(P<0.001或P<0.01)。HQ+DS组与模型组相比,SDF-1和CT-1表达显著增加(P<0.01)[图6(b)]。
2.2.6 Notch1和NICD的表达
Notch家族参与血管生成和干细胞分化。在本次实验中,RO4929097被用来探讨Notch/NICD通路在HQ+DS对血管生成的影响作用。HQ+DS组与模型组比较,增加了Notch1和NICD的表达(P<0.05)。经过HQ+DS-I干预后,与HQ+DS组相比,Notch1和NICD表达降低(P<0.01或P<0.001)[图6(c)]。

与假手术组相比,*为P<0.05,**为P<0.001,***为P<0.001;与模型组相比,$为P<0.05,$$为P<0.01;与HQ+DS组相比,&&为P<0.01;n=8图6 Western blot检测血管生成相关因子和干细胞动员蛋白的表达Fig.6 Western blot was used to detect the expression of angiogenesis-related factors and stem cell mobilization proteins
3 讨论
黄芪和丹参是中医益气活血类的常用药对组合,多应用于气虚血瘀证的治疗,尤其是在缺血性疾病应用中效过显著,但黄芪丹参配伍使用对心脏的保护机制尚不明确。实验结果表明,黄芪丹参配伍能显著改善MI大鼠的LVEF,降低心肌梗死面积,效果优于使用单味黄芪或丹参。黄芪丹参配伍增加了IBZ中CD31的AODs,证明黄芪丹参配伍对心脏的保护作用可能与促进血管生成有关。因缺血而诱导血管生成的关键问题是新生毛细血管能否有效增加血液供应,活血化瘀类中药在特定组织中是否具有优先作用,是值得进一步研究的课题。实验结果表明,模型组形成更多肉芽组织,并以新生血管为特征,提示梗塞区新生血管可能只促进肉芽组织成熟,加速梗塞心肌纤维化,导致缺血组织供血减少。血管生成主要由组织缺氧通过HIF-1α激活来刺激[13]。HIF-1α激活许多基因的转录,包括血管内皮生长因VEGF、血管内皮生长因子受体flt-1和bFGF[14-15]。bFGF是一种有效的血管生成因子,可刺激参与血管生成和肉芽组织形成的成纤维细胞和内皮细胞的增殖。HQ+DS组和模型组的HIF-1α和FGFR-1表达均明显高于假手术组,HQ+DS组的HIF-1α表达较模型组下降,HIF-1α的表达受氧浓度的严格影响。低氧条件下,HIF-1α的泛素化和降解受到抑制,由此产生的HIF-1α在细胞质中的积累刺激多种血管生成因子,包括bFGF[16]。HQ+DS组的HIF-1α表达下降,提示HQ+DS对治疗后缺血心肌氧浓度升高。干细胞疗法为缺血性新血管形成提供了很好的治疗潜力,已经证明,SDF-1与CXCR-4结合在一起,有助于动员干细胞并将其招募到缺血组织中[17-18]。SDF-1不仅有助于植入骨间充质干细胞(mesenchymal stem cells,MSCs)的归巢,而且还可以增加缺血时的血管密度并诱导血管生成[19]。CT-1是一种强有力的细胞因子,促进细胞植入,通过促进骨间充质干细胞的持续性和黏附性来维持梗塞心脏的功能[20]。研究还表明,CT-1可促进干细胞的心脏分化[21-22]。研究结果表明,HQ+DS显著增强了SDF-1和CT-1的表达,提示干细胞可能被动员到缺血心肌中,以保护受损组织。然而,HQ+DS调控干细胞促进缺血性心肌细胞的血管生成的机制需要进一步研究。
Notch信号控制血管网的血管生长、内皮细胞增殖和动静脉的分化[23]。哺乳动物细胞中有4个受体(Notch1-4)和5个配体(DII1、DII3、DII4、Jaggedl、Jagged2)。一旦Notch配体与其受体结合,Notch信号就发生,Notch受体从细胞膜释放NICD。NICD转移到细胞核调节基因转录,从而影响细胞的增殖和分化[24]。Notch1/NICD参与缺血组织的血管生成,有利于干细胞向心肌细胞分化[25-27]。在本研究中,HQ+DS上调了Notch和NICD的表达,并在Notch分泌酶被抑制后不再增加NICD的水平,提示Notch1/NICD信号可能在HQ+DS介导的缺血心肌血管生成中起到重要作用。然而,缺氧是否影响Notch激活仍不清楚。
4 结论
研究结果表明,HQ+DS对MI大鼠的心脏保护作用可能取决于其在缺血区的促血管生成作用。此外,Notch信号和干细胞动员都可能参与HQ+DS促进的血管生成。研究结果有助于加深对活血化瘀类中药的认识,为HQ+DS作为心肌缺血相关疾病的治疗或联合治疗提供更多的治疗依据。

