秋茄叶抗肿瘤有效成分的分离与鉴定
●温扬敏 邱丹缨 罗彩林 谢永华(泉州医学高等专科学校 福建 泉州 362000)
红树植物属海区潮间带的木本植物类群,其独特的生境使红树植物富含结构独特、具有多种生物活性的化合物,天然的次生代谢产物是筛选药物先导化合物的重要来源[1]。红树植物的果实、皮和根等在民间长期作为药物使用,可用于麻风病、糖尿病、风湿病等一些常见疾病的治疗,以及作为动物创伤和中毒的外敷药等。开展红树林植物化学成份和药理活性研究,对红树林资源的保护和合理开发具有重要意义。
秋茄(Kandelia candel)属于红树科秋茄属植物,是最耐寒的红树植物种类,广泛分布于越南、印度、日本以及中国的福建、台湾、广东、广西等地[2]。Majumdar 等[3]最早从秋茄叶中分离出三萜和甾醇化合物,后来研究者们陆续从秋茄中分离鉴定出甾醇、萜类、鞣质类、黄酮类等具有一定生理活性的单体化合物。但目前对秋茄化合物的生理活性研究不够深入,化学成分研究还处于起步阶段。因此,研究秋茄的化学成分和生理活性,对秋茄资源的保护与利用以及新型先导化合物开发具有十分重要的意义[4]。本研究采用活性追踪方法对泉州湾红树植物秋茄叶抗肿瘤活性物质进行分离纯化,为秋茄药用成分的开发与新型抗肿瘤药物研究提供实验依据。
1 材料与方法
1.1 材料
秋茄叶采自泉州湾红树林保护区洛阳桥段,由泉州市红树林自然保护区陈若海工程师鉴定。采回实验室自来水洗净后烘箱45℃烘干,粉碎机粉碎后备用。
1.2 主要仪器与试剂
AVANCE Ⅲ500M 核磁共振仪( 德国Bruker公司);KHBST-360 型酶标仪(上海科华科技公司);紫外光谱仪( 英国Amersham Biosciences公司);HF-90 型CO2培养箱(北京阳光思特生物公司);ESI-MS 质谱仪(美国Thermo 公司);酶标仪(美国Dynex 公司);食管癌细胞株(天呈科技生物公司);反相柱层析硅胶RPC-18(德国Merck 公司);胎牛血清(美国Hyclone 公司);凝胶柱层析Sephadex LH-20 (上海宸乔生物科技有限公司);细胞培养基(北京赛默飞世尔公司);正相柱层析硅胶(青岛海洋化工有限公司)。
1.3 提取与分离
提取分离流程见图1。称两份质量为2kg 的秋茄叶,分别用双蒸水和95%乙醇浸泡3 次,每次24h,合并三次提取液,过滤蒸馏获得浸膏。95%乙醇浸膏用水混悬,依次用石油醚、乙酸乙酯和正丁醇萃取,减压回收溶剂,分别收集石油醚(357g)、乙酸乙酯(534g)和正丁醇(286g)萃取物。将乙酸乙酯萃取物经硅胶柱,用氯仿-甲醇梯度洗脱,分别收集氯仿-甲醇40∶1和10∶1 洗 脱2 个 组 份Fr.1(2 650mg)和Fr.2(1 960mg)。组份Fr.1 再经聚酰胺柱,用石油醚-氯仿梯度洗脱,分别收集3个组份Fr.1-1(660mg)、Fr.1-2(730mg)和Fr.1-3(570mg)。组份Fr.1-1经Sephadex LH-20 柱、氯仿-甲醇1∶1 洗脱,得到化合物1(92mg);组份Fr.1-2 经Sephadex LH-20 柱,氯仿-甲醇1∶1 洗脱,得到化合物2(86mg);组份Fr.1-3 经Sephadex LH-20 柱,氯仿-甲醇1∶1 洗脱,得到化合物3(88mg)和化合物4(79mg)。
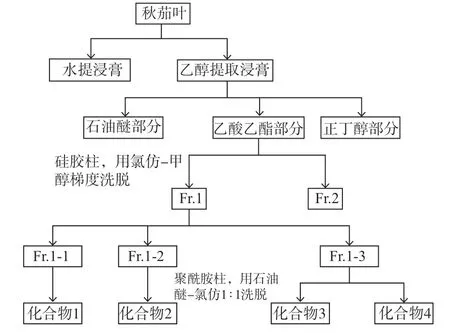
图1 秋茄叶化合物分离工艺流程图
1.4 MTT 实验
根据实验室已有方法[5],在100 mL 细胞悬液中分别加入不同浓度待测药物,培养72h 后,用酶标仪测定OD450值,按以下公式计算肿瘤抑制率。
抑制率=(OD 对照-OD 实验)/OD 对照×100%
2 结果
2.1 秋茄叶水提物和乙醇提取物抗肿瘤活性
为研究秋茄叶水和乙醇提取物的抗肿瘤活性,分别进行人食管癌EC-9706 细胞株抗肿瘤活性测定。细胞培养72h 后结果,见图2。从图2可以看出秋茄叶水提物和乙醇提取物对人食管癌EC-9706 细胞均有一定抑制效果。其中水提物和乙醇提取物对食管癌细胞抑制IC50为4.81mg/mL 和3.27mg/mL。不同浓度下,乙醇提取物的肿瘤抑制活性均显著高于水提物(p<0.05)。除0.2mg/mL外,乙醇提取物和水提物对食管癌细胞抑制活性存在极显著差异(p<0.01)。
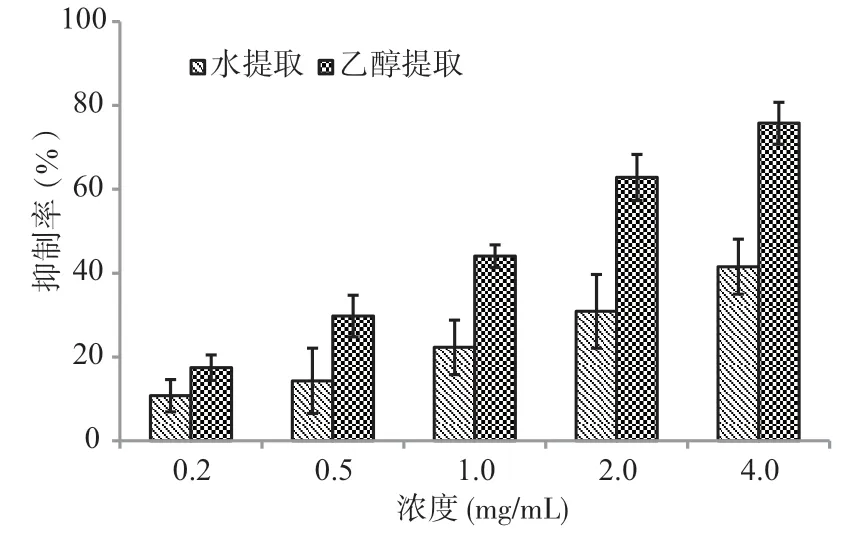
图2 秋茄叶水提物和乙醇提取物对人食管癌EC-9706 细胞的抑制活性
2.2 秋茄叶乙醇提取物不同萃取部分抗肿瘤活性
秋茄叶水提物和乙醇提取物抗肿瘤活性结果显示,乙醇提取物对食管癌细胞体外抑制活性显著高于水提物。因此,对乙醇提取物依次用石油醚、乙酸乙酯和正丁醇萃取,分别测定不同萃取部分对人食管癌细胞体外抑制活性(图3)。从图3 可以看出,石油醚萃取部分对食管癌细胞抑制活性较差,其中浓度为0.5mg/mL 时,石油醚萃取部分对食管癌细胞抑制率最高为5.97%,但不同浓度之间对食管癌抑制活性无显著差异(p>0.05)。乙酸乙酯和正丁醇萃取部分对人食管癌均有较强抑制活性,其中对食管癌细胞抑 制IC50为2.10mg/mL 和3.01mg/mL。乙 酸 乙酯和正丁醇萃取部分对人食管癌抑制活性均随浓度增加而增大。不同浓度下,乙酸乙酯萃取部分对食管癌抑制活性均极显著高于正丁醇萃取部分(p>0.01)。
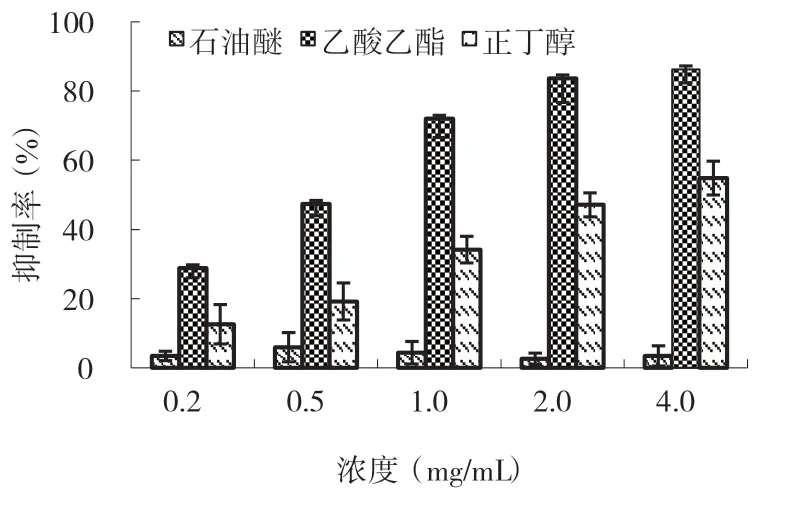
图3 秋茄叶乙醇提取物不同萃取部分对人食管癌EC-9706 细胞的抑制活性
2.3 硅胶柱分离各洗脱组分抗肿瘤活性
秋茄叶乙醇提取物不同萃取部分抗肿瘤活性结果显示,乙酸乙酯萃取部分对人食管癌体外抑制活性最大,因此采用硅胶柱进一步对乙酸乙酯萃取部分进行分离,得到两个组分(Fr.1 和Fr.2)。分别测定Fr.1 和Fr.2 对人食管癌细胞体外抑制活性(图4)。从图4 可以看出,不同浓度Fr.1 对人食管癌细胞均有一定抑制活性,且随浓度增加抑制活性增大,其中对食管癌细胞抑制IC50为0.37mg/mL。而不同浓度Fr.2 对人食管癌细胞抑制活性均小于10%,且不存在剂量关系。Fr.1 对人食管癌细胞抑制活性极显著高于Fr.2(p<0.01)。
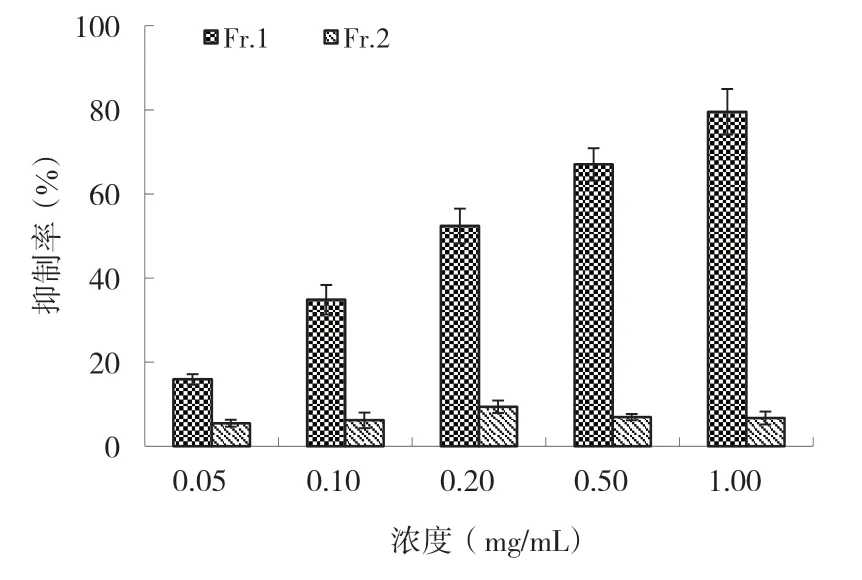
图4 硅胶柱各洗脱组分对人食管癌EC-9706 细胞抑制活性
2.4 分离单体化合物抗肿瘤活性
Fr.1 和Fr.2 对人食管癌细胞体外抑制结果显示,Fr.1 的抗肿瘤活性显著大于Fr.2。因此,采用聚酰胺柱和葡聚糖凝胶(Sephadex LH-20)柱分离得到四个单体化合物。本文分别测定了四个化合物对人食管癌细胞体外抑制活性(图5)。从图5 可以看出四个化合物对人食管癌细胞均有一定抑制活性,且抑制活性均随浓度增加和培养时间延长而增大。细胞培养72h 后,化合物1、化合物2、化合物3 和化合物4 对食管癌细胞抑制IC50分别为27.28μg/mL、30.47μg/mL、93.17μg/mL 和34.10μg/mL。
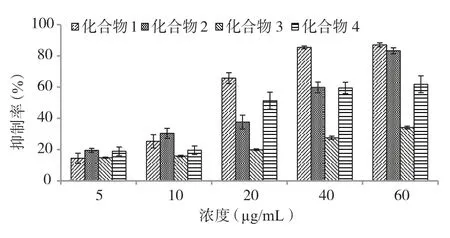
图5 秋茄分离单体化合物对人食管癌EC-9706 细胞的抑制活性
2.5 结构鉴定
单体化合物抗肿瘤活性结果显示,四个化合物均有一定抗肿瘤活性,所以分别对其进行结构鉴定。
2.5.1 化合物1白色粉末, mp 294~296℃。Liebermann-Burchard 反应阳性,Molish 反应阴性。由HR-ESI-MS 得到分子式C30H48O3。ESI-MSm/z:456 [M]+。1H-NMR (400 MHz, C5D5N)δH: 4.94(1H, brs, H-29α), 4.76 (1H, brs, H-29β), 3. 52 (1H,d,J= 9. 8 Hz, H-19),3. 49 (2H, t,J= 7. 8 Hz, H-3),1.94 (3H, brs, H-30), 1.21 (3H, s,H-27), 1.06 (3H, s,H-26), 1.05 (3H, s, H-23), 1.00 (3H, s, H-25), 0.82(3H, s, H-24).以上光谱数据与文献报道基本一致[6],加上与对照品呈现一致的Rf 值,故鉴定化合物为白桦脂酸(图6-A)。
2.5.2 化合物2白色粉末, mp 275~276℃。Liebermann-Burchard 反应阳性,Molish 反应阴性,溴甲酚绿反应阳性。ESI-MSm/z: 456 [M]+,分子式为C30H48O3。1H-NMR (400 MHz, C5D5N)δH: 5.48 (1H, t,J= 3.2 Hz, H-12), 3.47 (1H, dd,J=11.5, 4.8 Hz, H-3), 2.64 (1H, d,J= 7.8 Hz, H-18),1.36 (3H, s, 29-CH3), 1.24 (3H, s, H-27), 1.21(3H, s, H-23β), 1.04 (3H, s,H-24α), 1.01 (3H, s,H-30), 0.94 (3H, s, H-26), 0.87 (3H, s, H-5). 以上光谱数据与文献报道基本一致[7],加上与对照品呈现一致的Rf 值,故鉴定化合物为熊果酸(图6-B)。
2.5.3 化合物3白色粉末, mp 253~255℃。Liebermann-Burchard 反应阳性,茴香醛显色为紫红色。EI-MSm/z:442[M]+。1H-NMR(CDCl3,400MHz)δH:4.67(1H,s,H-29α),4.57(1H,s,H-29β),4.03(1H,d,J=9.8Hz,H-28b),3.32(1H,d,J=9.8 H z,H-2 8 a),3.1 8(2 H,t,J=7.8 H z,H-3),2.38(1H,m,H-19),1.93(3H,s,H-30),1.01(3H,s,H-26),0.96(3H,s,H-23),0.81(3H,s,H-25),0.75(3H,s,H-24)以上光谱数据与文献报道基本一致[8],加上与对照品呈现一致的Rf 值,故鉴定化合物为白桦脂醇(图6-C)。
2.5.4 化合物4白色粉末,mp 213~215℃。Liebermann-Burchard 反应阳性,茴香醛显色为紫红色,三氯醋酸反应呈阳性。ESI-MSm/z:427[M + H]+。1H-NMR(400MHz,CDCl3)δH:4.68(1H,d,J=2.4Hz,H-29a),4.58(1H,d,J=2.4Hz,H-29b),3.19(1H,dd,J=11.4,4.8Hz,H-3),1.68(3H,s,H-30),1.03(3H,s,H-26),0.97(3H,s,H-23),0.94(3H,s,H-27),0.83(3H,s,H-25),0.79(3H,s,H-28),0.76(3H,s,H-24)。以上光谱数据与文献报道基本一致[9],加上与对照品呈现一致的Rf 值,故鉴定化合物为羽扇豆醇(图6-D)。
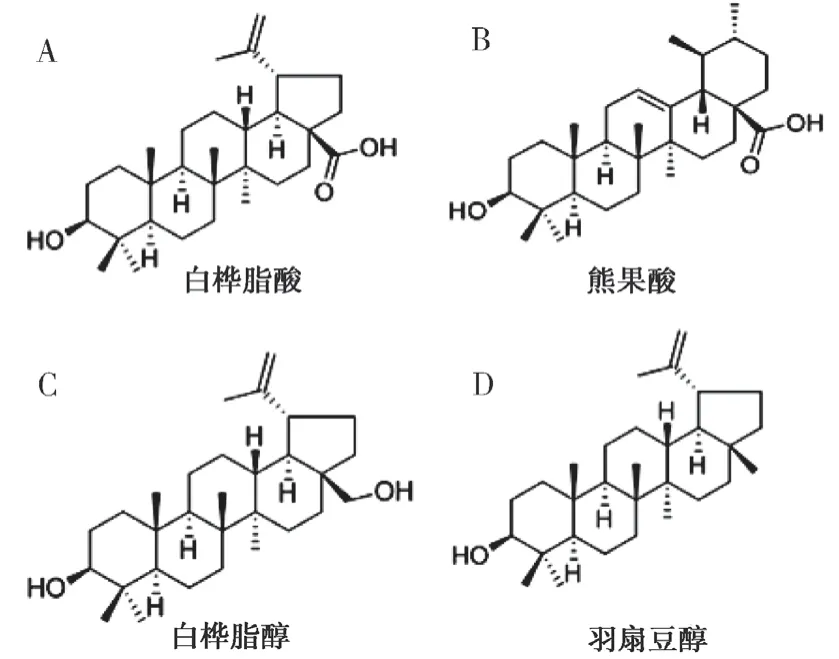
图6 秋茄叶中分离化合物的分子结构
3 讨论
秋茄是一种常见的红树植物,生长在热带、亚热带海岸潮间带特殊生境,不仅具有重要的生态意义,还具有重要经济和药用价值[10]。由于秋茄所处的特殊生长环境,已从秋茄中分离出多种具有特定生理功能的化合物。Majumdar 等[3]从秋茄叶分离出β-香树脂醇、木醛酮、蒲公英甾醇3 个三萜化合物和1 个甾醇化合物β-谷甾醇。Ghoshet 等[11]从秋茄的树皮中分离出包括6 个新鞣质类化合物。卢昌义等[12]等对秋茄叶脂肪酸组成研究表明秋茄叶中脂肪酸碳链多为12~28 个碳原子,富含软脂酸和硬脂酸等饱和脂肪酸,油酸和亚油酸等不饱和脂肪酸。从秋茄叶中分离出黄酮化合物芦丁对动脉样硬化和高血压有一定治疗作用。秋茄作为海洋药用植物已经被《现代本草纲目》收录[13]。
肿瘤是当前危害人类健康的主要疾病之一,研究表明秋茄的皮、果实、叶子等均有不同程度抗肿瘤活性。研究证实秋茄乙醇提取物对人鼻癌细胞CNE-1 具有抑制作用[14]。本研究结果显示秋茄叶乙醇提取物对人食管癌细胞体外抑制活性显著高于水提取物。陈虹等[15]研究表明,秋茄根石油醚提取物对人肝癌细胞SMMC-7721、小鼠黑色素瘤细胞B16 和人胃癌细胞BCG803 等均有体外抑制活性,其半致死浓度IC50分别为335.2μg/mL、378.6μg/mL 和275.6μg/mL。 本 研究结果与以上结论相似,显示秋茄叶乙醇提取物的石油醚萃取部分对人食管癌细胞具有体外抑制活性,其中秋茄叶乙醇提取物的乙酸乙酯萃取部分对人食管癌细胞体外抑制活性显著高于石油醚萃取部分。
为克服天然产物传统的先分离化合物再进行活性测定研究模式的盲目性,有效提高分离抗肿瘤活性物质的准确性。本研究以对人食管癌细胞体外生长抑制活性为指标,采用活性追踪的方式从秋茄叶中得到的4 个三萜类单体化合物:白桦脂酸、熊果酸、白桦脂醇和羽扇豆醇。且4 个三萜类单体化合物对人食管癌细胞均具有一定体外抑制活性,其结果与其他研究一致[16-17]。证实秋茄中含有多种抗肿瘤活性成分,具有重要的抗肿瘤等药用开发价值。未来有待进一步研究秋茄活性成分的抗肿瘤机制,为新型抗肿瘤药物及红树植物开发提供实验依据。

