利用菊糖生产L-乳酸的菌株筛选鉴定和发酵工艺优化
黄玉龙,孙若诗,全婷,刘燕,慕钰文,康三江,张辉元*
1(甘肃省农业科学院农产品贮藏加工研究所,甘肃省果蔬贮藏加工技术创新中心,甘肃 兰州,730070) 2(西北师范大学 生命科学学院,甘肃特色植物有效成分制品工程技术研究中心,甘肃 兰州,730070)
菊芋(HelianthustuberosusL.),从17世纪由欧洲传入中国,又称为洋姜、鬼子姜,菊科向日葵属,为多年生宿根性草本植物。菊芋生长高度在1~3 m不等,秋季开花,花如菊,黄色。叶子椭圆形,多毛。根茎系统深埋于地下并且比较结实粗壮,叶子互生于茎的顶端,中央是花头,多瘤的块茎在地下不均匀生长,其颜色有浅褐色、白色、红色等[1]。目前,国内已有对菊芋茎叶中活性成分、药理机制的相关报道[2],大多关于菊芋的研究以菊糖的提取、酶解工艺为主[3-4]。菊芋作为一种潜在的生物资源,其酶解产物可作为生物基化合物如乙醇、丁醇、丁酸、2,3-丁二醇、柠檬酸、乳酸等的生产原料[5-6]。国内外对L-乳酸的需求日趋增加,我国人多地少,粮食资源匮乏,进行以廉价非粮原料生产L-乳酸的研究显得尤为重要[7-8]。本文通过MRS改良培养基筛选产乳酸含量高的菌株,并对该菌株进行形态学及基因序列分析法鉴定[9],采用单因素和正交实验对其产乳酸发酵基质和培养条件进行系统研究,得出以菊糖酶解液发酵L-乳酸的最优工艺条件,旨在为菊芋的高值化开发提供一定的技术支撑。
1 材料与方法
1.1 材料与试剂
新鲜菊芋,购于甘肃兰州,红皮,肉质块茎。
菊糖酶解液:按液料比18∶1(mL∶g)于86 ℃下提取41 min的热水浸提工艺制取菊芋汁,水提液过滤后得菊糖汁;在菊糖汁中添加酵母膏氮源1.0%(体积分数),NaCl 0.5%(体积分数),K2HPO40.3%(体积分数),菊糖汁定容,初始pH6,经黑曲霉(Aspergillusniger) A-15在30 ℃下摇瓶发酵6 d,即为菊糖酶解液。菊芋汁中还原糖质量浓度从酶解前的0.997 g/L提高到酶解后的24.22 g/L。
菌种来源:本实验室保藏的菌种,编号依次为G、A2、A4、zh。
蛋白胨,上海中泰;牛肉浸膏,北京双旋;酵母膏,北京奥博星;柠檬酸氢二铵,天津凯通;K2HPO4,天津市北辰方工试剂厂;MnSO4、成都化学试剂厂;MgSO4、CH3COONa,中国医药公司;Tween-80、TE缓冲液、Marker、ddH2O等,革兰氏染色成套试剂,北京索莱宝。其他试剂均为市售分析纯或生物试剂。
1.2 仪器与设备
9700聚合酶链式反应(polymerase chain reaction,PCR) System,GeneAmp;SBA-40D生物传感分析仪,山东省科学院生物研究所;PHS-3C精密pH计,上海虹益仪器仪表有限公司;WZZ-2B自动旋光仪,上海精密科学仪器有限公司;Ultimate3000高效液相色谱仪,紫外检测器,DIONEX。
1.3 培养基
种子培养基为MRS肉汤培养基。
溶钙圈培养基:在MRS培养基中加入2%的CaCO3,1.5%(质量分数)的琼脂粉,pH值自然。1×105Pa灭菌15 min。
发酵培养基:依实验设计加入各成分,菊糖酶解液定容,调pH值。1×105Pa灭菌15 min。250 mL锥形瓶摇瓶厌氧发酵,装量50 mL。
1.4 实验方法
1.4.1 菌株的初筛
将本实验室保藏的4株产乳酸菌株,接入到MRS基础培养基中,以30 g/L果糖代替葡萄糖作为单一碳源进行发酵实验,36 ℃,发酵96 h后测定发酵液中乳酸产量,选择将果糖转化为乳酸产率较高的菌株,计算如公式(1)所示:
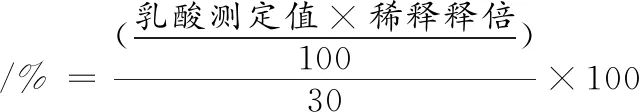
(1)
1.4.2 菌株的鉴定
参考文献[10-11]方法,根据筛选试验所选菌株,通过菌落形态观察和基因序列分析对菌株进行分类鉴定[12-13]。
(1)待鉴定菌株PCR的DNA模板的制备(反复冻融法):100 ℃煮沸5 min,-20 ℃下冷冻5 min,循环2次;上述样品5 000 r/min条件下离心1 min,吸取8 μL上清液即为PCR扩增的DNA模板。
(2)待鉴定菌株16S rDNA的扩增:以提取的DNA为模板,使用细菌16S rDNA通用引物P1(1 492r)、P2(27F)进行扩增。
反应体系总体积50 μL:模板5 μL、Primer 1[1 μL(1 μmol/L)]、Primer 2[1 μL(1 μmol/L)]、Taq酶25 μL、ddH2O 18 μL;PCR扩增程序:95 ℃预变性5 min、94 ℃变性30 s、58 ℃退火1 min、72 ℃延伸 2 min,30个循环;72 ℃延伸 10 min;4 ℃ 保存。
(3)琼脂糖凝胶电泳,点样量3 μL。
1.4.3 乳酸含量的测定
发酵液离心后取上清液,蒸馏水适当稀释,采用SBA-40D型生物传感自动分析仪测定乳酸含量[14-15]。
1.4.4 产乳酸条件优化
利用微生物产乳酸的过程通常为厌氧发酵,影响乳酸产量较显著的因素有K2HPO4、MnSO4、CH3COONa、接种量、培养时间、培养温度、pH值和氮源种类等[16-17]。以乳酸产量为考察指标,对上述因素分别进行单因素实验,并选取影响较显著的因素,采用4因素3水平正交试验,探究其对发酵培养基中乳酸产量的影响水平。
1.4.5 乳酸的粗制及旋光度的测定
成熟的乳酸发酵液,煮沸后用石灰乳调pH值为9.5~10,搅拌后55 ℃静置4 h,沉降菌体等悬浮物;趁热过滤得乳酸钙溶液,减压浓缩至25%,用50%(体积分数)的H2SO4在80 ℃条件下酸解乳酸钙,中和完全后,静置1~2 h;减压抽滤除去CaSO4得粗乳酸[18]。
粗制乳酸旋光度的测定:测定温度为20 ℃,测定管长度为10 cm,乳酸质量浓度7.5 g/L,在589.44 nm钠单色光源下,测定样品的旋光度[19]。
1.4.6L-乳酸和D-乳酸的测定
采用高效液相色谱法测定,色谱柱为Silversit C18,250 mm×4.6 mm×5 μm,流速0.5 mL/min,紫外检测波长210 nm,进样量20 μL,流动相为V(水)∶V(乙腈)=99.5∶0.5,柱温30 ℃。
样品预处理:取适量发酵液于50 mL离心管中,在4 ℃条件下8 000 r/min离心10 min,以除去CaCO3和菌体,取离心后的上清液,再加入等体积0.5 mol/L的H2SO4水溶液进行酸解,离心除去CaSO4,取1 mL上清液经适当稀释后,再以0.45 μm的滤膜过滤即得待测液。乳酸标样在上述色谱条件下经高效液相色谱分析。
2 结果与分析
2.1 可利用果糖的乳酸菌株的筛选
将4株产乳酸菌株以果糖为单一碳源,MRS培养基中发酵96 h测定发酵液的乳酸产量并计算果糖转化率,结果如表1所示,编号为zh的菌株在4株菌中乳酸产量较高(41 mg/100mL),且在此过程中果糖的转化率达到68.3%。因此选取zh菌株进行菌种鉴定和产乳酸条件优化。

表1 不同菌株对果糖的利用率Table 1 Utilization of fructose by different strains
2.2 菌株zh的鉴定及产乳酸条件优化
2.2.1 菌株zh的鉴定
通过菌落形态观察(图1-a)菌株zh在平板培养基上,菌落边缘呈不规则雪花状,中等大小,中间略有微小球状突起,微黄色,边缘湿润,乳白色,直径为(10±3) mm,菌落背面为乳黄色,实心菌落且生长旺盛。
对培养3 d的种子菌株zh进行革兰氏染色,镜检结果图1-b所示,显示为紫色杆状,革兰氏染色呈阳性,故其为G+。
溶钙圈实验:在溶钙圈固体培养基中接入菌株zh,36 ℃培养5 d后,结果如图1-c所示,在菌落周围有明显的透明圈,判定菌株zh可能为乳酸菌。
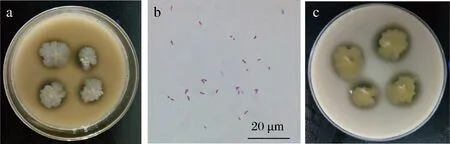
a-菌落形态;b-革兰氏染色;c-溶钙圈图1 菌株zh鉴定Fig.1 Strain zh identification
过氧化氢酶反应:反应无气泡产生,结果呈阴性。
糖发酵试验:反应结果如表2所示,菌株zh可发酵的糖类有乳糖苷、纤维二糖、山梨醇、葡萄糖和果糖。
综合菌株zh上述生理生化鉴定结果,根据《伯杰细菌鉴定手册》第9版,初步判定菌株zh为植物乳杆菌 (Lactobacillusplantarum)。

表2 菌株zh糖发酵试验结果Table 2 Biochemical identification results of stain zh
分子鉴定:菌株zh的PCR扩增后电泳图如图2,对照用Marker条带范围是100~5 000 bp,菌株zh的条带在1 300 bp左右。
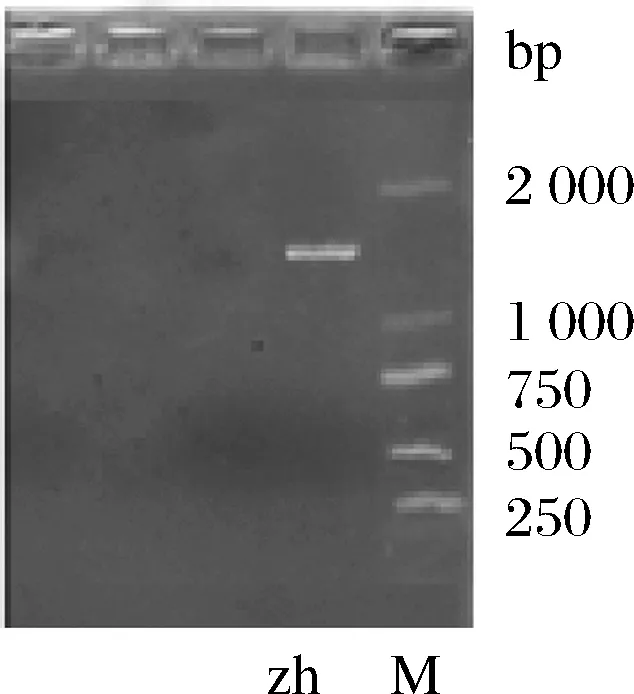
图2 菌株zh的PCR电泳图Fig.2 PCR electrophoregram of zh
同样的将PCR扩增产物委托华大基因(北京)测序后,得到序列在GenBank中登录号为KY368099。将菌株zh的序列结果输入到NCBI-BLAST数据库进行比对分析,结果显示此序列与L.plantarum菌株相似性较高。在NCBI上下载与所测序列有较高相似度(在96%以上)的序列,绘制的系统发育树如图3所示,菌株zh与L.plantarum在同一分支上,相似度>99%,最终确定菌株zh为植物乳杆菌(Lactobacillusplantarum)。

图3 菌株zh系统发育树Fig.3 Phylogenetic tree of the strain zh based on 16S rDNA sequences
2.2.2 菌株zh产乳酸条件优化结果与分析
在微生物生长代谢过程中,碳源、氮源、无机盐、培养时间、温度等外界因素均对代谢产物的积累产生较大的影响[20]。碳源和氮源为必需营养物质;盐离子在发酵过程中起缓冲作用;金属离子作为生长因子,对微生物的生长有促进或抑制作用,例如Mn2+是超氧阴离子和H2O2的清除剂,通过保护菌株免受活性氧的毒害而对菌株的生长产生积极作用;微生物生长依赖于最适温度和pH值,选择其生长的最适环境,对目标产物的积累起重要作用[21-22]。
分别以MnSO4、CH3COONa、接种量、培养温度、pH值和氮源种类作为考察因素,单因素实验结果如图4所示。由图4-a~图4-d可知,对菌株zh产乳酸量影响较大的因素是MnSO4、CH3COONa、培养温度和pH值。当这4个因素发生改变时,乳酸的积累量变化显著,而接种量对其影响较稳定。氮源筛选结果(图4-f)可知,zh菌株以酵母膏为氮源时,乳酸产量最高。因此在产乳酸条件优化实验中,培养基的基础成分以0.6%(质量分数)酵母膏为氮源、接种量2.0%、培养120 h,考察MnSO4、CH3COONa、培养温度和pH值对乳酸产量的相互影响。
根据正交实验设计原理,结合单因素实验结果,选取MnSO4、CH3COONa、培养温度和pH值这4个因素(表3),进行L9(34)正交实验,结果见表4,方差分析结果见表5。

表3 菌株zh正交实验因素水平表Table 3 Factors and levels of orthogonal tests
根据正交试验结果,影响因素的排序为C>A>D>B,培养温度对菌株zh产乳酸影响最大,其次是MnSO4添加量和pH值,CH3COONa添加量对其影响最小,优化后的理论工艺参数为A2B2C3D1;方差分析结果表明C影响极显著,P<0.01;A影响显著,P<0.05。确定的最优发酵条件为:最佳氮源为酵母膏,氮源质量分数0.6%、MnSO40.6 g/L、CH3COONa 7 g/L、pH 4、接种量2.0%、培养温度34 ℃,摇瓶发酵120 h,此时菌株zh产乳酸的量可达到13.99 g/100g(菊芋干粉)。
为检验试验结果的可行性,将优化工艺参数进行产乳酸验证试验,重复3次取平均值,实际的乳酸产量可达到14.37 g/100g(菊芋干粉),因此菌株zh产乳酸稳定且重复性好。
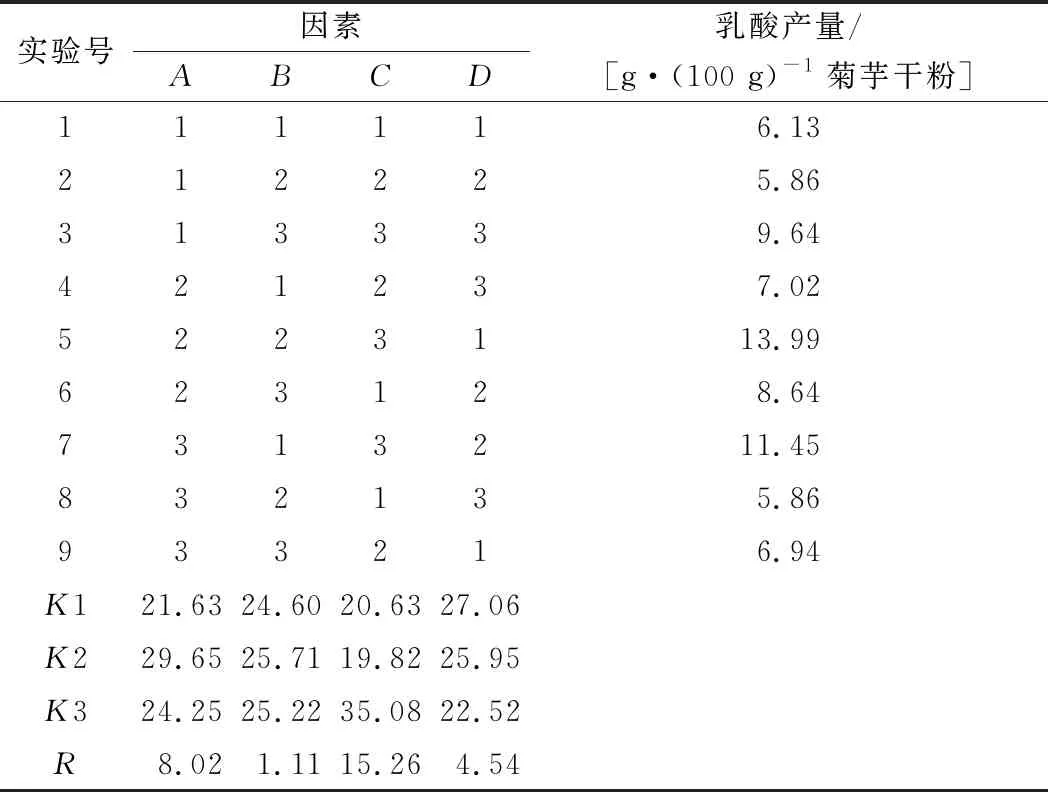
表4 L9(34)正交试验结果Table 4 Result s of orthogonal experiment
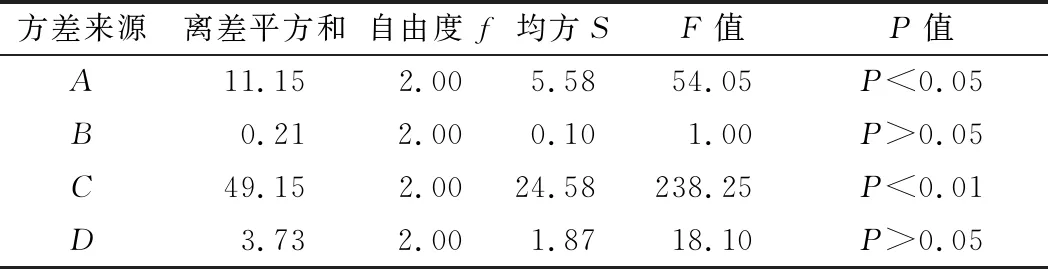
表5 方差分析结果表Table 5 The results of variance analysis
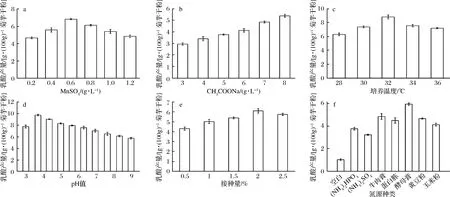
a-MnSO4添加量;b-CH3COONa添加量;c-培养温度;d-pH值;e-接种量;f-氮源种类图4 菌株zh产乳酸单因素图Fig.4 Single factor diagram of lactic acid production by strain zh
2.2.3 旋光度的测定
将粗制所得的乳酸样品稀释至7.5 g/L,在589.44 nm钠单色光源下测定其旋光度,其旋光度平均值为+0.153。L-乳酸旋光度为(+),D-乳酸旋光度为(-),乳酸标样经高效液相色谱(high performance liquid chromatography,HPLC)进行分析后,其色谱图如图5所示,D-乳酸和L-乳酸保留时间分别为3.453 min和4.454 min。由所测样品旋光度值可初步判断,本研究中通过菊糖酶解液所得到乳酸为外消旋体[23]。

1-D-乳酸;2-L-乳酸图5 乳酸标准样品液相色谱图Fig.5 The HPLC chromatogram of lactic acid standard
3 结论与展望
本实验筛选出1株可发酵转化菊糖酶解液的菌株zh,通过菌落形态观察、生理生化及16S rDNA序列分析,确定该菌株为植物乳杆菌(L.plantarum)。通过单因素和正交实验,优化了zh菌株发酵菊糖酶解液制备L-乳酸的工艺条件,其最佳培养条件为以酵母膏为氮源,氮源0.6%(质量分数),MnSO40.6 g/L、CH3COONa 7 g/L,菊芋酶解液定容,初始pH值4,接种量2.0%,培养温度34 ℃,摇瓶发酵120 h。经3次平行验证试验表明,菌株zh实际产乳酸量达到14.37 g/100g菊芋干粉。对制备的乳酸粗品进行旋光性检测,其平均旋光值为+0.153,初步判定试验所得乳酸为外消旋体。综上所述,该菌株产酸量可观,营养需求简单,生产成本较低,能够为菊芋等非粮原料生产L-乳酸的菌株筛选和产酸条件优化提供一定借鉴。
随着L-乳酸在食品、医药、化妆品等领域的广泛应用,降低成本是L-乳酸发酵生产过程中的核心问题,而非粮原料或农林副产物已成为低成本发酵原料的重要糖源。菊芋作为重要的能源经济作物,块茎中菊糖含量约占干物质的80%(质量分数),是优质廉价的发酵原料之一。本试验仅是在摇瓶培养条件下的结果,发酵罐放大试验及工业化生产中运用时的工艺条件还有待进一步优化。可通过对生产菌株的诱变选育,并考虑同步糖化发酵的连续工艺,进一步提高L-乳酸的发酵生产水平。

