Wnt/β-catenin信号通路与miRNA在食管癌发生发展中的研究进展
张臻,徐克平
(南京医科大学附属淮安第一医院胸外科,江苏 淮安 223300)
食管癌是一种较常见的消化道疾病,其病理特点十分明显,最常见的为食管腺癌(esophageal adenocarcinoma,EAC)和食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)[1-2]。食管癌是全球第六大常见死亡疾病,主要发生在亚洲国家。2015年,中国新增47.79万食管癌病例,同年约有37.5万例患者死亡[3]。食管癌在不同地区的发病率、组织学类型和预后各不相同。食管癌患者最初无明显症状,通常诊断即为晚期,预后较差,5年生存率为15%~25%[4];在这个阶段,切除病灶通常不是合理的选择,放疗和化疗等替代治疗的效果也非常有限,因此提高食管癌诊断率和了解其分子基础机制显得尤为重要。研究表明,Wnt/β联蛋白(β-catenin)信号通路的激活或抑制具有调控食管癌发生发展的作用[5]。而微RNA(microRNA,miRNA)是一种非编码小分子RNA,其已被证明可以调节细胞的生长、分化和迁移,且在癌症中表达失调[6]。临床上,越来越多的miRNA被用作癌症的生物标志物,因此识别疾病阶段或治疗反应性的miRNA成为研究热点。研究表明,miRNA在食管癌中发挥重要的调控作用与Wnt/β-catenin信号通路密切相关[7]。现就Wnt/β-catenin信号通路与miRNA在食管癌发生发展中的研究进展予以综述,以为临床治疗食管癌及开发新药提供新思路。
1 Wnt/β-catenin信号通路的概述
1982年,Nusse和Varmus[8]首次在乳腺肿瘤病毒诱发小鼠乳腺癌过程中发现了Wnt基因,Wnt在进化上保持一种高度保守的状态,其在细胞的分化、增殖、凋亡、发育以及各种肿瘤发展等过程均具有调控作用。Wnt信号通路的启动是在低密度脂蛋白受体相关蛋白5/6的辅助下与跨膜卷曲蛋白结合,从而激活Wnt信号通路[9]。Wnt信号通路根据传递方式的不同分为Wnt/β-catenin经典通路和Wnt/Ca2+、Wnt/平面细胞极性非经典通路[10]。在正常状态下,Wnt信号通路呈现静息或未激活状态,一旦Wnt信号通路过度活化,会诱发细胞出现异常增殖和分化,最终引起肿瘤的发生。Wnt/β-catenin信号通路主要由Wnt1、Wnt2以及Wnt3等配体激活。当无Wnt激活信号时,下游通路中的β-catenin能与轴抑制蛋白、糖原合成酶激酶3β(glycogen synthase kinase-3β,GSK-3β)和腺瘤息肉病大肠杆菌蛋白形成的复合体相互作用并引起磷酸化,随后与泛素蛋白结合,最终被蛋白酶水解(图1)。当有Wnt激活信号时,Wnt蛋白能与低密度脂蛋白受体相关蛋白5/6和卷曲蛋白相结合,激活蓬乱蛋白,并在蓬乱蛋白的作用下促使GSK-3β磷酸化,使β-catenin无法磷酸化而累积在细胞中,这些非磷酸化β-catenin随即进入细胞核并与淋巴样增强因子和T细胞因子复合物结合,进而激活靶基因[11-13](图2)。
2 Wnt/β-catenin信号通路与食管癌
2.1Wnt/β-catenin信号通路在食管癌中异常表达 Wnt/β-catenin信号通路在包括ESCC在内的多种癌症中持续激活,具有调节细胞增殖、侵袭、迁移分化等多种功能,而阻断Wnt/β-catenin信号通路被认为是治疗各种类型癌症的潜在选择[14]。经典Wnt信号通路是癌症生物学的一项重要机制。经典Wnt信号通路激活是多步骤的复杂过程,其中Wnt2是一种配体蛋白,以旁分泌的方式在肿瘤成纤维细胞中分泌,且在不同细胞中可以激活不同的信号通路[15]。β-catenin是Wnt经典通路下游中的重要蛋白分子,在各种肿瘤(乳腺癌、宫颈癌等)的发生发展中发挥着不可或缺的调控作用,在食管癌组织的细胞核和细胞质中均显著表达[16]。Deng等[17]通过免疫组织化学方法分析了265份ESCC样本中Wnt2、GSK-3β、β-catenin表达的临床病理意义,结果发现,在55.5%的ESCC样本中检测到Wnt2过表达,其与分化程度呈显著正相关;7.2%的ESCC样本细胞质中检测到GSK-3β过表达,54.3%的ESCC样本中检测到β-catenin过表达,且随着样本中哈萨克人ESCC恶性程度的加重,Wnt2的阳性率明显升高;同时还发现,β-catenin的异常表达与种族、肿瘤大小、肿瘤位置、分化程度具有相关性。Pan等[18]研究发现,β-catenin在食管癌中显著表达,且β-catenin磷酸化程度与临床病理显著相关,这对食管癌的临床治疗和预后具有重要参考意义。
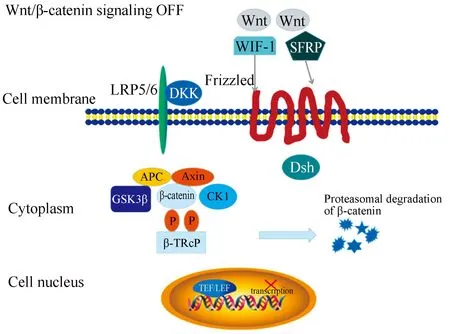
β-catenin:β联蛋白;WIF-1:Wnt抑制因子-1;SFRP:分泌型卷曲相关蛋白;Cell membrane:细胞膜;LRP:低密度脂蛋白受体相关蛋白;DKK:Dickkopf;Frizzled:跨膜受体卷曲蛋白;Cytoplasm:细胞质;APC:腺瘤息肉病大肠杆菌蛋白;Axin:轴蛋白;Dsh:蓬乱蛋白;GSK-3β:糖原合成酶激酶3β;CK1:酪蛋白激酶1;β-TRcP:β-转导重复相容蛋白;Cell nucleus:细胞核;TEF/LEF:T细胞因子/淋巴增强因子;transcription:转录;Proteasomal degradation of β-catenin:β联蛋白的蛋白酶体降解

β-catenin:β联蛋白;Cell membrane:细胞膜;LRP:低密度脂蛋白受体相关蛋白;Frizzled:跨膜受体卷曲蛋白;Cytoplasm:细胞质;Dsh:蓬乱蛋白;APC:腺瘤息肉病大肠杆菌蛋白;Axin:轴蛋白;CK1:酪蛋白激酶1;GSK-3β:糖原合成酶激酶3β;Cell nucleus:细胞核;TEF/LEF:T细胞因子/淋巴增强因子;transcription:转录;Degradation of Axin:轴蛋白降解
2.2Wnt/β-catenin信号通路在食管癌中的调控作用 Wnt/β-catenin信号通路具有调控食管癌发生发展的作用。Xue等[19]研究发现,丙泊酚可以通过阻断Wnt/β-catenin途径,诱导食管癌A109细胞凋亡,抑制过氧化氢诱导的细胞增殖和转移,从而为ESCC的治疗提供了可能的途径。这表明,Wnt/β-catenin信号通路在丙泊酚对食管癌的保护过程中发挥了关键作用。Mao等[20]的研究显示,视黄酸受体在人食管癌组织中高表达,其高表达与食管癌的病理分化、淋巴结转移及临床分期密切相关。进一步研究发现,视黄酸基因敲除能够通过下调增殖细胞核抗原、基质金属蛋白酶7和基质金属蛋白酶9的表达抑制食管癌细胞的增殖和转移以及增强食管癌细胞对5-氟尿嘧啶(5-fluorouracil,5-FU)和顺铂的敏感性,而这个过程与Wnt/β-catenin的活性有关。以上结果表明,下调视黄酸受体可能通过Wnt/β-catenin信号通路减慢食管癌的恶性发展。Zhu等[21]对肿瘤坏死因子-α诱导蛋白8样分子2(tumor necrosis factor-α induced protein-8-like 2,TIPE2)在食管癌中的分子机制进行探究发现,TIPE2在食管癌组织和细胞中表达下调,而腺病毒介导的TIPE2过表达能显著抑制食管癌细胞的增殖、侵袭以及诱导细胞凋亡。同时,TIPE2在体内外高表达抑制了食管癌Wnt/β-catenin信号通路中蛋白的表达,表明TIPE2可能通过抑制Wnt/β-catenin信号通路抑制食管癌的进展和发生。Zhao等[22]在探究人钙蛋白酶4(Calpain-4,CAPN4)在ESCC中的作用发现,ESCC组织中的CAPN4表达水平显著上调,与相关的恶性特征呈正相关;沉默CAPN4的表达后,ESCC的侵袭和转移明显抑制,而这个过程可能是通过CAPN4激活ESCC细胞中的Wnt/β-catenin信号通路来发挥调控作用。Li等[23]研究发现,Msi2过表达能够激活Wnt/β-catenin和Hedgehog信号通路,进而促进ESCC细胞增殖、上皮-间充质转化和迁移。Han等[24]研究表明,小核仁RNA宿主基因16在包括ESCC在内的多种癌症的增殖和转移中起着关键的调节作用,其在ESCC中的表达与肿瘤分期、淋巴结转移和临床分期呈正相关;进一步研究发现,下调小核仁RNA宿主基因16后,ESCC细胞中Wnt/β-catenin信号通路的蛋白表达明显减少,细胞增殖和侵袭显著增加,细胞凋亡显著减少。这表明,小核仁RNA宿主基因16可能通过调控Wnt/β-catenin信号通路影响ESCC的增殖和转移。可见,Wnt/β-catenin信号通路在食管癌中发挥重要作用,抑制Wnt/β-catenin信号通路激活能够显著抑制食管癌的发展,这也为临床治疗食管癌提供理论指导。
3 miRNA与食管癌
3.1miRNA作为食管癌的生物标志物 miRNA是一种进化保守的非编码小分子RNA,长度为18~25个核苷酸,通过与3′非翻译区作用抑制翻译或促进其降解[25]。目前研究证实,miRNA在几乎所有的生物学通路中均发挥重要作用,其与肿瘤的发生发展密切相关,在临床中常被作为肿瘤诊断和治疗的分子靶点[26]。Zhang等[27]首次尝试将循环miRNA作为食管癌的生物标志物,在来自ESCC患者的290份血清样本中将miR-10a、miR-22、miR-100、miR-148b、miR-223、miR-133a和miR-127-3p等一系列miRNA作为诊断指标,结果发现这些miRNA单独或相互结合具有良好的诊断能力。Zhang等[28]研究发现,miR-25-3p、miR-151a-3p、miR-100-5p和miR-375可能作为识别EAC患者的血清生物标志物,分析这些miRNA指标对EAC患者的早期检测或治疗反应具有重要临床价值。Sun等[29]研究发现,与健康对照者相比,ESCC患者的血浆miR-718表达水平明显降低,且与TNM分期及淋巴结转移呈负相关,表明血浆中的miR-718可能作为ESCC潜在的诊断标志物。miR-206可抑制多种肿瘤细胞的增殖、侵袭和迁移,但其对食管癌的预后价值尚不明确。Du等[30]通过转录组测序技术和甲基化数据库分析了miR-206在食管癌遗传和表观遗传机制中的重要作用,结果发现,miR-206高表达与食管癌的不良预后显著相关。
3.2miRNA介导的食管癌耐药机制 化疗是提高晚期食管癌患者整体生存率和生活质量的有效途径。然而,耐药性大大削弱了化疗和替代治疗的有效性。文献报道,表观遗传修饰(如miRNA调控)与耐药现象密切相关[31];有证据表明,miRNA表达异常可促进抗凋亡和耐化学反应表型,因此对所选miRNA表达的修饰可能在一定程度上改善药物反应,甚至逆转多重药物耐药[32]。Hummel等[33]通过微阵列和实时定量聚合酶链反应测定ESCC细胞中miRNA的表达谱发现,在顺铂耐药的ESCC细胞中发现1个miRNA (miR-130a-3p)和6个miRNA(miR-935、miR-550a-3p、miR-125a-5p、miR-1226-3p、miR-99b-5p和miR-18a-3p)在5-FU耐药的ESCC细胞中表达失调。在质子泵抑制剂治疗后,ESCC中耐药相关的miRNA表达发生了改变,miR-141和miR-200b表达上调,而miR-376a表达下调[34]。Lynam-Lennon等[35]研究表明,miR-31可以调节EAC的辐射抵抗。另有研究表明,miR-145可以保护SK-GT4细胞(EAC细胞系)对抗顺铂,并增强顺铂在FLO-1细胞(EAC细胞系)中的作用[36]。因此,miRNA表达水平与EAC耐药的发展相关。
3.3miRNA在食管癌中的调控作用 miRNA表达的上调和下降在食管癌中起关键的调控作用,Zhen和Huang[37]探讨了miR-652在ESCC中的作用发现,上调miR-652表达可显著减少ESCC细胞的增殖和侵袭,其中成纤维细胞生长因子受体1被确定为ESCC细胞中miR-652的直接靶标,且与miR-652的表达呈负相关,而增加成纤维细胞生长因子受体1表达,可以消除miR-652过表达对ESCC细胞增殖和侵袭的抑制作用,表明miR-652通过直接靶向成纤维细胞生长因子受体1抑制ESCC细胞的增殖和侵袭。Hu等[38]研究发现,食管癌患者癌组织中的miR-124表达水平低于健康对照者,且Ⅲ~Ⅳ期食管癌患者中miR-124的表达水平显著低于Ⅰ~Ⅱ期患者;进一步研究发现,miR-124的表达水平与肿瘤大小、肿瘤转移和淋巴结转移存在一定的相关性。也有研究显示,miR-155在食管癌患者肿瘤组织中的表达上调,并调控包括凋亡(肿瘤蛋白p53诱导核内蛋白1、肿瘤蛋白p53和胱天蛋白酶3)、Janus激酶-信号传导及转录激活因子-细胞因子信号抑制物以及转化生长因子-β在内的多种与食管癌相关的通路,在细胞增殖、细胞周期、发育、免疫和炎症多方面发挥重要作用[39]。随着医疗技术的发展,肿瘤的早期诊断对治疗癌症具有重要指导意义,且不同miRNA在食管癌中发挥的作用也不尽相同,充分了解miRNA的功能及其机制可能为癌症诊断提供指导价值。
4 Wnt/β-catenin信号通路相关miRNA与食管癌
4.1巴雷特食管(Barrett′s esophagus,BE)和EAC EAC是西方国家食管癌的主要组织学类型,其发病率呈上升趋势。前体病变EAC,又称BE,是一种远端食管的化生性病变,其特征主要表现为食管末端的正常鳞状上皮被肠样柱状上皮取代[40-41]。BE患者发生EAC的可能性是正常人的30~40倍。SOX17是Wnt的负调控因子,在正常黏膜向EAC的进展中逐渐丢失,但SOX17是否直接参与了正常黏膜向EAC的转化尚不清楚,miR-141已被证明可以下调食管癌细胞系中SOX17的表达,激活Wnt信号通路,进而促进EAC的发生[42]。虽然很多miRNA在EAC进展中的作用尚不清楚,但BE中Wnt活化的缺失可能与miR-31、miR-744、let-7c和miR-200a的下调有关,其中miR-31直接作用于Wnt抑制剂DKK(Dickkopf)1,在BE中可观察到DKK1的表达水平明显升高,间接显示了Wnt与miRNA的关联性[43]。miR-744被证明直接靶向Wnt/β-catenin信号转导的几种负调节剂,包括GSK-3β,因此观察到的miR-744缺失与BE中Wnt信号转导减少有关,但与其通过增加胰腺中的表达来驱动Wnt活化和致瘤性不同[44]。let-7c的丢失可能导致腺瘤息肉病大肠杆菌蛋白水平升高,并破坏稳定的复合体,可能有助于限制BE中的β-catenin反式激活。在Wnt信号级联中,许多与BE相关的miRNA均有靶点,它们可能通过激活或抑制Wnt信号通路促进EAC的转移和侵袭[45]。Wang等[6]研究发现,miR-221在人类EAC组织及5-FU耐药的EAC细胞中过度表达,抑制miR-221可以显著减少5-FU耐药细胞的增殖,诱导细胞凋亡,并恢复细胞对其化学敏感性,其中DKK2被证明是miR-221的靶基因,抑制miR-221可以导致DKK2调控的Wnt/β-catenin信号通路的抑制。此外,减少miR-221的表达会导致上皮-间充质转化相关基因(如上皮钙黏素和波形蛋白)的改变以及裸鼠异种移植肿瘤的生长明显减慢[46]。可见,miR-221可能通过靶向DKK2表达调控Wnt/β-catenin-上皮-间充质转化途径来控制EAC的5-FU耐药作用。
4.2食管鳞癌 miRNA异常表达可以通过激活或抑制Wnt/β-catenin信号通路影响食管鳞癌的发生发展[47]。miR-4261是一种新发现的miRNA,其在乳腺癌中过表达且能促进乳腺癌细胞增殖、细胞周期的G1/S期过渡和迁移[48]。Ma等[49]研究发现,miR-4261在ESCC组织和细胞系中显著上调,且Wnt/β-catenin信号抑制剂DKK2被确定为miR-4261的靶标。miR-4261下调可以抑制Wnt/β-catenin信号通路,进而抑制ESCC的发生和进展。Liu等[50]研究了miR-455-3p在食管癌中的作用发现,拮抗miR-455-3p可显著抑制食管鳞癌的化疗抵抗性和侵袭性。其作用可能通过抑制Wnt/β-catenin和转化生长因子-β信号通路使CD90+和CD271+细胞亚群减少,进而影响食管鳞癌的发展。Qi等[51]通过检测ESCC组织样本中miR-30a-3p/5p的表达以及体外增殖等实验发现,miR-30a-3p/5p的低表达与ESCC晚期进展及患者预后差密切相关,下调miR-30a-3p/5p可以通过靶向抑制Wnt2和卷曲蛋白2,激活Wnt信号通路,进而促进ESCC细胞增殖,而增加miR-30a-3p/5p表达可以抑制细胞增殖。Ren等[52]研究发现,miR-638过表达可以促进饥饿和雷帕霉素诱导的ESCC细胞自噬,为了进一步阐明miR-638在自噬中的调控机制,他们通过与多个预测算法的结果相交发现,DACT3是Wnt/β-catenin信号转导的关键调节因子,其机制可能为miR-638通过直接抑制DACT3,激活Wnt/β-catenin信号通路,进而促进癌细胞的自噬。Zhang等[53]研究发现,miR-644a可以通过调节配对样同源转录因子2引起蛋白激酶B/GSK-3β/β-catenin信号通路失活,抑制ESCC细胞的恶性程度。Zhang等[54]研究发现,miR-200b可以通过细胞周期蛋白依赖性激酶1、细胞周期蛋白依赖性激酶2、细胞周期蛋白依赖性激酶4、细胞周期蛋白B等多种关键细胞周期调控因子以及Wnt/β-catenin信号转导的表达和激活来诱导G2期细胞周期阻滞和凋亡,减缓ESCC细胞的生长。Ge等[55]研究发现,miR-942通过直接靶向Wnt/β-catenin蛋白信号级联的多级负调控因子人分泌型卷曲相关蛋白4、GSK-3β和Ⅰ型分裂蛋白转导素样增强子来上调Wnt/β-catenin蛋白信号活性;同时他们发现,c-Myc能直接与miR-942启动子结合并促进其表达,表明miR-942可以通过激活Wnt/β-catenin信号通路促进ESCC的发生发展,其可能是ESCC的有效治疗靶点。高危型人乳头瘤病毒(high-risk human papilloma virus,HR-HPV)被认为是诱发食管癌的可能原因,但其分子发病机制尚不清楚。Zang等[56]以miR-125b和Wnt/β-catenin信号通路为基础探讨了HR-HPV感染食管癌的可能机制,结果发现,miR-125b与HR-HPV感染的食管癌呈负相关,且过表达miR-125b能够抑制Wnt/β-catenin蛋白信号活性,表明HPV-16 E6可能通过下调miR-125b和激活Wnt/β-catenin蛋白信号通路来促进食管癌的发生。ESCC患者的放疗受到电离辐射的抵抗性限制。有证据表明,miR-301a的异常表达有助于癌症进展和对放射线的敏感性[57]。Su等[58]研究发现,miR-301a可能通过与抗辐射性目标Wnt1相互作用,抑制Wnt/β-catenin和上皮-间充质转化,从而提高辐射敏感性。以上研究结果表明,miRNA和Wnt/β-catenin信号通路存在互相调控的关系,miRNA异常表达可以通过激活或抑制Wnt/β-catenin信号通路影响食管癌的发生发展,且这种调控机制也为miRNA和Wnt/β-catenin信号通路作为治疗食管癌新靶点以及癌症生物标志物提供了理论指导。
5 小 结
虽然学者对miRNA和Wnt/β-catenin信号通路在食管癌发生发展中的作用进行了大量研究,但是不同类别的miRNA在食管癌形成中的作用以及miRNA能否特异性调控Wnt/β-catenin信号通路仍需进一步探究。目前,肿瘤的治疗逐步向精准和靶向方向推进,如何在临床上做好个体化治疗显得尤为重要。此外,充分了解食管癌的发病机制及诊断生物标记对探索新药、病情诊断以及治疗食管癌具有重要意义。未来,进一步阐明Wnt/β-catenin信号通路与miRNA之间的调控关系,可为食管癌的防治及其临床治疗提供新思路。

