基于TCGA数据库分析ASPM在肺腺癌中的表达及临床意义
杜 强,姚义勇,曾 刚
(南京医科大学附属苏州医院呼吸与危重症医学科,江苏 苏州 215008)
目前,肺癌的发病率和致死率在恶性肿瘤中位居首位。2018年全球肿瘤统计报告显示,新发肺癌患者达210 万,肺癌患者死亡人数为180 万(约占癌症死亡人数的1/5),其中东亚地区男性肺癌发病率全球最高,而女性患者发病率最高的是北美及欧洲等西方国家[1]。非小细胞肺癌是最常见的肺癌病理类型,占所有肺癌的85%,其中肺腺癌是最常见的非小细胞肺癌亚型,占比可达40%[2]。近年研究发现,异常纺锤体样小头畸形相关基因(abnormal spindle-like microcephalyassociated gene,ASPM)参与神经系统的发育、调节干细胞特性等功能[3]。此外,在神经系统、消化系统、生殖系统等多种恶性肿瘤中,ASPM 表达水平较癌旁组织高,且高表达患者预后较差。但其影响肿瘤预后的分子作用机制不明确,此前报道可能通过调控细胞周期、p53、Wnt 等通路促进肿瘤的发生发展[4],目前ASPM在肺腺癌中的作用研究甚少,缺乏ASPM对肺腺癌患者生存预后影响及潜在机制方面的研究。本研究旨在通过生物信息学方法研究ASPM 在肺腺癌中表达情况、对肺癌预后的影响及可能的作用机制。
1 资料与方法
1.1 数据资料下载
从TCGA 数据库下载肺腺癌患者RNASeq-2GeneNorm 表达谱数据和相关临床数据共585 例(数据截止更新日期为2016 年01 月28 日),其中肺腺癌515例,剔除资料不全的样本,具有完整生存随访时间的肺腺癌病例共470 例,其中男性病人219 例,女性病人251例,具有配对的癌旁组织共计58例;主要临床资料包括年龄、吸烟史、TNM分期及生存状态等。
1.2 方法
1.2.1 生存分析将肺腺癌患者按照ASPM 表达水平高低进行排序,以ASPM 表达水平中位数为界,分为低表达组和高表达组,使用SPSS 软件中以Kaplan-Meier法分析患者的ASPM表达水平与生存期关系,进行log-rank 检验;并采用Cox 回归模型分析影响预后的危险因素,计算风险比及95%置信区间,P<0.05为差异具有统计学意义。
1.2.2 差异基因筛选从TCGA 数据库下载表达数据,按照ASPM 表达水平的中位数为界,分为低表达组和高表达组,使用R语言中的ballgown及ggplot软件包进行高低表达组间差异基因筛选[阈值设置:差异基因上调倍数(fold change,FC)≥1.3 或下调倍数≤0.8,P<0.05]。
1.2.3 差异基因GO 分析在DAVID 6.8 在线数据库中(https://david.ncifcrf.gov/),对差异基因进行GO(gene ontology)分析(物种和背景均为Homo sapiens),主要涉及细胞组分(cellular component,CC)、生物过程(biological process, BP) 和 分 子 功 能(molecular function,MF)。
1.2.4 ASPM 相关的信号通路富集分析按照ASPM表达水平分高表达组和低表达组,使用GSEA4.0.3进行KEGG 信号通路分析,参数设置:Gene sets database:c2.cp.kegg.v7.1.symbols;Number of permutations:1 000 次;以|NES|>1,NOMP-value<0.05,FDRqvalue<0.25作为基因显著富集的判断标准。
1.2.5 蛋白交互网络分析利用在线分析工具STRING(https://string-db.org/)预测差异蛋白间的相互作用,在STRING中输入183个差异基因并分析,综合评分≥0.7被认为是有意义的,绘制蛋白质网络分析图[5],将STRING 得到的差异基因导入Cytoscape 软件中,利用Cytohubba 插件基于最大邻域分量法(maximum neighborhood component,MNC)分析关键基因。
1.3 统计学方法
癌和癌旁组织表达差异基因采用R 语言分析(ballgown及ggplot软件包);统计分析使用SPSS 21.0软件;ASPM mRNA 在癌和癌旁组织表达水平的差异采用GraphPad Prism 7 软件作图,采用配对样本t检验;ASPM mRNA 表达与肺腺癌患者临床病理学特征的关系采用χ2检验;生存分析采用Kaplan-Meier 法及log-rank检验;并运用Cox比例风险回归模型分析影响患者预后危险因素,P<0.05为差异有统计学意义。
2 结 果
2.1 ASPM mRNA 在肺腺癌组织和配对癌旁组织的表达水平
在TCGA 数据库中具有完整资料的肺腺癌和匹配的癌旁组织共计58例,对其ASPM mRNA表达水平进行分析显示癌组织表达水平明显高于匹配的癌旁组织,且差异有统计学意义(P<0.05),见图1。

图1 癌和癌旁组织中ASPM的表达差异
2.2 肺癌组织ASPM表达与临床病理学指标的关系
通过筛选TCGA 数据库中肺腺癌患者RNAseq 2GeneNorm 表达数据和相关临床数据,得到具有完整资料的腺癌病例470 例。采用卡方检验分析ASPM mRNA 表达与临床相关指标如年龄(≤65 岁,>65 岁)、性别、吸烟史、T 分期、N 分期相关性。结果显示,ASPM mRNA 表 达 与 年 龄(P=0.034)、性 别(P=0.026)、吸烟史(P=0.016)、T 分期(P=0.003)相关,即ASPM mRNA在≤65岁、男性、有吸烟史及T2~4期的人群中表达量高,与N分期(P=0.327)无明显相关,见表1。
2.3 ASPM mRNA 表达水平与肺腺癌患者生存期的关系
对470 例肺腺癌病例采用Kaplan-Meier 法及logrank 检验分析,结果显示ASPM mRNA 表达水平高的肺腺癌患者的生存期短(P=0.002),见图2。对影响因素进行单因素分析显示年龄、性别、吸烟史与患者的生存期无明显关系(P>0.05),而T 分期(P=0.004)、N 分期(P<0.01)与患者生存期相关,即T分期、N分期越晚总体生存率越低;进一步Cox 分析结果显示N 分期[HR=2.313,95%CI(1.696,3.154),P<0.01)]、ASPM表达水平[HR=1.521,95%CI(1.114,2.076),P=0.008]均为影响肺腺癌预后的独立危险因素。见表2。

表1 ASPM mRNA表达与临床病理参数相关性

图2 生存曲线ASPM高低表达组的生存曲线

表2 肺腺癌患者生存期预后影响因素的单因素和多因素分析
2.4 ASPM mRNA高低表达组间差异基因
将470 例肺腺癌患者按照ASPM mRNA 表达水平分为高表达组和低表达组,使用R 语言中ballgown 及ggplot软件筛选出差异基因183个,其中上调倍数≥1.3倍的有97 个,下调倍数≤0.8 的有86 个,P<0.01,根据上述数据构建差异基因火山图(图3),列出其中表达差异最大的前10个基因(表3)。

图3 差异基因的火山图
2.5 GO功能富集分析
利用DAVID 6.8软件对183个差异基因进行GO富 集分析(数目≥4,P<0.05),将差异基因分为BP、CC和MF 3 个亚类(图4)。在生物过程方面主要富集于蛋白质分解、细胞信号转导、细胞蛋白质代谢过程、氧化应激反应等,在细胞组分方面,主要富集于细胞外间隙、细胞外区、细胞表面、蛋白质细胞外基质、核小体等,分子功能方面差异基因主要富集于钙离子结合、丝氨酸型内肽酶活性、激素活性、蛋白质结合桥接、钙依赖性蛋白结合方面。
2.6 ASPM相关信号通路富集分析
按照ASPM mRNA 的表达量分为高表达组和低表达组,进行GSEA 分析发现有18条通路出现有意义富集(表4),|NES|>2 的富集通路有7 条(图5),主要集中于卵母细胞减数分裂、细胞周期、孕酮介导的卵母细胞成熟、p53 信号通路、同源重组、一碳代谢及DNA复制。

表3 表达差异最明显的前10个基因

图4 GO功能富集分析

表4 KEGG信号通路富集分析
2.7 构建蛋白质相互作用网络并筛选关键基因
通过STRING 在线工具对差异基因进行分析,以综合评分(high confidence)大于0.7 作为筛选标准构建PPI网络图(图6)。随后将STRING获取的节点数据导入Cytoscape 软件中使用CytoHubba 插件筛选出关键基因4 个(图7),分别为丝酶抑制蛋白家族D1 成员(serpin family D member 1,SERPIND1,MNC=7),纤维蛋白原β链(fibrinogen beta chain,FGB,MNC=7),纤维蛋白原α链(fibrinogen alpha chain,FGA,MNC=9),纤维蛋白原γ链(fibrinogen gamma chain,FGG,MNC=9)。
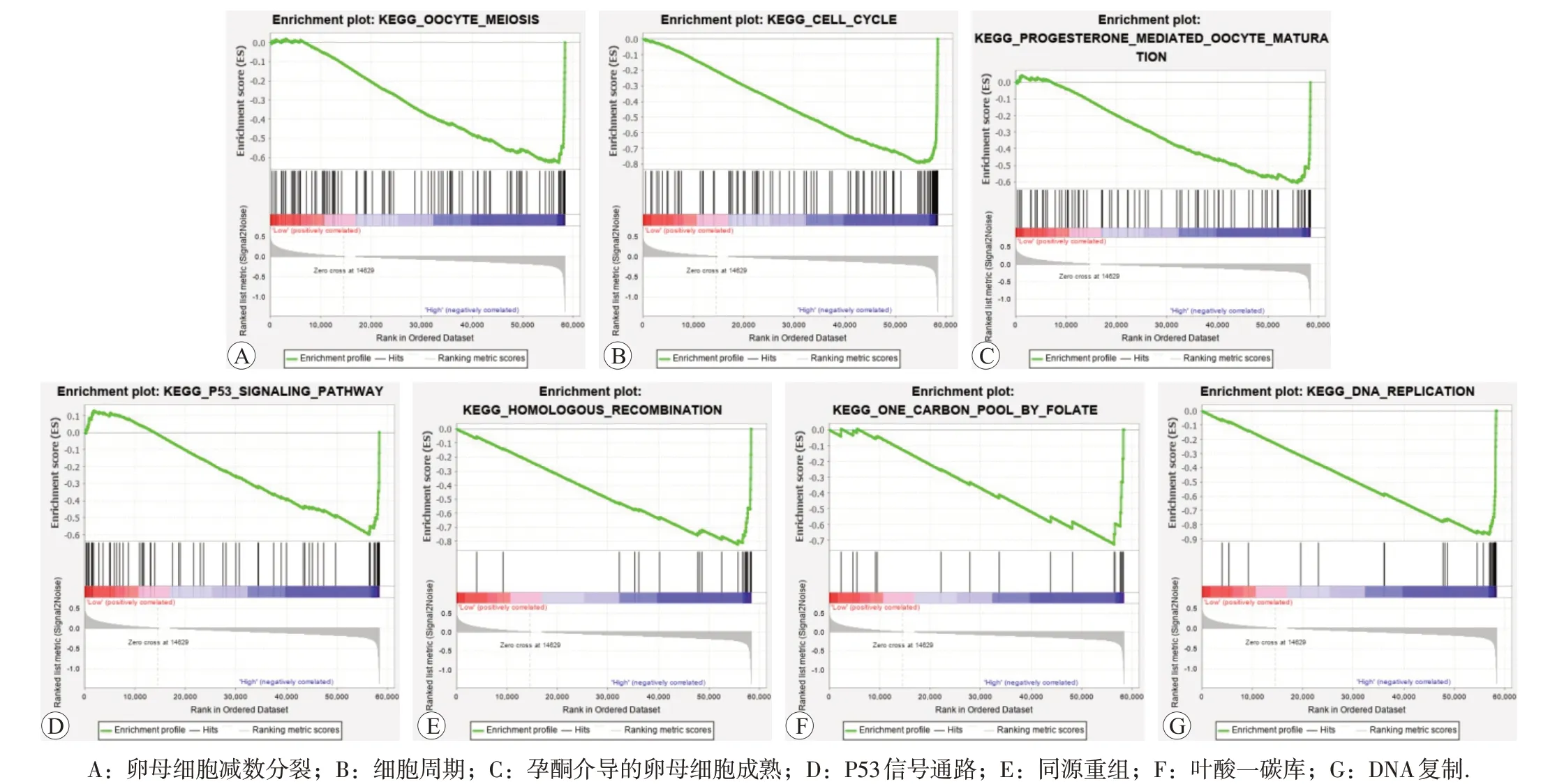
图5 GSEA富集KEGG pathway基因集

图6 差异表达蛋白的相互作用

图7 蛋白相互作用中的关键基因
3 讨 论
肺癌是全世界范围内发生率和死亡率最高的肿瘤,按病理可分为小细胞和非小细胞肺癌两大类,其中85%以上都是非小细胞肺癌。尽管目前药物和手术方式上都有了很大进展,但由于缺乏早期症状且转移风险高,多数患者确诊时已处于晚期,5 年生存率低于15%[6]。肺腺癌属于非小细胞肺癌一种,是原发性肺癌中发生率最高的亚型,占到全部肺癌病例的40%且呈现持续上涨的趋势[7]。多数肺癌患者确诊时已进入进展期或者出现远处转移,失去了手术机会,放化疗等成为主要的治疗方式。肿瘤的发生发展是一个复杂的过程,包括原发部位脱落、细胞外基质降解、侵犯周围组织、进入血液及淋巴系统并最终形成一个新的病灶[8],涉及的机制众多,常见的包括细胞周期、细胞凋亡、细胞自噬、免疫逃避及细胞信号转导等[9],而发现新的分子标记物能够让肿瘤诊断窗口期前移,增加肿瘤患者手术治疗机会,并能更准确评估患者预后。
本研究通过分析TCGA 数据库中肺腺癌和癌旁组织临床资料及mRNA 表达谱数据,发现ASPM mRNA在肺腺癌组织中表达显著上调,其表达水平与年龄、性别、吸烟史、T 分期相关,进一步生存分析发现ASPM mRNA 表达水平、N 分期及T 分期与肺腺癌预后显著相关,且ASPM mRNA 高表达组患者总体生存率显著下降。进一步的多因素生存分析显示ASPM 高表达是肺腺癌预后不良的独立危险因素,可作为判断肿瘤预后的标志物。
ASPM基因位于人类染色体1q31,编码3 477 个氨基酸(蛋白410 kDa),由1个潜在的微管结合结构域氨基末端、2个钙调蛋白同源结构域、81个异亮氨酸-谷氨酰重复序列和1 个未知功能的羧基末端组成,ASPM 蛋白以剪接异构体的形式存在,包括124、164、218、250 和410 kDa,其中250 和410 kDa 富集于中心体和中间体,提示这两种形式的剪接异构体是ASPM蛋白的主要功能形式[10]。
最早发现ASPM 是参与神经系统发育和脑体积增大中的关键蛋白[11],主要参与纺锤体的调节进而在有丝分裂过程中发挥作用,该基因突变会导致常染色体隐性原发性小头[12]。随着研究的深入,发现ASPM是一种干细胞标记物[13],并且在多种肿瘤细胞中高表达,如胶质瘤、胰腺癌、卵巢癌和肝细胞癌组织[14-16]。在胶质瘤中,ASPM 在肿瘤组织中表达升高[17],结果在体外实验和大鼠成瘤实验得到进一步验证,且ASPM 的表达水平与肿瘤的分期和复发率密切相关,其可能机制是影响肿瘤干细胞的扩增。在胰腺导管腺癌中,Xiong等[18]研究者通过RT-PCR方法证实ASPM 在癌组织中高表达,且与肿瘤进展密切相关。在前列腺癌中,Pai 等[19]研究发现ASPM 可能通过激活Wnt 信号通路促进前列腺肿瘤进展。ASPM 首先与通路上游Dvl-3 相互作用增加β-catenin 稳定性并抑制其降解,使细胞内β-catenin 浓度增加,通过Wnt-Frizzled-Dvl3-βcatenin 信号传导方式促进下游靶基因表达,敲低ASPM 后则相应出现侵袭增殖能力、克隆形成能力以及肿瘤细胞干性和成瘤能力的下降,由此可见ASPM 能够促进前列腺癌进展。在侵袭性乳腺癌中,Shubbar等[20]研究发现只有ASPM和Cyclin B2与其相关存活率和临床病理参数有关,两者共同参与乳腺癌发生、发展,推测参与细胞周期调控有关,但详细作用机制尚未阐明。
本文通过GO 分析发现ASPM 广泛分布在细胞表面、胞质内及细胞核中,可能通过桥接作用、丝氨酸磷酸化等机制,参与蛋白质分解、细胞间信号传导等方面参与肿瘤的发生发展,通过PPI 网络图,本研究发现了与ASPM 有密切作用的4 个蛋白(SERPIND1、FGB、FGA、FGG),并分析了KEGG 信号通路,发现ASPM 参与的机制众多,主要集中于细胞分化的早期阶段,如DNA 复制、减数分裂及细胞周期等,提示ASPM 可以通过多个方面的分子机制共同促进肿瘤发展。
综上所述,本研究利用生物信息学方法分析ASPM mRNA 在肺腺癌组织中高表达且与患者总体生存率呈负相关,是肺腺癌的一项新的独立预后指标,SERPIND1、FGB、FGA、FGG 4 个蛋白是ASPM 起作用的关键分子,通过影响细胞发育的早期阶段来促进肺腺癌进展,这些可以作为肺腺癌的潜在诊断和治疗靶点。本研究局限性在于仅基于公共数据库所提供的mRNA 表达水平分析,缺乏足够的临床样本及细胞、动物实验支持,本课题组后续将通过相关实验研究进一步探索ASPM 在肺腺癌中的具体机制,为肺癌的诊断和治疗提供一个新方向。

