也谈化学反应中的量变与质变
沈乐文
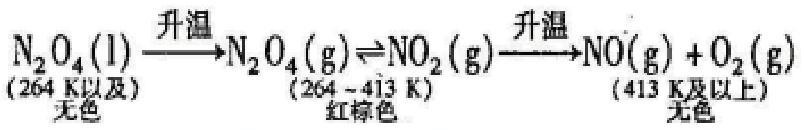
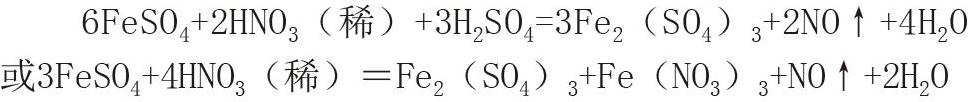
量变引起质变是事物变化的基本规律之一。在中学化学反应中,由于反应物所处温度、浓度等因素的量变引起化学反应质变的例子很多,教师在教学过程中充分利用和挖掘这部分课程资源,从辩证唯物主义的角度,教给学生分析和认识问题,这对学生的发展是非常必要的。然而,教学中有少数教者对有些反应的本质尚未认识清楚,教学中出现了一些偏差,现列举几例,予以澄清。
一、给N2O4加热,并非温度越高气体颜色(红棕色)越深
我们知道:红棕色气体NO2分子易聚合生成无色的N2O4分子,通常情况下存在如下化学平衡:2NO2(g) N2O4(g);NO2的体积分数约占15%。当温度降至264K(N2O4的熔点)时,N2O4(g)N2O4(l);此时NO2几乎全部转变成无色液态N2O4(约有0.7% NO2)溶于液态N2O4之中,致使液体微显黄色)。关于温度对平衡移动的影响,高中教材是以此反应现象的变化为例,分别做了演示实验和学生实验。即升高温度N2O4由液态变为气态,继续升高温度时(温度量变),N2O4开始分解(产生质变)。实验表明:随着温度升高(由冰水至常温,由常温至沸水的三个对比实验),氣体颜色逐渐加深。由此有人认为:在“N2O4(l)2NO2(g)”的转化过程中,温度升高与颜色加深呈正比关系。其实,这种认识是错误的。当温度升高至413K时,体系中新的质变又开始了,NO2在此温下发生分解反应:2NO22NO+O2,并随着温度升高,反应速率加快,分解程度变大,气体颜色则逐渐变浅,直至无色。由此看,给液态N2O4加热,随着温度的量变,化学反应发生了两次质的变化,伴随的现象是:气体颜色由无色到红棕色再到无色。反应过程中温度的量变与化学反应的质变关系如下:
二、向一定量热的浓硝酸中加入足量的铁粉,随反应进行硝酸还原产物不仅只是NO2、NO,还有更低价态的还原产物
铁与冷的浓硝酸反应后表面生成了一层致密氧化膜阻止了反应的继续进行。但向一定量热的浓硝酸中加入足量的铁屑,反应可持续进行下去,随着硝酸浓度的减小,硝酸还原产物除NO2、NO外,还有N2O、NH4+等。当硝酸浓度很大时(69%),还原产物为NO2;随着反应的进行,硝酸浓度减小变为稀硝酸时,其还原产物为NO;当硝酸浓度继续减小变为很稀硝酸时,其还原产物为N2O;当硝酸浓度减小到极稀时,其还原产物为NH4+;当硝酸全部反应完后,过量的铁将生成的硝酸铁还原为硝酸亚铁。整个过程中随硝酸浓度的量变,其化学反应的质变主要经历了五个阶段。
值得注意的是,硝酸浓度量变与化学反应质变没有绝对的浓度界限,两种反应并存于同一过渡浓度之中是有可能的,因此浓度的划分是相对的,在某一浓度范围内,发生哪一种化学反应也不是绝对的。
三、向FeSO4溶液中滴入几滴浓硝酸,硝酸的还原产物只能是NO
某教材中有这样的一个实验:向试管(图1)中加适量铁粉,再加约5mL稀硫酸,待反应完成后(铁粉略过量),取上层清液分别加入两支试管中,在一支试管中加入2滴KSCN溶液,观察现象;在另一试管中先加入几滴浓硝酸,振荡后再加入2滴KSCN溶液,观察现象。教材随后解释了现象产生原因,所写化学方程式为:2FeSO4+2HNO3(浓)+H2SO4=Fe2(SO4)3+2NO2↑+2H2O
这是一个典型孤立、静止看问题的错误,几滴浓硝酸滴入到至少有2mL的稀FeSO4的溶液中,硝酸浓度已稀释了二十几倍,事实上变成了稀硝酸,硝酸浓度的这种量变必然是导致化学反应的质变,即硝酸的还原产物不是NO2,应为NO,其正确的化学反应方程式为:
这种错误对学生的误导是严重的。
四、向一定量的浓硫酸中加入足量锌粒,反应过程中不存在硫酸浓度的量变引起化学反应的质变
很多教辅资料认为:向盛有一定量浓硫酸的试管是加入足量锌粒,反应过程中存在硫酸浓度的量变引起化学反应的质变,即开始反应时浓硫酸表现出强氧化性,其反应为:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O;随着反应进行,硫酸不断消耗和水的生成,硫酸浓度减小变为稀硫酸,此时稀硫酸不具强氧化性,锌与稀H2SO4发生置换反应:Zn+H2SO4(稀)=ZnSO4+H2↑。
其实这种认为是不符合客观实际的,是在片面地看问题。如果亲自动手做此实验就会发现:过量的锌粒与浓硫酸开始反应时就很缓慢,表面只有少量气泡产生,随后有白色物质沉积在锌粒表面,反应进一步减慢,一会儿后反应便自动停止了。这是因为生成的ZnSO4容易吸收水分子形成ZnSO4·7H2O,反应过程中每生成一个ZnSO4时只产生了两个H2O分子,其结晶水合物还只能是ZnSO4·2H2O,因此,反应过程中生成的水根本不会使浓硫酸浓度发生实质性改为;此外生成的ZnSO4·2H2O难溶于浓硫酸中,致使锌粒表面不断被生成的ZnSO4·2H2O覆盖,阻止了反应的继续进行,因而导致了反应的最终停止。
事实证明,该反应过程不存在硫酸浓度的量变引起化学反应的质变问题。我们绝对不能把一个不存在的问题编制成为一个练习题让学生做。
的确,高中化学教材中蕴含十分丰富的辩证唯物主义教育内容,为我们在教学过程中有机渗透辩证唯物主义思想提供了鲜活的素材,这对学生的持续发生是大有裨益的,特别是对当前高中过早分文科、理科尤为必要。但值得注意的是,渗透教育过程中所依托的知识内容一定要具有科学性,涉及实验题材的内容教者一定要亲自动手做实验,然后再指导学生做探究实验,让学生在实验过程中发现量变引起质变的存在,从而真正领会质量互变规律是事物变化的基本规律之一,是人们认识事物变化的基本方法。只有这样才能在知识与技能、过程与方法、情感态度与价值观的等方面使学生充分得到发展。

