直立型扁蓿豆对干旱胁迫和复水的响应及适应策略*
乌日娜, 石凤翎, 徐 舶
直立型扁蓿豆对干旱胁迫和复水的响应及适应策略*
乌日娜, 石凤翎**, 徐 舶
(内蒙古农业大学草原与资源环境学院/草地资源教育部重点实验室(内蒙古农业大学) 呼和浩特 010000)
以直立型扁蓿豆[(L.) Sojak. cv. Zhilixing]为材料, 于苗期连续干旱处理12 d后复水4 d, 研究直立型扁蓿豆幼苗形态结构特征、生理代谢及生物量分配对干旱胁迫及复水的响应, 揭示直立型扁蓿豆对干旱胁迫及复水的适应策略。结果表明: 随着干旱胁迫时间延长, 直立型扁蓿豆叶片气孔开放率逐渐降低, 处理9 d后气孔及表皮细胞密度比正常浇水处理(CK)分别增加48.5%和36.6%, 形成小而密的表皮细胞和气孔。生理上, 除MDA含量随胁迫时间的延长逐渐增加外, 其余指标均先升高后降低, 干旱胁迫9 d时达最高, SOD、POD、叶绿素、可溶性糖、可溶性蛋白及脯氨酸分别较CK提高88.9%、111.2%、86.7%、140.5%、147.8%和124.6%。同时, 生物量随胁迫时间的延长先增大后减小, 于干旱胁迫9 d达最大值, 比CK增加16.4%, 总的分配格局表现出地上生物量投资高于地下, 地下生物量投资比例随胁迫时间的延长逐渐增加, 而地上生物量变化与其相反。复水后各指标均能恢复至CK水平或超过CK, 表现出极强的复水敏感性和潜在恢复能力。该品种扁蓿豆对干旱胁迫及复水的适应主要分为3个时期: 主动适应期, 其生理参数的可塑性指数为形态参数的1.33倍, 主要通过抗氧化及渗透调节来减少水分散失增加水分吸收、缓解氧化伤害以适应干旱逆境; 被动适应期, 其形态参数的可塑性指数为生理参数的1.31倍, 主要采用牺牲生物量的生存策略以及降低色素含量减少光吸收的光保护机制来提高逆境下的生存能力; 复水恢复期, 根冠比、气孔开放率、气孔及表皮细胞密度比CK分别增加25.9%、29.7%、24.2%和16.3%, 其较高的根冠比和叶片较高的气孔开放率及小而密的气孔及表皮细胞特征, 保证了直立型扁蓿豆吸水能力以及水分运输效率的迅速恢复。综上, 直立型扁蓿豆抗旱能力较强, 能够通过形态生理的改变以及调整不同器官的生物量分配来应对与适应干旱逆境及复水, 且在不同处理阶段采取不同的适应策略以达到生存目的。
直立型扁蓿豆; 干旱胁迫; 复水; 形态; 生理; 适应策略; 叶片表皮细胞; 气孔密度
我国干旱胁迫对农牧业生产造成的损失巨大, 因此, 研究植物对干旱的形态生理响应和适应策略极为重要。植物对干旱的适应体现在2个方面, 一方面是干旱胁迫下的生存能力, 另一方面是复水后迅速恢复的能力[1]。干旱胁迫和复水条件下, 植物会在生长、形态及生理生态特征上进行调整, 植物叶片的形态结构、生物量积累与分配以及生理代谢等均会受到影响而发生一系列的适应性变化。
扁蓿豆[(L.)]是一种生态适应性广、抗旱、抗寒、耐盐碱的豆科草本植物, 广泛分布于我国北方地区, 在黑钙土、栗钙土和中度盐碱土上均能良好生长[2-3], 可以用于建植人工草地、改良天然草地、防风固沙及水土保持, 对于恢复盐碱环境具有较高的利用价值[4-5]。同时, 其营养价值高, 适口性好, 与苜蓿(L.)相比不含皂素, 家畜过量采食不会发生鼓胀病, 是一种优质的蛋白质饲料, 但其茎斜卧且草产量和种子产量均较苜蓿低, 限制了扁蓿豆的开发利用。因此, 培育草产量及种子产量高的扁蓿豆品种以满足生产需求, 对生态建设和畜牧业发展均具有重要的现实意义。而由内蒙古农业大学利用多次混合选择法培育而成, 并于1992年12月审定通过登记为育成品种的直立型扁蓿豆[(L.) Sojak. cv. Zhilixing]除具有饲用价值高、抗性较强等优良特性外, 相比野生型扁蓿豆, 该品种还具有较高的草产量和种子产量[6-10], 且植株直立便于打草刈割利用。该品种耐旱、抗寒、耐瘠薄、耐风沙、耐盐碱, 水分利用效率高, 青绿期可达180~200 d, 适合北方干旱寒冷地区栽培利用。石凤翎等[7]对其抗旱形态解剖结构进行了观察分析, 发现其叶片为长椭圆形, 边缘锯齿状, 上表皮疏被短柔毛, 而下表皮毛较上表皮多。气孔下陷程度较苜蓿深, 且气孔密度、栅栏组织与海绵组织排列的紧密程度以及栅栏组织的层数较苜蓿高, 利于光合作用, 在干旱时能够阻止水分蒸散。其叶脉也较苜蓿明显且密集, 输导组织发达, 胞间隙小, 从形态解剖学上分析证实直立型扁蓿豆较苜蓿更为抗旱。此外, 李鸿雁等[8]将扁蓿豆与其他抗性较强的豆科牧草进行比较, 发现叶片的栅栏组织和海绵组织厚度、栅栏组织结构紧密度以扁蓿豆最高, 其抗旱性能不仅优于苜蓿, 也强于百脉根(L.)、黄花苜蓿(L.)、二色胡枝子(Turcz.)、野火球(L.)等抗性优良的牧草。
直立型扁蓿豆所具备的上述优良特性使其可以作为育种的优质亲本用于苜蓿品种抗性改良及苜蓿新品种培育。Shu等[11]对5种非生物胁迫(ABA、盐胁迫、渗透胁迫、4 ℃、-8 ℃)下的直立型扁蓿豆进行转录组测序, 鉴定出2 721个非生物应激反应基因, 可以为利用基因工程改良苜蓿属牧草及其他牧草抗逆性的研究提供优质基因资源。因此, 对直立型扁蓿豆的研究及开发利用具有极其重要的意义。然而近年来, 对直立型扁蓿豆的研究多集中在组织培养、引种及多倍体诱导, 仅有少数学者对直立型扁蓿豆的抗旱性进行研究, 主要在筛选抗旱鉴定指标并与其他材料进行抗旱性比较方面[12-13], 鲜有学者对不同程度干旱胁迫及复水条件下直立型扁蓿豆形态解剖结构、生理代谢及生物量分配规律进行研究。因此, 本研究拟通过对直立型扁蓿豆幼苗在不同干旱胁迫强度及复水处理下的形态结构、生物量积累与分配以及生理代谢等方面的阶段性变化进行研究, 了解该品种扁蓿豆对干旱逆境及复水的形态及生理响应, 并进一步探讨直立型扁蓿豆应对干旱胁迫及复水的阶段性响应策略, 为提高苜蓿的抗旱性提出新的思路, 也为干旱半干旱地区草产业发展和区域植被建设提供理论支撑。
1 材料与方法
1.1 试验材料
直立型扁蓿豆种子采集于内蒙古农业大学牧草试验地(2008年)。该品种为轴根型, 根系发达, 入土深度可达2 m以上, 主根不明显, 茎直立, 高90~110 cm, 分枝多, 每株分枝数平均30~50个。叶量大、开花整齐、饲草品质好、产草量高, 每公顷鲜草产量37 500~45 000 kg, 种子产量150~180 kg。比野生种增产50.6%, 种子硬实率由30%~60%下降至10%左右。
1.2 试验处理
挑选饱满、均匀一致的种子进行试验, 由于扁蓿豆种子存在硬实现象, 所有种子均用浓H2SO4浸泡5~8 min, 在20 ℃恒温条件下进行萌发, 发芽率87%, 待种子发芽后移入育苗盘(32穴盘, 上口径58 mm, 底部20 mm, 深度110 mm)。每穴播种2粒, 种植基质为购自中顺园林机械公司的有机营养土。将育苗盘放置于温室中, 湿度43%, 温度25 ℃。苗期每天光照12 h, 定期定量供水。待幼苗生长到6~8叶期时进行连续干旱胁迫处理, 干旱处理前浇足水。试验分为两组: 对照(CK)组保持正常浇水; 处理组不浇水, 连续干旱胁迫处理12 d幼苗叶片发生萎蔫变黄脱落后开始复水, 给予充分水分, 复水4 d后植株恢复正常生长。CK组和处理组均设3个重复。
1.3 测定指标及方法
1)生理生化指标测定方法
分别于干旱胁迫9 d、12 d及复水4 d的上午10:00对CK、干旱胁迫处理的植株取样, 每个处理30株, 每株取第4或5片完全展开叶片, 共获得12个样品。用于测定叶绿素、可溶性糖、可溶性蛋白、脯氨酸、丙二醛(MDA)含量及超氧化物歧化酶(SOD)、过氧化物酶(POD)活性。参照李合生[14]的方法测定各项生理指标。其中, 叶绿素用无水乙醇提取, 可溶性糖采用苯酚法测定, 可溶性蛋白采用考马斯亮蓝染色法测定, 游离脯氨酸采用酸性茚三酮法测定, MDA采用硫代巴比妥酸法测定, SOD活性采用NBT光化还原法测定, POD活性采用愈创木酚法测定。
2)扫描电镜观察叶片方法
按上述方法选取长势一致的第4或第5片完全展开叶迅速投入2.5%戊二醛固定液中, 用日立S-3400N型扫描电镜放大400~3 000倍观察叶片表皮形态, 测定其形态指标。
气孔长宽: 每个样品随机选择30个气孔, 测定气孔横轴及纵轴。气孔密度: 每个样品各选取3个单位面积, 统计气孔数量, 换算1 mm2气孔个数, 求均值。气孔开放率: 单位面积开放数/单位面积总个数。表皮细胞长宽: 每个样品随机选择10个表皮细胞, 测定细胞长宽。表皮细胞密度: 每个样品各选取3个单位面积, 统计表皮细胞数量, 换算1 mm2表皮细胞个数, 求均值。
3)各处理单株生物量测定
取CK、干旱胁迫9 d、12 d及复水后4 d的苗期植株各15株, 共12个样品, 测定其总生物量、地上生物量、地下生物量及根冠比。
各指标(参数)可塑性指数(plasticity index, PI)=[(不同处理下某参数的最大值-最小值)/最大值][15](1)
1.4 数据处理
利用Excel 2016对数据进行整理, 利用SPSS 19.0进行单因素方差分析。
2 结果与分析
2.1 干旱胁迫及复水条件下直立型扁蓿豆幼苗叶片表皮及气孔特征变化
由图1A和图2A可知, 叶片上表皮细胞密度随着干旱胁迫时间的延长先升高后降低, 复水后恢复并超过CK, 各处理之间差异显著(0.05)。叶片下表皮细胞密度随着干旱胁迫时间的延长逐渐降低, 在干旱胁迫12 d时叶片下表皮细胞密度大幅降低, 复水后恢复至CK水平(图1A和图2B)。干旱胁迫9 d时, 上表皮细胞密度比CK增加36.6%。随着胁迫时间的延长, 上下表皮细胞均破裂干瘪, 密度降低, 分别比CK减少52.3%和29.4%。复水后细胞恢复生长, 使上下表皮细胞密度分别比CK增加16.3%、3.1%。此外, 相比于叶片下表皮, 上表皮对干旱的反应更灵敏, 除干旱胁迫12 d外, 其余各处理上表皮细胞密度均显著高于下表皮(0.05), 且上表皮的变化幅度大于下表皮。

图1 不同处理条件下直立型扁蓿豆幼苗叶片表皮细胞及气孔
CK为正常水分处理; 9d和12d为干旱胁迫9 d和12 d, Rewater为复水后4 d。不同小写字母表示CK及各处理间差异显著(0.05), *表示上下表皮间差异显著(0.05)。CK is the control of normal water condition. 9d and 12d are 9 and 12 days of drought stress. Rewater is rehydration for 4 days after drought stress. Different lowercase letters indicate significant differences among CK and different treatments at<0.05 level. * indicate significant difference between epicuticle and lower epidermis at<0.05 level.
由图1B、1C和图2A、2B可知, 上表皮细胞长度和宽度在干旱胁迫条件下逐渐减小, 下表皮细胞变化与其相反, 干旱胁迫及复水处理间没有显著差异。胁迫9 d、12 d, 上表皮细胞长度分别比CK减少22.4%和23.3%(<0.05), 宽度分别比CK减少25.1%和27.2%(<0.05); 下表皮细胞长度分别比CK增加11.5%和12.6%(<0.05), 宽度分别比CK增加13.9%和15.1%(<0.05)。复水后, 表皮细胞长度和宽度没有发生明显变化。除CK上下表皮细胞长度和宽度差异不显著外, 其余处理上表皮细胞长度和宽度均显著低于下表皮(0.05)。
由图1D可知, 上下表皮气孔开放率均随胁迫的加重而减小, 复水后均可恢复, 且上表皮气孔开放率高于下表皮气孔开放率(<0.05)。与CK相比, 胁迫9 d和12 d上表皮气孔开放率降低显著, 分别比CK减少25.9%和57.7%(<0.05)。干旱胁迫9 d上表皮气孔开放率明显下降而下表皮气孔开放率无明显变化, 表明直立型扁蓿豆主要通过上表皮气孔开放率的调节缓解干旱对植株造成的损伤。干旱胁迫12 d表皮气孔开放率降至最低, 能阻止水分蒸散, 保护光合器官, 有利于复水后光合功能的恢复。复水后上表皮气孔开放率恢复至CK水平, 而下表皮气孔开放率比CK增加29.7%(<0.05), 有利于光合恢复。
随着干旱胁迫程度的加深, 叶片上表皮气孔密度先升高后降低(图1E)。与CK相比, 干旱胁迫9 d, 气孔密度增加48.5%, 干旱12 d, 叶片受到严重影响, 气孔密度降至CK水平。复水后, 叶片恢复生长, 上表皮气孔密度显著增加24.2%。下表皮气孔密度在各处理之间无显著差异。上表皮气孔密度显著高于下表皮。
由图1F和图1G可知, 叶片上表皮气孔长度和宽度在干旱胁迫及复水条件下显著降低(<0.05), 而相互间无显著差异。相比CK, 胁迫9 d、12 d及复水条件下, 上表皮气孔长度分别减少17.8%、24.2%和20.1%(<0.05), 上表皮气孔宽度分别减少13.0%、14.1%和12.6%(<0.05)。胁迫12 d和复水4 d, 下表皮气孔长度分别比CK减少11.2%和9.76%(<0.05), 宽度分别比CK减少9.3%和7.1%(<0.05)。胁迫9 d时下表皮长、宽度与CK处理差异不显著。表明干旱胁迫造成气孔缩短, 即使复水也不再伸长。除CK外, 其余处理下表皮气孔长度和宽度均明显高于上表皮(<0.05)。

图2 不同处理条件下直立型扁蓿豆幼苗叶片上表皮(A)和下表皮(B)的显微结构
2.2 干旱胁迫及复水处理条件下直立型扁蓿豆幼苗生理指标的变化
干旱胁迫下, 除MDA含量不断升高外, 其余生理指标均随着干旱胁迫时间的延长先升高后降低, 复水4 d后能够恢复(表1)。水分胁迫导致叶绿素合成受阻, 叶绿素a、b、a/b及叶绿素总量在干旱胁迫第9 d达最大值, 分别比CK增加103.6%、48.9%、37.3%和86.7%。随着干旱胁迫时间的延长, 叶绿素合成受到的阻力增强或分解加速, 导致干旱胁迫12 d叶绿素a、b、a/b及叶绿素总量分别比CK减少20.5%、13.3%、7.7%和19.0%, 其中叶绿素b含量相比于另外三者变化幅度较小。说明叶绿素总量及a/b的变化主要由叶绿素a的变化引起。复水后叶绿素a、b、a/b及叶绿素总量均恢复至对照水平。干旱胁迫下, 植物为消除体内过氧化物的积累, 使SOD及POD活性在胁迫第9 d达最大值, 分别较CK提高88.9%和111.2%。此后随着时间的延长, 抗氧化酶活性逐渐降低, 并在胁迫第12 d降至最低且分别比CK减少26.6%和43.4%。复水4 d后, 叶片SOD及POD活性逐渐恢复至CK水平。为抵御干旱逆境, 植物体内大分子物质分解, 叶片可溶性糖、可溶性蛋白及脯氨酸含量在胁迫第9 d显著增加到最大值, 分别比CK增加140.5%、147.8%和124.6%。随着时间的延长, 植物功能遭到破坏, 物质含量在胁迫第12 d显著降低, 分别比CK减少40.5%、45.2%和31.5%。随着复水时间的延长, 叶片可溶性糖、可溶性蛋白及脯氨酸含量恢复至CK水平。干旱胁迫12 d, MDA含量迅速增加, 比CK增加126.4%。复水后MDA含量下降, 仍高于CK。

表1 干旱和复水条件下直立型扁蓿豆生理指标的变化
同行不同小写字母表示不同处理间在<0.05水平差异显著。Different lowercase letters indicate significant differences at 0.05 level among different treatments.
2.3 干旱胁迫及复水处理对扁蓿豆幼苗生物量积累与分配的影响
不同干旱胁迫强度下扁蓿豆生物量积累发生明显改变(表2)。干旱胁迫9 d, 同化物增加了向根部的分配以增强植物对水分及养分的吸收能力, 用以地上部分的生长, 使得总生物量、地下生物量和地上生物量均显著增加(<0.05), 分别比CK增加16.4%、27.5%和11.9%。干旱胁迫12 d, 随着胁迫的增强, 总生物量下降,显著低于胁迫9 d。地上生物量虽然比CK减少5.80%, 但地下生物量比CK增加38.6%,涨幅较大,因此其单株生物量仍高于CK。复水后, 总生物量、地下生物量和地上生物量显著增加, 分别比CK增加24.8%、46.3%和16.2%。
干旱胁迫9 d, 地上生物量比重降低而地下生物量比重升高, 导致根冠比显著增加(<0.05), 比CK增加13.9%, 这表明地下生物量的增长幅度大于地上, 总生物量的增长主要由地下生物量的增加所致。干旱胁迫12 d, 地上生物量比重较CK减少12.0%, 而根冠比及地下生物量比重明显增加, 分别比CK增加47.2%和29.5%, 表现出较强的同化物分配能力。复水后, 地上生物量比重比CK减少6.92%, 地下生物量比重和根冠比分别比CK增加17.24%、25.9%。地上、地下生物量比重及根冠比在干旱胁迫下发生明显变化, 表明严重的干旱胁迫会对生物量的分配产生影响。
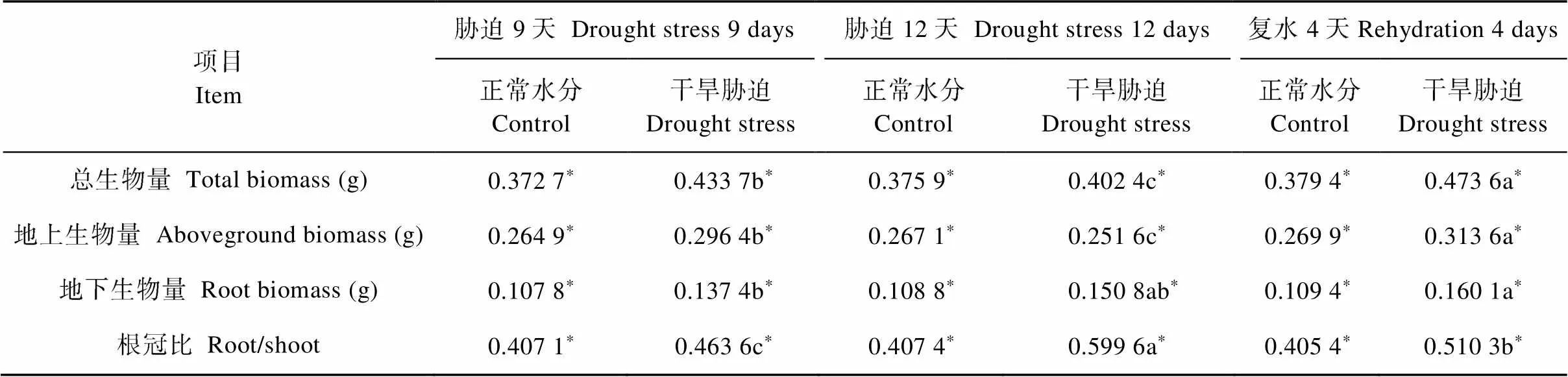
表2 干旱和复水条件下直立型扁蓿豆生物量分配
不同小写字母表示不同胁迫天数之间差异显著,*表示不同处理与其对照间差异显著(<0.05)。Different lowercase letters indicate significant differences at 0.05 level among different days of stress. * indicate significant differences between control and stress treatments on the same day at<0.05 level.
2.4 干旱胁迫对直立型扁蓿豆形态及生理参数可塑性指数的影响
干旱胁迫9 d, 生理参数可塑性指数均值为形态参数的1.33倍(表3)。生理参数中, 以SOD、POD及脯氨酸的可塑性指数值最大, MDA及叶绿素的可塑性指数最低, 表明直立型扁蓿豆主要通过调整生理水平的变化适应干旱环境; 在形态参数中, 以气孔密度及开放率的可塑性指数较高, 对该品种扁蓿豆抵御干旱胁迫的作用较大, 而生物量及根冠比的可塑性指数最低, 作用相对较弱。干旱胁迫12 d, 形态参数的可塑性指数的均值大于生理参数, 为生理参数的1.31倍。形态参数中, 以根冠比及生物量的可塑性指数最大, 表明直立型扁蓿豆主要通过生物量的变化来适应该阶段的胁迫; 生理参数中, 以脯氨酸、可溶性糖及可溶性蛋白的可塑性指数最高, 表明在严重干旱胁迫下, 生理代谢调节过程中, 渗透调节系统发挥主要功能, 而抗氧化系统次之。
3 讨论
3.1 直立型扁蓿豆对干旱胁迫及复水的形态及生理响应
大量研究表明, 生境的改变势必会导致叶片形态结构的变化, 其变化特征能很好地体现环境因子的影响或该植物对生境变化的适应能力[16]。本试验中, 干旱胁迫9 d直立型扁蓿豆叶片上表皮细胞及气孔密度均随着干旱时间的延长先升高后降低, 与Fraser等[17]的研究结果一致, 即适度的干旱可增加叶片气孔密度, 而过度干旱则使叶片气孔密度下降。较大的气孔密度有利于短时间内充分利用有效水分进行光合作用, 有助于散热, 可避免热害使叶绿体和原生质体发生变性。与CK相比, 此时的叶片表皮细胞密度增大而细胞长、宽变小, 表明干旱胁迫抑制了细胞的增大而促进了表皮细胞的分裂, 这样的结构增大了细胞的外表面积, 增加了水分蒸发的阻力, 减缓水分散失, 而且较小的细胞可以避免严重脱水时细胞体积变化过大而产生的机械损伤, 叶片的自我保护能力得到提高。同时, 细胞越小, 排列越紧密, 植物的光能利用率越高。至干旱胁迫12 d,扁蓿豆幼苗失水严重导致叶片表皮细胞扭曲起伏重叠及失水破裂, 气孔形成受到抑制, 导致表皮细胞及气孔密度的下降。然而, 也有气孔密度随着干旱胁迫程度的增加而增加的情况, 如赤皮青冈[(Blume) Oerst]幼苗[18], 这可能是由于试验设置的干旱胁迫未能达到破坏植物细胞的程度。另外, 研究结果显示, 干旱胁迫下, 受旱时间不一, 均造成直立型扁蓿豆气孔器变短, 长、宽减小, 抗旱性增强, 与砂生槐[(Benth.) Baker][19]、赤皮青冈[18]等干旱区植物对干旱胁迫的响应一致, 表明直立型扁蓿豆抗旱性较强。本试验中上、下表皮气孔开放率均随着干旱胁迫的加剧逐渐下降, 表明直立扁蓿豆能够通过调节气孔开放率来减少水分散失确保在干旱环境下的生存, 与前人的研究结果一致[20-21]。复水后显著高于CK的表皮细胞及气孔密度、气孔开放率以及显著增加的下表皮气孔开放率, 可能有利于扁蓿豆抗旱能力的提高, 以及光合恢复和植物的补偿性生长。
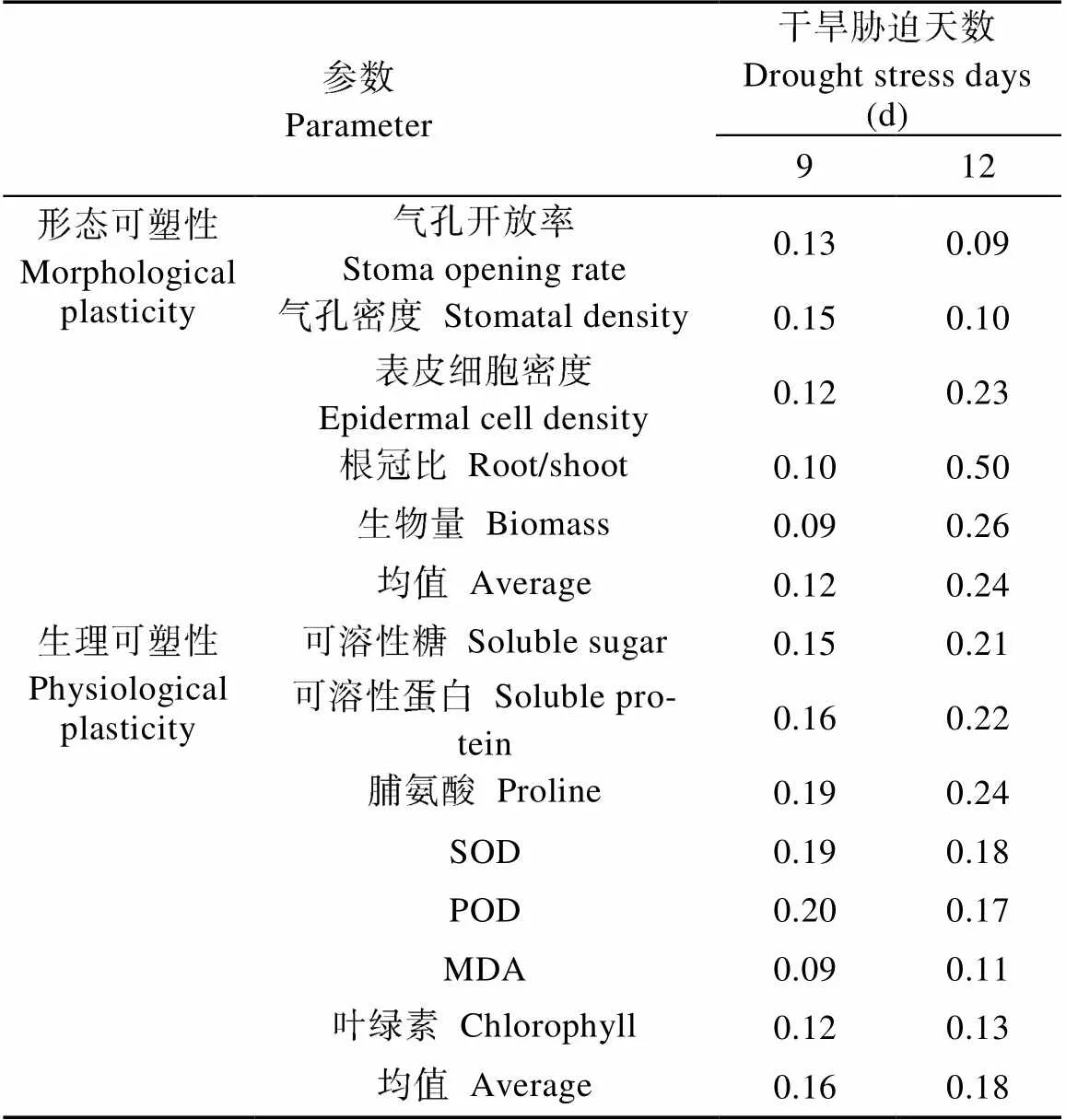
表3 干旱条件下直立型扁蓿豆叶片形态及生理参数的可塑性指数
上、下表皮相比, 上表皮气孔开放率、表皮细胞及气孔密度明显高于下表皮, 与石凤翎等[7]的研究结果一致, 表明上表皮对土壤水分的变化更为敏感, 这可能是由于叶片上表皮受到的光照更多, 更利于水分蒸腾散失。因此, 直立型扁蓿豆主要通过调节上表皮气孔开放率、表皮细胞及气孔密度, 形成小而排列紧密的表皮细胞及气孔, 增强控制气体与水分的进出能力以减少水分散失, 有利于其快速响应环境变化[22-23]。复水后, 与CK相比, 上表皮细胞仍保持小而密的状态, 而下表皮细胞大小仍维持在高于CK的水平, 这样的形态特征可能提高了扁蓿豆的抗旱性, 有利于植物及时应对干旱逆境。直立型扁蓿豆能够以形态的变化来应对与适应干旱环境。
与直立型扁蓿豆叶片气孔长、宽在干旱胁迫下减小的表现不同, 抗旱性强的苜蓿品种叶片气孔的长、宽随着胁迫的持续先增加后减少, 气孔产生疏而大的适应特征, 维持正常生理活动。进一步胁迫后,苜蓿气孔长、宽减小, 但复水后, 气孔保卫细胞吸水, 气孔增大[24]。而直立型扁蓿豆气孔的长、宽在干旱胁迫下减小, 复水后也不再恢复, 表明其为适应干旱环境形成了特定的气孔特征, 与苜蓿相比, 抗旱性更强, 更有利于及时应对再次的逆境胁迫。
植物不仅通过表观形态改变来适应干旱, 渗透调节以及抗氧化酶活性增加也是植物应对干旱的重要途径。本研究结果表明, 干旱胁迫下除MDA外, 其余指标均呈先升高后降低的变化趋势, 表明扁蓿豆幼苗只能在某一特定的干旱时长下通过提高自身抗氧化酶活性、渗透调节物质含量及叶绿素含量来抵御伤害, 与Selote等[25]、Szabados等[26]、Slama等[27]的研究结果一致。胁迫前期(0~9 d), 叶片生长受到抑制, 而叶绿素合成受阻相对较小或分解较少, 活性氧(ROS)的积累以及细胞水解酶类活性的提高使得扁蓿豆幼苗叶绿素含量、抗氧化酶活性及渗透调节物质在干旱胁迫前期升高。同时研究发现可溶性糖及脯氨酸积累愈多, 膜透性增加愈小, 说明除作为渗透调节物质外, 这两者还可以保护和维持膜的稳定性[28-29], 以适应干旱逆境。至干旱胁迫12 d, 抗氧化酶合成受到抑制且降解加快, 导致活性降低, 与前人研究结果一致[30]。渗透调节物质一部分用于维持生命活动的消耗, 一部分向根系运输促进根系对土壤水分的吸收[31]; 同时, 酶活性降低导致自由基大量积累, MDA含量迅速升高[32-33], 膜透性增加, 渗透调节物质大量流失, 上述原因综合导致扁蓿豆叶片渗透调节物质含量在胁迫后期不断降低。此时, 叶片气孔关闭, 阻碍CO2向叶绿体的供应, 影响其生物合成并加速其分解[34], 导致叶绿素含量下降。复水后叶绿素含量、渗透调节物质含量及抗氧化酶活性均能够恢复至CK水平, 表现出较好的复水敏感性和潜在恢复能力。而耐渗透胁迫型的苜蓿复水后其渗透调节物质变化较慢[35], 恢复能力较弱。另外, 本试验中幼苗叶片叶绿素b含量相比于另外3个叶绿素指标的变化并不明显, 说明叶绿素总量和叶绿素a/b的变化主要由叶绿素a的显著变化所引起,与Viljevac等[36]、张丹等[37]的研究结果一致, 表明干旱对叶绿素a的抑制大于对叶绿素b的抑制。
与直立型扁蓿豆相同, 苜蓿[38]、百脉根[39]在干旱胁迫下能够通过增加渗透调节含量以及增强抗氧化酶活性来响应逆境。然而与直立型扁蓿豆抗氧化酶活性先升高后降低的变化趋势不同, 苜蓿SOD活性随干旱胁迫的持续而增强, POD活性则逐渐降低[28], 表明苜蓿抗氧化防御系统中SOD活性发挥主要作用;而在直立型扁蓿豆中SOD、POD均能发挥重要作用。同时, 直立型扁蓿豆叶绿素含量先升高后降低, 苜蓿叶绿素含量下降[40], 难以通过提高叶绿素含量的方式提高其抗旱能力, 这可能是直立型扁蓿豆抗旱性强于苜蓿的原因之一。复水后直立型扁蓿豆渗透调节物质及酶活性均明显减小, 但在百脉根中, SOD、POD和CAT活性仍较对照高, 这表明干旱胁迫使百脉根酶活性增强, 从而提高了百脉根对干旱的适应性, 有利于其再次应对干旱逆境[39]。
干旱胁迫和复水的影响最终由植物的生物量体现, 在资源有限时, 为适应环境变化通常会形成新的生物量分配模式。本研究结果表明, 直立型扁蓿豆总生物量随着干旱胁迫时间的延长先增大后减小,生物量总的分配格局表现出地上部分生物量分配高于地下部分生物量分配, 地下部分生物量投资比例随胁迫的持续而增大。干旱胁迫9 d, 一方面, 直立型扁蓿豆通过降低气孔开放率减少水分散失, 并通过提高气孔密度来增强植物进行气体交换的能力, 进而提高了光合作用速率, 使生物量得以增加; 另一方面, 适度的干旱刺激, 导致生物量及根冠比的显著增加, 表明直立型扁蓿豆通过调整源库关系来适应干旱环境。干旱胁迫12 d, 一方面气孔开放率及气孔密度下降, 干旱对气孔的影响导致净光合产物的减少, 植株生长受到抑制; 另一方面为抵御逆境所带来的伤害, 前期积累的同化产物分解消耗, 导致生物量积累降低, 表明该品种扁蓿豆在严重干旱胁迫下可能通过减少或牺牲生物量的积累, 以更多的资源和能量来应对伤害。与干旱9 d相比, 地上、地下生物量比重及根冠比在该阶段的变化更加明显, 这表明相比于程度较轻的干旱胁迫, 严重的干旱胁迫对生物量的分配比例影响较大。综上, 直立型扁蓿豆的生物量分配在干旱胁迫下可塑性较强[41-42]。与直立型扁蓿豆不同, 干旱胁迫不仅降低了抗性强的苜蓿品种生物量[43-44], 也使红豆草(Scop.)、百脉根、红三叶(L.)、沙打旺(Pall.)、白三叶(L.)等豆科牧草的生物量下降[45]。与沙打旺在土壤水分条件改善后维持较小的根冠比[46]不同, 直立型扁蓿豆响应干旱所形成的特征, 即小而密的气孔及表皮细胞、较高的根冠比在复水后有利于地上部分快速的生长以弥补因胁迫减少的生物量。
3.2 直立型扁蓿豆对干旱胁迫及复水的适应策略
在不同干旱胁迫程度下, 植物的适应策略不同。本试验中直立型扁蓿豆对干旱胁迫的适应主要分为两个时期, 即主动适应时期和被动适应时期。在主动适应时期, 直立型扁蓿豆从维持水分吸收与散失的平衡, 发展到维持ROS产生和清除的平衡; 在被动适应时期, 则从调整源库关系, 发展到调整资源和能量在地上和地下部分的分配比例。
在主动适应时期, 直立型扁蓿豆在形态上除了降低气孔开放率外, 还通过形成小而密的气孔及表皮细胞提高叶片保水力来减少水分散失, 并通过增加气孔密度进行散热, 可避免热害使叶绿体和原生质体发生变性。而苜蓿则通过增大气孔形成大而疏的气孔适应特征来防止水分散失的同时吸收足量的CO2进行正常的光合作用并通过增大气孔散热降温[46]。生理上, 通过提高渗透调节物质含量及保护酶活性来缓解伤害, 降低细胞膜透性, 保护膜结构。在干旱胁迫下降低气孔开放率的同时增加气孔密度, 保证了气体交换, 减轻了对CO2吸收和固定的限制, 使得叶绿素含量升高, 从源头上减少了ROS的产生, 减轻了氧化伤害, 该结果体现了直立型扁蓿豆叶片气孔对干旱胁迫作出的积极响应。与直立型扁蓿豆相同, 苜蓿、百脉根等在干旱胁迫下也采取通过增加渗透调节物质含量以及抗氧化酶活性减小膜系统受损害程度, 增强抗逆性的适应机制, 不同的是其积累量和对逆境的敏感性[46]。此外, 直立型扁蓿豆为获得更多的土壤水分而采取主动适应对策, 进行源库调节, 使光合同化物优先向根系分配, 促进根系生长, 增大根冠比, 有利于植物应对更为严峻的干旱环境。总体来说, 仅依靠形态的改变来减少水分散失、增加水分吸收以及提高保水能力的主动适应策略难以维持水分散失和吸收的平衡, 需启动渗透调节和抗氧化等植物体的主动防御机制以及进行源库调节调整生物量在地上及地下的分配来抑制或修复干旱胁迫造成的伤害, 维持干旱环境下的生长及生理活动。当少数叶片萎蔫变黄, 这预示着直立型扁蓿豆被动适应阶段的开始。
当植物生存受到干旱威胁时, 许多旱生植物会牺牲局部器官来维系生命, 这种方式即为植物的被动适应策略。本研究结果显示直立型扁蓿豆只能在一定范围内通过改变形态结构特征, 提高叶绿素、渗透调节物质含量及抗氧化酶活性来抵御伤害, 当超过这一临界点, 表皮细胞及气孔密度下降, 自身代谢紊乱, 叶绿素分解, 酶活性降低, 膜透性增加, 渗透调节物质外渗, 此时, 其主动防御能力被削弱难以维持植物体内的水分及ROS产生与清除的平衡。主动适应阶段由此结束, 启动被动适应策略。首先, 叶片气孔关闭, 阻碍CO2向叶绿体的供应, 叶绿素合成受阻而分解加速, 减少光吸收实现光保护机制, 与Liu等[47]的研究结果一致。叶绿素降解使碳同化作用停止, 但叶片本身所含的营养物质有利于植株其他部位的存活, 因而直立型扁蓿豆可以将有限的水分和养分用于幼嫩器官或组织来增加存活时间。其次, 积累的同化物进一步分解, 生物量下降, 渗透调节物质发挥的“吸水”作用有限, 更多的是用于保护蛋白及膜结构, 也可作为能量和碳、氮的来源, 便于复水后养分的集中供应, 有利于加速植物恢复进程[48], 此外, 根冠比也进一步增加。综上所述, 在这一阶段, 直立型扁蓿豆进一步调整植物源库关系改变地上及地下生物量分配比例, 使内部资源重新分配, 即使其发生转移和再利用, 是一种以舍弃生物量为代价的生存策略。
植物复水后的第一要务是修复干旱对其造成的伤害。当前, 植物抗旱性的研究多集中于干旱期间植物的变化, 而关于植物经历干旱后复水的修复过程的研究相对薄弱。本试验中干旱胁迫后复水, 一方面, 直立型扁蓿豆叶片在干旱下形成小而密的气孔和表皮细胞特征及复水后较高的气孔开放率、细胞膜结构的迅速修复, 大大提高了其光合作用的潜力和速率, 进而减轻了对CO2吸收和固定的限制, 从根源上减少ROS的产生, 有利于植物的水分平衡和ROS产生与清除平衡的再次形成。另一方面, 干旱胁迫下积累的可溶性糖、可溶性蛋白、脯氨酸等在复水后不仅可作为能量或碳、氮来源被迅速利用, 加快其恢复进程, 也可以发挥渗透调节作用来提高吸收水分的能力, 有助于叶片水势及水分运输效率的恢复。复水后直立型扁蓿豆渗透调节物质及酶活性均能恢复, 百脉根的酶活性仍然较高, 表明其抗氧化能力提升, 有利于复水恢复, 百脉根对干旱的适应性得到提高, 有利于再次应对干旱逆境。直立型扁蓿豆为应对再次的干旱逆境形成了特定的形态特征, 而百脉根则形成了特定的生理特征。另外, 干旱胁迫下较高的根冠比也保证了直立型扁蓿豆在干旱胁迫解除后能够迅速恢复吸水能力及水分运输效率。与此不同, 研究表明沙打旺在胁迫后维持较小的根冠比, 主要通过其叶片较高的水分利用率来恢复地上部分的生长[45]。上述形态结构、生理代谢的变化和调整导致了同化物的最优分配, 对直立型扁蓿豆体内水分吸收及运输效率产生影响, 从而出现补偿反应, 这是生物保存自身的一种重要机能, 在一定程度上弥补了干旱对植物本身所产生的伤害。
4 结论
干旱胁迫下, 直立型扁蓿豆叶片上表皮气孔开放率降低, 表皮细胞及气孔密度比CK分别增加36.6%和48.5%, 形成了小而密的表皮细胞及气孔, 控制气体与水分的进出能力得到增强, 减少了水分散失; 复水后上表皮细胞仍保持小而密的状态, 而下表皮细胞较大利于储水, 这样的形态特征有利于植物及时应对干旱逆境; 除MDA含量随胁迫时间的延长逐渐增加外, 叶绿素含量、抗氧化酶活性及渗透调节物质含量均先升高后降低, 在干旱胁迫9 d达最高, SOD、POD、叶绿素、可溶性糖、可溶性蛋白及脯氨酸分别较CK提高88.9%、111.2%、86.7%、140.5%、147.8%和124.6%, 随后下降, 复水后恢复至CK水平, 表现出极强的复水敏感性和潜在恢复能力, 表明直立型扁蓿豆具有较强的干旱适应性; 干旱胁迫下, 生物量随着水分的减少先增大后减小, 于干旱胁迫9 d达最大, 比CK增加16.4%,复水后超过CK。生物量总的分配格局表现出地上部分生物量投资高于地下部分生物量投资, 地下部分生物量投资比例随着水分的减少而增大。
干旱胁迫下, 直立型扁蓿豆通过形态结构变化、抗氧化防御、渗透调节和同化物分配等策略适应干旱逆境。主动适应阶段, 直立型扁蓿豆生理参数的可塑性指数为形态参数的1.33倍, 且其抗氧化酶的可塑性指数高于其他生理指标, 该品种主要依靠生理代谢调节中的抗氧化系统抵御胁迫, 渗透调节次之。随着胁迫的加深, 直立型扁蓿豆进入被动适应阶段, 其形态参数的可塑性指数为生理参数的1.31倍, 主动防御系统被削弱, 采取牺牲生物量, 将有限的水分和养分用于保护幼嫩器官或组织来提高逆境下的生存能力。另外, 在该阶段, 直立型扁蓿豆的叶绿素含量比CK降低19.0%, 因此, 也可以通过色素含量的降低来减少光吸收从而实现光保护机制。
复水后, 直立型扁蓿豆的根冠比、气孔开放率、气孔及表皮细胞密度比对照分别增加25.9%、29.7%、24.2%和16.3%, 其较高的根冠比和叶片较高的气孔开放率及小而密的气孔及表皮细胞特征, 保证了直立型扁蓿豆吸水能力以及水分运输效率的迅速恢复。其次, 干旱胁迫下根系中积累的渗透调节物质在复水后可以作为能量或碳、氮来源以加快植株的恢复, 同时发挥渗透调节作用保障叶片水势及水分运输效率的恢复。
[1] XU ZZ, ZHOU GS, SHIMIZU H. Plant responses to droughtand rewatering[J]. Plant Signaling & Behavior, 2010, 5(6): 649–654
[2] YANG J Y, ZHENG W, TIAN Y, et al. Effects of various mixed salt-alkaline stresses on growth, photosynthesis, and photosynthetic pigment concentrations ofseedlings[J]. Photosynthetica, 2011, 49(2): 275–284
[3] GUAN B, ZHOU D, ZHANG H, et al. Germination responses ofseeds to salinity, alkalinity, and temperature[J]. Journal of Arid Environments, 2009, 73(1): 135–138
[4] AN S S, DARBOUX F, CHENG M. Revegetation as an efficient means of increasing soil aggregate stability on the Loess Plateau (China)[J]. Geoderma, 2013, 209/210: 75–85
[5] ZHAO L P, WU G L, SHI Z H. Post-fire species recruitment in a semiarid perennial steppe on theLoess Plateau[J]. Australian Journal of Botany, 2013, 61(1): 29–35
[6] 张雨桐, 石凤翎, 乔雨, 等. EMS诱变对直立型扁蓿豆出苗和幼苗生长的影响[J]. 草原与草业, 2019, 31(2): 24–31 ZHANG Y T, SHI F L, QIAO Y, et al. Effects of EMS mutated(L.) Sojak. cv. Zhilixing seeds on seedling emergence and seedling growth[J]. Grassland and Prataculture, 2019, 31(2): 24–31
[7] 石凤翎, 郭晓霞, 李红. 扁蓿豆抗旱形态解剖结构观察与分析[J]. 干旱地区农业研究, 2005, 23(2): 115–118SHI F L, GUO X X, LI H. Examination and analysis of drought-resisting morphology and anatomy of[J]. Agricultural Research in the Arid Areas, 2005, 23(2): 115–118
[8] 李鸿雁, 李志勇, 师文贵, 等. 6种豆科牧草叶片解剖性状与抗旱性关系研究[J]. 西北植物学报, 2010, 30(10): 1989–1994 LI H Y, LI Z Y, SHI W G, et al. Leaf anatomic indexes and the relations with drought resistance of the six forage of[J]. Acta Botanica Boreali-Occidentalia Sinica, 2010, 30(10): 1989–1994
[9] 王璐, 石凤翎, 卞晓燕, 等. 秋水仙素处理直立型扁蓿豆的诱变效应分析[J]. 种子, 2013, 32(10): 50–53 WANG L, SHI F L, BIAN X Y, et al. Analyzing the mutative effects of(L.) Sojak. cv. Zhilixing treated by colchicine[J]. Seeds, 2013, 32(10): 50–53
[10] 李慧, 石凤翎, 熊梅, 等.60Co-γ辐射对直立型扁蓿豆种子产量及构成因子的影响[J]. 中国草地学报, 2013, 35(6): 9–13LI H, SHI F L, XIONG M, et al. Effect of60Co-γ ray irradiation on seed yields and component factors of(L.) Sojak. cv. Zhilixing[J]. Chinese Journal of Grassland, 2013, 35(6): 9–13
[11] SHU Y J, LI W, ZHAO J Y, et al. Transcriptome sequencing and expression profiling of genes involved in the response to abiotic stress in[J]. Genetics and Molecular Biology, 2018, 41(3): 638–648
[12] 鱼小军, 肖红, 徐长林, 等. 扁蓿豆和苜蓿种子萌发期抗旱性和耐盐性比较[J]. 植物遗传资源学报, 2015, 16(2): 405–410 YU X J, XIAO H, XU C L, et al. Comparative study on drought resistance and salt tolerance ofandat seed germination period[J]. Journal of Plant Genetic Resources, 2015, 16(2): 405–410
[13] 郝建辉, 石凤翎. 不同扁蓿豆材料抗旱性比较研究[J]. 中国草地学报, 2006, 28(3): 39–42 HAO J H, SHI F L. Study on drought resistance ofaccessions[J]. Chinese Journal of Grassland, 2006, 28(3): 39–42
[14] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000LI H S. Principles and Techniques of Plant Physiological Biochemical Experiment[M]. Beijing: Higher Education Press, 2000
[15] VALLADARES F, WRIGHT S J, LASSO E, et al. Plastic phenotypic response to light of 16 congeneric shrubs from a Panamanian rainforest[J]. Ecology, 2000, 81(7): 1925–1936
[16] 杨琴琴. 入侵植物香菇草()对水分的表型可塑性研究及其演变预测[D]. 杭州: 浙江农林大学, 2013 YANG Q Q. The phenotypic plasticity of water and the forecast of evolution of invasive plant[D]. Hangzhou: Zhejiang A & F University, 2013
[17] FRASER L H, GREENALL A, CARLYLE C, et al. Adaptive phenotypic plasticity of: Response of stomatal density, leaf area and biomass to changes in water supply and increased temperature[J]. Annals of Botany, 2009, 103(5): 769–775
[18] 吴丽君, 李志辉, 杨模华, 等. 赤皮青冈幼苗叶片解剖结构对干旱胁迫的响应[J]. 应用生态学报, 2015, 26(12): 3619–3626 WU L J, LI Z H, YANG M H, et al. Response of leaf anatomical characteristics ofseedlings to drought stress[J]. Chinese Journal of Applied Ecology, 2015, 26(12): 3619–3626
[19] 姚卫杰, 张艳福, 丹曲, 等. 砂生槐叶片气孔特性对干旱和低温胁迫的响应[J]. 贵州农业科学, 2015, 43(9): 23–29 YAO W J, ZHANG Y F, DAN Q, et al. Stomatal feature ofleaf under drought and cold stress[J]. Guizhou Agricultural Sciences, 2015, 43(9): 23–29
[20] WANG S G, JIA S S, SUN D Z, et al. Mapping QTLs for stomatal density and size under drought stress in wheat (L.)[J]. Journal of Integrative Agriculture, 2016, 15(9): 1955–1967
[21] 可静, 李进, 吕海英, 等. 不同条件下黑果枸杞叶片气孔开度和超微结构的变化[J]. 干旱区研究, 2017, 34(6): 1362–1370 KE J, LI J, LYU H Y, et al. Change of stomatal aperture and ultrastructure onMurr.leaves under different conditions[J]. Arid Zone Research, 2017, 34(6): 1362–1370
[22] DRAKE P L, FROEND R H, FRANKS P J. Smaller, faster stomata: Scaling of stomatal size, rate of response, and stomatal conductance[J]. Journal of Experimental Botany, 2013, 64(2): 495–505
[23] 夏振华, 陈亚宁, 朱成刚, 等. 干旱胁迫环境下的胡杨叶片气孔变化[J]. 干旱区研究, 2018, 35(5): 1111–1117 XIA Z H, CHEN Y N, ZHU C G, et al. Stomatal change in leaves ofunder drought stress[J]. Arid Zone Research, 2018, 35(5): 1111–1117
[24] 赵雅丽, 熊浩, 毕玉芬, 等. 干热胁迫对紫花苜蓿叶片气孔大小的影响[J]. 云南农业大学学报, 2013, 28(3): 336–339 ZHAO Y L, XIONG H, BI Y F, et al. Effect of drought and heat stress on leaf stomata size in alfalfa[J]. Journal of Yunnan Agricultural University, 2013, 28(3): 336–339
[25] SELOTE D S, KHANNA-CHOPRA R. Antioxidant response of wheat roots to drought acclimation[J]. Protoplasma, 2010, 245(1): 153–163
[26] SZABADOS L, SAVOURÉ A. Proline: A multifunctional amino acid[J]. Trends in Plant Science, 2010, 15(2): 89–97
[27] SLAMA I, TAYACHI S, DEY A J, et al. Differential response to water deficit stress in Alfalfa () cultivars: Growth, water relations, osmolyte accumulation and lipid peroxidation[J]. African Journal of Biotechnology, 2011, 10(72): 16250–16259
[28] 权文利, 产祝龙. 紫花苜蓿抗旱机制研究进展[J]. 生物技术通报, 2016, 32(10): 34–41 QUAN W L, CHAN Z L. Research progress on drought resistance mechanism of alfalfa[J].Biotechnology Bulletin, 2016, 32(10): 34–41
[29] SANDERS G J, ARNDT S K. Osmotic adjustment under drought conditions[M]//AROCA R. Plant Responses to Drought Stress. Berlin, Heidelberg: Springer, 2012
[30] 赵宏伟, 王新鹏, 于美芳, 等. 分蘖期干旱胁迫及复水对水稻抗氧化系统及脯氨酸影响[J]. 东北农业大学学报, 2016, 47(2): 1–7 ZHAO H W, WANG X P, YU M F, et al. Effect of drought stress and rewatering on antioxidant system and proline in rice during tillering stage[J]. Journal of Northeast Agricultural University, 2016, 47(2): 1–7
[31] 罗桑卓玛, 辛福梅, 杨小林, 等. 干旱胁迫对香柏幼苗生长和生理指标的影响[J]. 西北农林科技大学学报:自然科学版, 2015,43(5): 51–57 LUOSANG Z M, XIN F M, YANG X L, et al. Effect of drought stress on growth and physiological indicators ofvar.seedlings[J].Journal of Northwest A & F University: Natural Science Edition, 2015, 43(5): 51–57
[32] CHAKRABARTY A, ADITYA M, DEY N, et al. Antioxidant signaling and redox regulation in drought-and salinity-stressed plants[M]//HOSSAIN MA, WANI SH, BHATTACHARJEE S, et al. Drought Stress Tolerance in Plants, Volume 1. Cham: Springer International Publishing, 2016: 465–498
[33] ZHANG Q, MA C, XUE X, et al. Overexpression of acytosolic ascorbate peroxidase gene,, increases salt tolerance in transgenicAlfalfa[J]. Journal of Integrative Agriculture, 2014, 13(11): 2500–2507
[34] EFEOĞLU B, EKMEKÇI Y, ÇIÇEK N. Physiological responses of three maize cultivars to drought stress and recovery[J]. South African Journal of Botany, 2009, 75(1): 34–42
[35] DJILIANOV D, DRAGIISKA R, YORDANOVA R, et al. Physiological changes in osmotically stressed detached leaves of alfalfa genotypes selected in vitro[J]. Plant Science, 1997, 129(2): 147–156
[36] VILJEVAC M, DUGALIĆ K, MIHALJEVIĆ I, et al. Chlorophyll content, photosynthetic efficiency and genetic markers in two sour cherry(L.) genotypes under drought stress[J]. Acta Botanica Croatica, 2013, 72(2): 221–235
[37] 张丹, 任洁, 王慧梅. 干旱胁迫及复水对红松针叶和树皮绿色组织光合特性及抗氧化系统的影响[J]. 生态学杂志, 2016, 35(10): 2606–2614 ZHANG D, REN J, WANG H M. Response of photosynthetic characteristics and antioxidant system in needles and bark chlorenchyma of Korean pine to drought stress and rehydration[J]. Chinese Journal of Ecology, 2016, 35(10): 2606–2614
[38] 姚曹, 周俊, 徐洋, 等. 不同苜蓿品种幼苗对干旱胁迫的生理响应[J]. 安徽科技学院学报, 2017, 31(4): 30–33 YAO C, ZHOU J, XU Y, et al. Physiological responses of different alfalfa varieties seedlings to drought stress[J]. Journal of Anhui Science and Technology University, 2017, 31(4): 30–33
[39] 赵海明, 孙桂枝, 王学敏, 等. 百脉根种质苗期抗旱性鉴定及综合评价[J]. 草原与草坪, 2011, 31(6): 18–26ZHAO H M, SUN G Z, WANG X M, et al. Comprehensive evaluation and identification of drought resistance ofin seedling stage[J]. Grassland and Turf, 2011, 31(6): 18–26
[40] 张翠梅, 师尚礼, 陈建纲. 干旱胁迫对苜蓿幼苗叶绿素荧光特性和膜脂过氧化的影响[J]. 草原与草坪, 2019, 39(1): 16–27ZHANG C M, SHI S L, CHEN J G. Effects of drought stress on chlorophyll fluorescence parameters and lipid peroxodation in alfalfa seedlings[J]. Grassland and Turf, 2019, 39(1): 16–27
[41] 谢志玉, 张文辉. 干旱和复水对文冠果生长及生理生态特性的影响[J]. 应用生态学报, 2018, 29(6): 1759–1767 XIE Z Y, ZHANG W H. Effects of drought and rewatering on growth and photosynthetic physioecological characteristics of[J]. Chinese Journal of Applied Ecology, 2018, 29(6): 1759–1767
[42] 施钦, 殷云龙, 王芝权, 等. 中山杉及其父母本幼苗对干旱胁迫和复水的响应[J]. 应用生态学报, 2016, 27(11): 3435–3443 SHI Q, YIN Y L, WANG Z Q, et al. Response in cuttings ofhybrid ‘Zhongshanshan’ and their parents to drought and re-hydration[J]. Chinese Journal of Applied Ecology, 2016, 27(11): 3435–3443
[43] 郭书嫄. 干旱胁迫及复水条件下紫花苜蓿的生理生态响应[D]. 沈阳: 沈阳农业大学, 2016 GUO S Y. Eco-physiological responses of alfalfa under drought stress and re-watering[D]. Shenyang: Shenyang Agricultural University, 2016
[44] 韩瑞宏, 蒋超, 董朝霞, 等. 47份苜蓿种质材料抗旱性综合评价[J]. 中国草地学报, 2017, 39(4): 27–35 HAN R H, JIANG C, DONG C X, et al. Comprehensive evaluation of drought resistance of 47 Medicago germplasm materials under drought stress[J]. Chinese Journal of Grassland, 2017, 39(4): 27–35
[45] 张荟荟, 杨钢, 高洪文, 等. 10份豆科牧草的苗期抗旱性综合评价[J]. 新疆农业科学, 2013, 50(5): 938–943ZHANG H H, YANG G, GAO H W, et al. Comprehensive evaluation of drought resistance of ten legume forage seedlings[J]. Xinjiang Agricultural Sciences, 2013, 50(5): 938–943
[46] 徐炳成, 山仑, 李凤民. 苜蓿与沙打旺苗期生长和水分利用对土壤水分变化的反应[J]. 应用生态学报, 2005, 16(12): 2328–2332 XU B C, SHAN L, LI F M. Responses ofandseedlings growth and water use to soil moisture regime[J]. Chinese Journal of Applied Ecology, 2005, 16(12): 2328–2332
[47] LIU YB, LIU MT, CAO B. Effects of drought stress on antioxidant enzyme, photosynthetic pigment and flavonoid pathway in two desert shrubs[J]. Sciences in Cold and Arid Regions, 2011, 3(4): 332–338
[48] AN Y Y, LIANG Z S, ZHAO R K, et al. Organ-dependent responses ofto repeated dehydration and rehydration[J]. South African Journal of Botany, 2011, 77(2): 446–454
(L.) Sojak. cv. Zhilixing response and adaptation strategy to drought stress and rehydration*
WU Rina, SHI Fengling**, XU Bo
(College of Grassland, Resources and Environment, Inner Mongolia Agricultural University / Key Laboratory of Grassland Resources of Ministry of Education (Inner Mongolia Agricultural University), Huhhot 010000, China)
The effect of drought stress and rehydration on(L.) Sojak cv. Zhilixing morphological structures, physiological metabolism, and matter distribution were investigated to determine the adaptation strategy in an arid environment. Seedling-stage(with 6–8 leaves) were subjected to continuous drought stress for 12 days and then re-watered for 4 days; samples were collected from the control group (CK), after 9 and 12 days of drought stress, and 4 days after rehydration. Compared with the CK, the stoma opening rate decreased, while the stoma and epidermis cell densities increased by 48.5% and 36.6%, respectively. Smaller and denser epidermal cells formed. The malondialdehyde (MDA) content increased gradually during stress period. Superoxide dismutase activity (SOD), peroxidase activity (POD), and contents of chlorophyll, soluble sugar, soluble protein, and proline first increased and then decreased with prolonged drought. Total biomass also first increased then decreased, reaching the maximum after 9 days (0.433 7 g; 16.4% increase). The distribution of the above-ground biomass was higher than the under-ground biomass, and the under-ground biomass proportion increased with drought, while the opposite effect was observed with the above-ground biomass. After re-watering, all of the physiological and biochemical indexes recovered or exceeded those of the control, indicating strong rehydration sensitivity and resilience.adaptation to drought stress and rehydration was divided into three periods: active adaptation, passive adaptation, and re-watering. The physiological parameter plasticity index was 0.16, 1.33 times greater than the morphological parameter index, during the active adaptation period. Drought stress adaptation was achieved by altering the antioxidant and osmotic regulation systems to reduce water loss, improving water retention and absorption efficiency, and maintaining the water absorption and loss balance. The morphological parameter plasticity index was 0.24, 1.31 times greater than the physiological parameter index, during the passive adaptation period.sacrificed biomass and reduced pigments to aid survival. The root-shoot ratio (25.9%), stomatal opening rate (29.7%), and stomatal and epidermal cell density (24.2% and 16.3%, respectively) were higher than those in the CK during the re-watering period. These characteristics promoted rapid water recovery, absorption capacity, and water transport efficiency. Morphological and physiological changes allowedto adapt to drought stress and rehydration, contributing to its survival in arid conditions.
(L.) Sojak. cv. Zhilixing; Drought stress; Rehydration; Morphology; Physiology; Adaptive strategy; Epidermis cell of leaf; Stomatal density
Q945.78; Q944.53

10.13930/j.cnki.cjea.200308
乌日娜, 石凤翎, 徐舶. 直立型扁蓿豆对干旱胁迫和复水的响应及适应策略[J]. 中国生态农业学报(中英文), 2020, 28(12): 1901-1912
WU R N, SHI F L, XU B.(L.) Sojak. cv. Zhilixing response and adaptation strategy to drought stress and rehydration [J]. Chinese Journal of Eco-Agriculture, 2020, 28(12): 1901-1912
* 内蒙古自治区科技计划项目(2019GG244)资助
石凤翎, 主要从事牧草遗传育种研究。E-mail: sfl0000@126.com
乌日娜, 主要从事牧草遗传育种研究。E-mail: caokundeyouxiang@126.com
2020-04-24
2020-07-04
* This study was supported by the Science and Technology Project of Inner Mongolia Autonomous Region in China (2019GG244).
, E-mail: sfl0000@126.com
Apr. 24, 2020;
Jul. 4, 2020

