紫草素通过激活自噬相关的E1连接酶7信号通路诱导结肠癌细胞自噬
孙艳华,李明,徐建立,董路,曹学彬,孟小晶
作者单位:沧州市人民医院胃肠疝外科,河北 沧州061000
结肠癌是一种能够受遗传和环境影响的高发恶性肿瘤[1-2],是导致老年人癌症相关死亡率的主要原因[3],大约25%~40%的病人存在肿瘤复发,导致结肠癌的死亡率高达40%[4-5]。紫草素(shikonin)是一种来自传统中草药——紫草(Lithospermum erythrorhizon)根部的萘醌类化合物[6],其具有广谱抗肿瘤活性[7],可诱导细胞凋亡[8],抑制癌细胞增殖[9]。但紫草素诱导人结肠癌细胞自噬的作用机制仍不清楚。
细胞异常增殖是癌症发生的主要特征[10-11],自噬是一种进化上保守的可以有效维持细胞稳态的生理过程,通过溶酶体降解细胞内功能冗余的蛋白质或受损细胞器[12-14],在细胞生长、细胞分化、癌症、感染和代谢综合征等多种生理和病理过程中发挥着重要作用[15-17]。在DAF-2突变体秀丽隐杆线虫中,Beclin 1敲低使其寿命明显缩短[18-20]。自噬相关的E1连接酶7(ATG7)是自噬囊泡延伸过程中的关键因子,参与了两种必需的泛素化反应过程[21]。ATG7对于机体发育平衡,细胞分化尤为重要[22-24]。
本研究起止时间为2017年10月至2019年6月,旨在阐明ATG7在紫草素诱导的结肠癌细胞自噬过程中的作用机制。
1 材料与方法
1.1 研究材料 紫草素购于Aynor Medicine Technology Co.Ltd(中国西安),纯度98%;二甲基亚砜(DMSO)购于MP Biomedicals LLC(Santa Ana,CA,USA);Trypsin-EDTA 0.25%(1×),胎牛血清(FBS)和DMEM培养基购于Thermo Fisher Scientific(Waltham,MA,USA);Hoechst 33258试剂盒和细胞计数试剂盒-8(CCK-8)购于Beyotime Institute of Biotechnology(中国上海);抗体包括β-actin、磷酸化激活的c-Jun氨基末端激酶(P-JNK)、c-Jun氨基末端激酶(JNK)、DNA修复酶(PARP)、Fas相关死亡域蛋白(FADD)、磷酸化激活的P38蛋白(p-P38)、P38蛋白(P38)、LC3B、p62、半胱氨酸蛋白酶-3(Caspase-3)、裂解的半胱氨酸蛋白酶-3(Cleaved-Caspase-3)、半胱氨酸蛋白酶-8(Caspase-8)和裂解的半胱氨酸蛋白酶-8(Cleaved-Caspase-8),购于Cell Signaling Technology(Danvers,MA,USA);细胞外调节蛋白激酶(ERK)和磷酸化激活的ERK(P-ERK)的抗体购于Beyotime Institute of Biotechnology;二抗购于Jackson ImmunoResearch Laboratorie s(West Grove,PA,USA);RNA干扰试验所用载体pSUPER购于Oligoengine公司,阴性对照质粒为pSUPER_GFP siRNA,干扰pSUPER载体靶序列为5’-CCACTAGTCTGACGGATAA,ATG7干扰靶序列为5’-GCCTGCTGAGGAGCTCTCCAT。
1.2细胞培养人结肠癌细胞系SNU-407细胞购于中国科学院典型培养物保藏中心。正常结肠黏膜上皮细胞系NCM460细胞购于南京贝尔博有限公司。细胞培养条件:10%FBS,37℃,5%二氧化碳。
1.3 CCK-8检测通过CCK-8试剂盒测定细胞存活率。细胞经胰蛋白酶消化后,将其培养于96孔板中,每孔8×103个细胞,然后孵育过夜。将紫草素以指定浓度(0~80µmol/L)溶解在DMSO中,然后与10%FBS-DMEM混合。细胞在不同处理下培养24 h和48 h。向每个孔(200µL)中加入20µL CCK-8溶液,并在37℃下温育1 h。然后,使用ELx800吸光度酶标仪测量490 nm处吸光度。
1.4 Hoechst 33258染色将盖玻片浸泡在75%乙醇中30 min充分处理,用无菌磷酸缓冲盐溶液(PBS)洗涤3次,然后在六孔板中与细胞一起孵育过夜。用不同浓度(0µmol/L、10µmol/L、20µmol/L和30µmol/L)紫草素处理24 h。除去培养基后,向各孔中加入0.5 mL固定液处理10 min。弃定影液,再用PBS洗涤细胞3 min。在黑暗中用Hoechst 33258(0.5 mL)将细胞染色5 min。弃Hoechst 33258,并用PBS洗涤细胞两次,在每个盖玻片上加入1滴封固剂。最后,在IX71荧光显微镜下观察记录细胞生长情况。
1.5流式细胞术分析用不同浓度(0µmol/L、10µmol/L、20µmol/L和30µmol/L)紫草素处理细胞24 h后收集,经PBS充分洗涤细胞,通过胰蛋白酶消化分离,并转移到新的离心管中。离心沉降后,细胞浓度稀释至1×105个,然后用5µL膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和10µL碘化丙啶(PI)在黑暗中染色20 min。立即通过Guava Easy-Cyte 6HT-2L流式细胞仪分析记录细胞生长情况。
1.6蛋白质印迹法(Western Blot)细胞在紫草素处理24 h后,用胰蛋白酶消化,获得单细胞悬浮液并用PBS洗涤3次。使用全细胞裂解分析试剂盒(KeyGEN Biotec)提取总蛋白。然后,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质样品。再将蛋白质转移到聚偏二氟乙烯(PVDF)微孔膜上,并用5%脱脂奶粉封闭1 h。将PVDF膜在4℃下与一抗孵育过夜:ERK(1∶1 000)、P-ERK(1∶1 000)、JNK(1∶1 000)、P-JNK(1∶1 000)、P38(1∶1 000)、p-P38(1∶1 000)、FADD(1∶1 000)、Caspase-8(1∶1 000)、Cleaved-Caspase-8(1∶1 000)、Caspase-3(1∶1 000)、Cleaved-Caspase-3(1∶1 000)、PARP(1∶1 000)、裂解的DNA修复酶(Cleaved PARP,1∶1 000)、自噬分子标记物LC3B(1∶1 000)和β-actin(1∶1 000)。用1×磷酸盐吐温缓冲液(PBST)洗涤3次后,将膜与稀释的二抗一起温育1 h。再次洗涤3次后,使用增强化学发光溶液(Thermo Fisher Scientific)检测印迹。使用X射线胶片处理器(Taixing Suxing Company)拍照记录。经NIH成像程序(ImageJ)分析每种蛋白质的吸光度。
1.7统计学方法本研究中每一实验结果至少包括3次重复独立实验,数据用GraphPad Prism 5.0软件分析。所得数据以xˉ±s表示,多组间比较采用单因素方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1紫草素抑制人结肠癌细胞系SNU-407细胞增殖人结肠癌细胞系SNU-407细胞经不同浓度梯度的紫草素处理24 h和48 h后,通过CCK-8测定检查细胞活力。检测结果表明,在24 h和48 h时,紫草素对SNU-407细胞的50%生长抑制值(GI50)分别为(18.20±0.17)µmol/L和(12.90±0.32)µmol/L。同时,在低于35µmol/L紫草素范围内,正常结肠黏膜上皮细胞系NCM460细胞生长不受影响,在24 h和48 h时紫草素对NCM460细胞的GI50值分别为(57.96±0.36)µmol/L和(53.81±0.33)µmol/L。见表1。
2.2紫草素诱导人结肠癌细胞系SNU-407细胞凋亡通过Hoechst 33258染色观察不同浓度梯度紫草素处理SNU-407细胞后,细胞凋亡的形态学和生化特征。荧光显微镜观察结果表明,紫草素处理组细胞内凋亡小体明显增多(图1A)。此外,流式细胞术分析结果显示紫草素诱导SNU-407胞凋亡:紫草素处理24 h后,早期和晚期凋亡细胞的百分比显著增加;在紫草素暴露24 h后,早期凋亡细胞的百分比从3.09%增加至21.59%。随着紫草素浓度的增加,晚期凋亡细胞的百分比也明显增加(图1B)。
表1 不同浓度紫草素抑制结肠癌细胞增殖情况/(%,)

表1 不同浓度紫草素抑制结肠癌细胞增殖情况/(%,)
注:SNU-407属人结肠癌细胞系,NCM460属正常结肠黏膜上皮细胞系。与0µmol/L紫草素相比,aP<0.001
SNU-407细胞相对存活率NCM460细胞相对存活率紫草素0µmol/L 5µmol/L 10µmol/L 15µmol/L 20µmol/L 25µmol/L 30µmol/L 35µmol/L 40µmol/L 45µmol/L 50µmol/L 55µmol/L 60µmol/L 65µmol/L 70µmol/L 75µmol/L 80µmol/L 48 h 100 103.40±0.54 101.54±1.65 99.54±1.25 97.54±1.69 95.14±1.77 93.17±2.11 91.24±1.55 88.15±2.13a 83.12±1.47a 65.14±2.13a 48.24±2.17a 43.17±2.14a 40.14±1.22a 39.47±1.21a 39.12±0.87a 39.04±1.12a 24 h 100 82.51±1.21a 72.15±1.54a 63.21±0.87a 48.26±0.87a 43.15±1.54a 40.21±2.21a 37.12±2.14a 32.14±1.21a 28.47±2.21a 26.47±1.54a 23.58±2.14a 21.14±1.54a 19.57±2.66a 19.54±1.77a 18.54±1.25a 18.51±0.87a 48 h 100 75.21±1.11a 63.54±0.57a 45.59±0.76a 40.42±1.11a 35.41±1.88a 32.14±1.87a 30.74±2.21a 25.14±2.14a 22.47±2.14a 20.46±2.65a 18.54±1.54a 16.47±2.54a 15.47±1.47a 14.87±2.13a 14.33±1.29a 13.88±1.47a 24 h 100 105.20±0.24 108.24±1.55 103.57±1.22 101.25±1.58 98.58±1.66 96.25±1.44 93.21±1.47 90.21±2.13 85.14±1.33a 75.14±1.36a 53.14±1.56a 49.25±2.14a 43.14±1.54a 41.25±1.47a 40.14±0.87a 39.14±0.28a
2.3紫草素激活了死亡受体途径蛋白质印迹法检测结果显示,随着紫草素浓度的增加,FADD的表达增强(P<0.05),而紫草素处理组细胞PARP表达水平没有明显变化(P<0.05),但紫草素处理组细胞中裂解的PARP蛋白水平显著增加(P<0.05)。此外,与对照组相比,紫草素处理组Caspase-8和Caspase-3蛋白表达水平没有显著变化(P<0.05),而裂解的Caspase-8和Caspase-3蛋白含量显著增加(P<0.05)。见图2、表2。
2.4紫草素激活了丝裂原活化蛋白激酶(MAPK)途径紫草素处理对SNU-407细胞MAPK途径关键蛋白的蛋白质印迹法检测结果显示,与0µmol/L紫草素浓度组相比,随着紫草素浓度的增加,P-ERK、P-JNK和p-P38蛋白的表达水平显著上调(P<0.05),ERK、JNK和P38蛋白的表达水平均为发生显著变化(P>0.05)。此外,还检测了B细胞淋巴瘤/白血病-2(Bcl-2)、Bcl-2相关X蛋白(Bax)蛋白表达情况。与对照组相比,紫草素处理组中Bax水平明显上调,Bcl-2的表达显著降低(P<0.05)。见图3、表3。
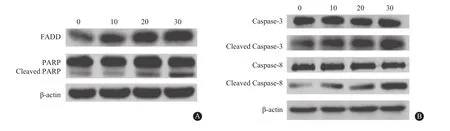
图2 蛋白质印迹法检测不同浓度紫草素诱导人结肠癌细胞SNU-407中死亡受体途径相关蛋白:A为FADD、PARP及Cleaved PARP检测结果;B为Caspase-3、Cleaved Caspase-3、Caspase-8、Cleaved Caspase-8检测结果
表2 不同浓度紫草素诱导人结肠癌细胞SNU-407中死亡受体途径相关蛋白蛋白质印迹法检测结果比较/
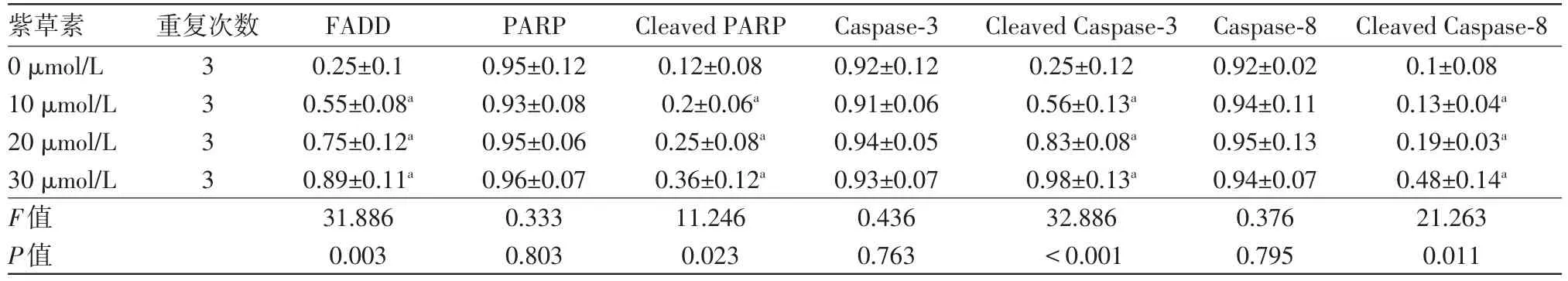
表2 不同浓度紫草素诱导人结肠癌细胞SNU-407中死亡受体途径相关蛋白蛋白质印迹法检测结果比较/
注:FADD为Fas相关死亡域蛋白,PARP为DNA修复酶,Cleaved PARP为裂解的DNA修复酶,Caspase-3为半胱氨酸蛋白酶-3,Cleaved Caspase-3为裂解的半胱氨酸蛋白酶-3,Caspase-8为半胱氨酸蛋白酶-8,Cleaved Caspase-8为裂解的半胱氨酸蛋白酶-8。与0µmol/L紫草素相比,aP<0.05
Cleaved Caspase-8 0.1±0.08 0.13±0.04a 0.19±0.03a 0.48±0.14a 21.263 0.011紫草素0µmol/L 10µmol/L 20µmol/L 30µmol/L F值P值重复次数3 3 3 3 FADD 0.25±0.1 0.55±0.08a 0.75±0.12a 0.89±0.11a 31.886 0.003 PARP 0.95±0.12 0.93±0.08 0.95±0.06 0.96±0.07 0.333 0.803 Cleaved PARP 0.12±0.08 0.2±0.06a 0.25±0.08a 0.36±0.12a 11.246 0.023 Caspase-3 0.92±0.12 0.91±0.06 0.94±0.05 0.93±0.07 0.436 0.763 Cleaved Caspase-3 0.25±0.12 0.56±0.13a 0.83±0.08a 0.98±0.13a 32.886<0.001 Caspase-8 0.92±0.02 0.94±0.11 0.95±0.13 0.94±0.07 0.376 0.795
表3 不同浓度紫草素处理对人结肠癌细胞SNU-407丝裂原活化蛋白激酶(MAPK)信号传导途径中各蛋白蛋白质印迹法检测结果比较/
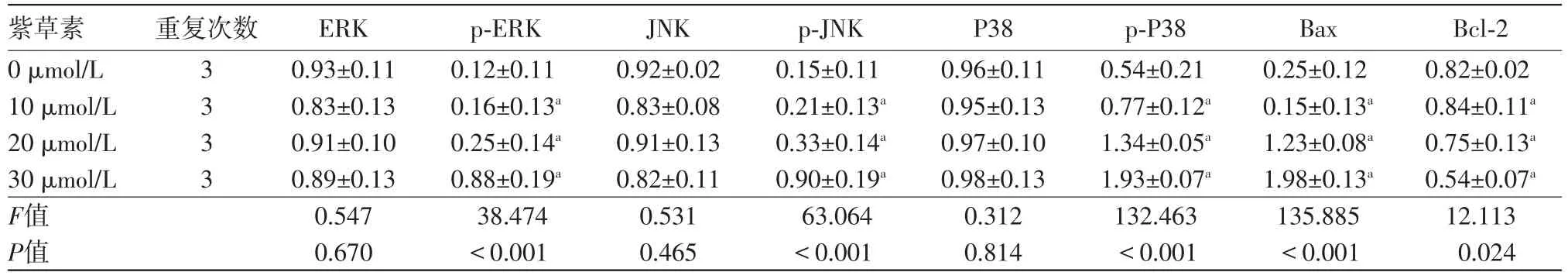
表3 不同浓度紫草素处理对人结肠癌细胞SNU-407丝裂原活化蛋白激酶(MAPK)信号传导途径中各蛋白蛋白质印迹法检测结果比较/
注:ERK为细胞外调节蛋白激酶,p-ERK为磷酸化激活的ERK,JNK为c-Jun氨基末端激酶,p-JNK为磷酸化激活的c-Jun氨基末端激酶,P38为P38蛋白,p-P38为磷酸化激活的P38蛋白,Bax为Bcl-2相关X蛋白,Bcl-2为B细胞淋巴瘤/白血病-2蛋白。与0µmol/L紫草素相比,aP<0.05
Bcl-2 0.82±0.02 0.84±0.11a 0.75±0.13a 0.54±0.07a 12.113 0.024紫草素0µmol/L 10µmol/L 20µmol/L 30µmol/L F值P值重复次数3 3 3 3 ERK 0.93±0.11 0.83±0.13 0.91±0.10 0.89±0.13 0.547 0.670 p-ERK 0.12±0.11 0.16±0.13a 0.25±0.14a 0.88±0.19a 38.474<0.001 JNK 0.92±0.02 0.83±0.08 0.91±0.13 0.82±0.11 0.531 0.465 p-JNK 0.15±0.11 0.21±0.13a 0.33±0.14a 0.90±0.19a 63.064<0.001 P38 0.96±0.11 0.95±0.13 0.97±0.10 0.98±0.13 0.312 0.814 p-P38 0.54±0.21 0.77±0.12a 1.34±0.05a 1.93±0.07a 132.463<0.001 Bax 0.25±0.12 0.15±0.13a 1.23±0.08a 1.98±0.13a 135.885<0.001
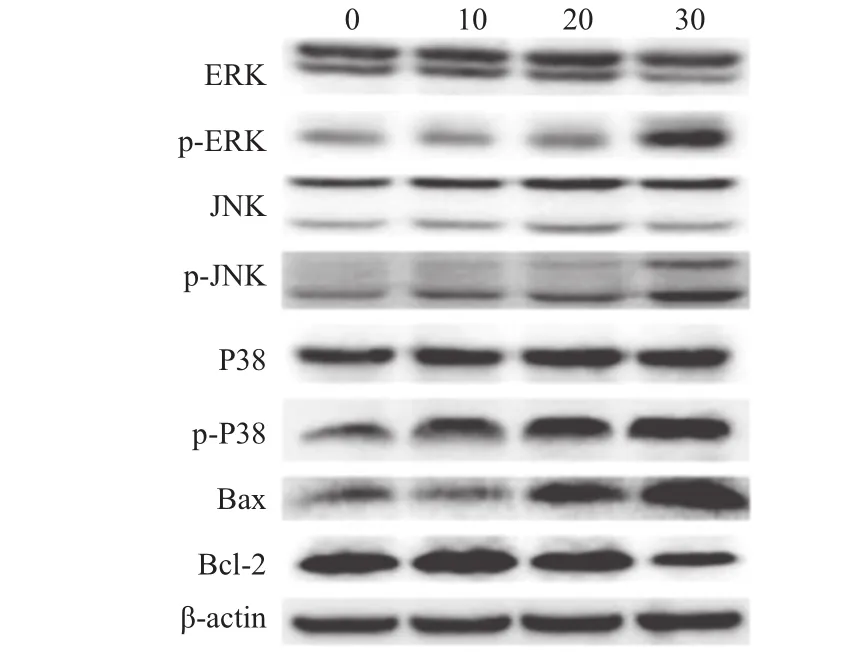
图3 蛋白质印迹法检测不同浓度紫草素处理对人结肠癌细胞SNU-407丝裂原活化蛋白激酶(MAPK)信号传导途径中各蛋白表达
2.5紫草素诱导人结肠癌细胞系SNU-407细胞自噬在对紫草素诱导结肠癌细胞自噬的检测中,SNU-407细胞经紫草素处理后,ATG5的蛋白质表达水平没有明显变化,然而,随着紫草素浓度的增加,ATG7蛋白表达水平明显增强,p62表达水平显著下调;10µmol/L、20µmol/L和30µmol/L紫草素处理后SNU-407细胞的ATG7/ATG5相对表达量分别为(176±9)%、(212±13)%和(293±11)%,与0 µmol/L紫草素处理组相比均显著增加(P<0.05)。见图4。
2.6 ATG7沉默抑制紫草素诱导的细胞自噬通过构建ATG7的RNA干扰质粒pSUPER_ATG7 siRNA(shATG7),转染SNU-407细胞后,经紫草素处理,与阴性对照质粒pSUPER_GFP siRNA(GFPi)转染细胞比较LC3-Ⅱ的激活情况。蛋白质印迹法检测结果显示,细胞自噬基因ATG7表达水平随紫草素浓度升高而增加,见图5A、表4。经20µmol/L紫草素处理后,ATG被沉默的shATG7组LC3-Ⅱ/LC3-Ⅰ比值显著低于GFPi阴性对照组[(8.25±1.36)比(97.45±1.98),P<0.001],LC3-Ⅱ的激活受到抑制,见图5B。

图4 不同浓度紫草素处理的SNU-407细胞中自噬相关的E1连接酶5(ATG5)、自噬相关的E1连接酶7(ATG7)和p62蛋白的表达
表4 自噬相关的E1连接酶7(ATG7)的沉默抑制不同浓度紫草素诱导的细胞自噬结果比较/

表4 自噬相关的E1连接酶7(ATG7)的沉默抑制不同浓度紫草素诱导的细胞自噬结果比较/
注:Beclin-1和ATG7均为自噬相关蛋白。与0µmol/L紫草素相比,aP<0.05
ATG7 0.1±0.04 0.22±0.05a 0.75±0.12a 0.95±0.13a 53.648<0.001紫草素0µmol/L 10µmol/L 20µmol/L 30µmol/L F值P值重复次数NCM460SNU407 3 3 3 3 Beclin-1 0.11±0.08 0.18±0.09a 0.35±0.12a 0.45±0.11a 15.224 0.009 ATG7 0.25±0.14 0.43±0.14a 0.75±0.12a 0.93±0.13a 38.853<0.001 Beclin-1 0.08±0.02 0.13±0.04a 0.45±0.12a 0.55±0.11a 174.649<0.001

图5 自噬相关的E1连接酶7(ATG7)的沉默抑制不同浓度紫草素诱导的细胞自噬:A为紫草素对细胞自噬基因的影响;B为ATG7干扰抑制了紫草素诱导的结肠癌细胞自噬
3 讨论
本研究对紫草素抗肿瘤分子机制分两步进行。第一部分为紫草素处理24 h条件下诱导结肠癌SNU-407细胞凋亡,细胞凋亡作为I型程序性细胞死亡方式,是靶向肿瘤药物实现细胞杀伤的最常见机制。而Ⅱ型程序性细胞死亡即细胞自噬,目前在抗肿瘤药物治疗研究领域仍有争议。因此,本研究主要关注于探讨紫草素诱导细胞自噬的分子机制。CCK-8细胞活力测定结果显示,紫草素以浓度和时间依赖性方式抑制结肠癌细胞SNU-407增殖;通过Hoechst 33258染色观察到紫草素处理组细胞核破裂,凋亡小体明显增多,表明紫草素可诱导SNU-407细胞凋亡。进一步蛋白质印迹法检测发现,紫草素可以激活MAPK和FADD诱导SNU-407细胞凋亡,并上调ATG7表达诱导结肠癌细胞自噬。以上结果为将紫草素开发成新型结肠癌治疗药物提供实验依据。
细胞凋亡途径可分为外在死亡受体途径和内在线粒体途径[25],外在死亡受体途径涉及的一些相关蛋白质,如FADD、Caspase-8和Caspase-3,其启动后再提高PARP的表达水平[26]。在药物等外界因素诱发凋亡时,裂解的PARP片段常用作细胞凋亡的标志物[27]。而MAPK通路的激活涉及多个细胞过程的启动[28]。例如,激活MAPK途径可以诱导细胞凋亡,这是多种化学治疗药物发挥作用的主要抗癌机制[29-30];ERK、JNK和p38直接参与细胞凋亡[31-32];ERK、JNK和p38的激活常与肿瘤细胞凋亡相关[33-34]。其中,JNK的活化能够调节线粒体蛋白质如Bcl-2来触发细胞生理过程,例如细胞增殖和凋亡[35]。
本研究实验结果表明,紫草素不仅增加了凋亡小体的数量,而且还激活了FADD、Caspase-3、Caspase-8和PARP,它们都参与了外源性死亡受体途径的调节。本研究还揭示了紫草素诱导p38、JNK和ERK的活化和磷酸化。基于这些结果,我们认为紫草素可通过死亡受体途径和人结肠癌细胞中的MAPK活化诱导细胞凋亡以发挥抗肿瘤作用。
自噬是一种正常生理分解代谢过程,通过将受损的细胞器,半衰期长的蛋白质和受损的蛋白质隔离和降解,维持细胞稳态[36]。ATG是一类专门参与细胞自噬调控的基因统称,已鉴定出多种类型,分别参与细胞自噬的启动、自噬体产生和降解等过程[36]。LC3Ⅱ/LC3Ⅰ的水平是自噬程度的重要标志。本研究蛋白质印迹法检测结果显示在ATG7沉默后LC3Ⅱ/LC3Ⅰ比值明显低于对照组,表明ATG7是紫草素诱导SNU-407结肠癌细胞凋亡的关键蛋白因子。泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)和自噬是两个截然不同且相互作用的蛋白水解系统。p62既是自噬底物,可用作自噬活性的报告基因。同时,p62还可将泛素化的蛋白质(例如tau)递送至蛋白酶体完成降解[36-37]。本研究蛋白质印迹法检测结果显示,随着紫草素浓度升高,ATG7表达水平明显上调,p62表达水平显著下调。这表明紫草素可激活结肠癌细胞自噬。
自噬不仅可以保护细胞免受异常细胞代谢活动的影响,并在多种病理过程中发挥肿瘤抑制作用[38-40]。在人肝癌细胞系SMMC-7721中,紫草素可以通过诱导自噬抑制肿瘤生长。紫草素还可诱导NCI-H460肺癌细胞和人骨肉瘤U2OS细胞以及H9C2细胞自噬。此外,紫草素可以通过调节一些自噬相关蛋白如Beclin-1、LC3BⅠ、LC3BⅡ、mTOR和p62来抑制雷帕霉素预处理的胶质瘤细胞中的自噬[24]。
本研究观察到ATG5与ATG7的比例以浓度依赖性方式增加;相反,p62的表达量随着紫草素浓度的增加而逐渐减少;同时,ATG7是紫草素诱导结肠癌SNU-407细胞自噬的关键调控因子。这些结果证明紫草素通过促进自噬体的起始,诱导结肠癌细胞自噬。
(本文图1见插图12-1)

