镉污染中性土壤伴矿景天修复的硫强化及其微生物效应①
吴广美,王青玲,胡鹏杰,杨钰莹,董 蓓,张绪美,沈文忠,吴龙华 *,骆永明
镉污染中性土壤伴矿景天修复的硫强化及其微生物效应①
吴广美1, 2,王青玲1,胡鹏杰1,杨钰莹1,董 蓓1,张绪美3,沈文忠3,吴龙华1 *,骆永明1
(1 中国科学院土壤环境与污染修复重点实验室(南京土壤研究所),农田土壤污染防控与修复技术国家工程实验室,南京 210008;2 中国科学院大学,北京 100049;3 太仓市农业技术推广中心,江苏太仓 215400)
采用田间微区试验研究了施硫处理对中性镉污染农田上伴矿景天镉吸取修复效率、土壤pH、有效态镉、有效态硫以及微生物群落变化的影响。结果发现:土壤pH随时间和硫用量的增加而显著下降,有效态镉和有效态硫含量随时间和硫用量的增加而显著增加。在360 g/m2硫处理下,伴矿景天地上部镉含量为70.9 mg/kg,较不施硫对照(38.3 mg/kg)增加85.1%,耕层土壤全量镉去除率为19.4%,是对照(10.5%)的1.85倍。施硫处理150 d后,土壤和细菌相对丰度显著高于试验前土壤和对照处理。本试验结果表明,中性土壤施加适量硫磺不仅可显著提高污染土壤中镉的生物有效性,也可通过调节与硫代谢相关的功能微生物,显著增强镉的植物吸取修复效率。
硫;镉;伴矿景天;植物修复;微生物
在过去的几十年中,由于工农业活动,我国耕地土壤镉(Cd)含量不断升高,甚至在工业落后的地区也出现镉污染问题,这严重威胁着生态环境和农业生产功能,危害人体健康[1-2],镉污染土壤的治理迫在眉睫。农田修复问题和技术面临巨大挑战,其中植物吸取修复技术具有原位、绿色、高效等优势,且能最大限度地减少对土壤微生物群落和理化性质的干扰[3-4],适合修复大面积污染的农田土壤。伴矿景天()是在浙江某铅锌矿区发现的一种镉超积累植物[5],对土壤镉具有很强的吸收富集能力。伴矿景天对酸性土壤中镉的去除效率显著高于中碱性土壤[6],这与酸性土壤镉有效性高有关。因此,如何增强中碱性土壤中镉的生物有效性,是提高污染土壤中镉的植物吸取修复效率的重要途径。
强化植物修复技术包括化学、生物以及农艺等措施,其中化学强化修复是指向污染土壤中添加化学试剂、增加土壤重金属移动性和有效性[7-8],但外加化学试剂所引起的二次污染风险以及对土壤理化性质的不利影响限制了其实际应用。近年来,硫元素在污染土壤重金属形态转化[9-11]以及植物体抵御重金属毒害方面受到广泛关注[12-15]。作为肥料,硫磺可补充作物硫营养,在好氧条件下被氧化成硫酸盐,释放H+,降低土壤pH,增加土壤镉的生物有效性[16-17]。土壤微生物群落组成及活性高低是衡量土壤肥力大小和土壤质量高低的一个关键性指标,但土壤微生物群落的多样性和结构对外界环境条件的变化较为灵敏,能反映环境变化和生态功能[18]。因此,本研究拟选择典型镉污染中性农田土壤,开展田间微区试验,探讨硫肥对镉锌超积累植物伴矿景天镉吸取修复效率的影响,并探究硫肥的土壤微生物生态效应,为中性镉污染农田的高效修复提供理论依据。
1 材料与方法
1.1 供试土壤和植物
供试土壤为江苏省东部某镉污染农田土壤。将采集的0 ~ 15 cm表层土样风干、过筛,部分用于育苗,部分用于基本理化性质(表1)的测定,测定方法参考《土壤农化分析》[19]。供试土壤为河流冲积母质发育的普通简育水耕人为土,pH 6.85,为中性土壤[20],全镉含量1.33 mg/kg,超出GB15618—2018筛选值[21]。供试植物为伴矿景天,采用种子育苗,于中国科学院南京土壤研究所植物生长室培养,待其长出4片真叶后选择大小一致、长势良好的幼苗移栽至田间。

表1 供试土壤的理化性质
1.2 田间试验
田间试验在上述镉污染农田进行。试验共设0、180、360、720 g/m2四个硫肥处理,每处理重复3次,随机排列。每个微区3 m2(长2 m、宽1.5 m),小区间开40 cm宽、20 cm深的水沟。供试硫肥为分析纯硫磺粉。土地翻耕平整后将硫肥均匀撒在土壤表面,然后多次翻耕使其与耕层土壤混匀。于2018年1月1日移栽伴矿景天幼苗,行、株距均为15 cm。基肥施用氮磷钾15-15-15的复合肥600 kg/hm2,后期未追肥未灌溉,杂草通过人工拨除。试验于2018年5月30日收获。
1.3 样品采集与测定
土壤样品分别在伴矿景天种植后的0、40、90、150 d时采集,在150 d时同时采集1个周边农田未施硫土壤(NS)。用不锈钢土钻在每个小区梅花形取5个0 ~ 15 cm耕层土壤,混合均匀,土样运至实验室,部分风干后过10目和100目尼龙筛,测定土壤理化性质及全镉量;部分于-80℃冰箱保存,用于土壤微生物提取和高通量测序分析。土壤有效镉采用pH 7的0.01 mol/L CaCl2按质量比为1∶10的土液比浸提,土壤有效硫采用0.008 mol/L Ca(H2PO4)2·H2O按质量比为1∶10土液比浸提[20]。土壤全量和有效态镉含量采用石墨炉原子吸收分光光度计(Varian SpectrAA220Z)测定,土壤有效硫含量采用分光光度计(Metash Spectr UV-5800)测定。
伴矿景天地上部收获后分别用自来水和去离子水洗净,105 ℃杀青30 min,70 ℃烘干48 h,称重,粉碎,HNO3-H2O2(体积比1∶1)消化,采用火焰原子吸收分光光度计(Varian SpectrAA220FS)测定地上部镉含量。测定所用试剂均为优级纯,并采用国家标准参比物质(芹菜:GBW10048)进行质量控制。参比物质测定结果均在合理范围内。
1.4 土壤微生物测序
选用试验90 d时的不施硫和施硫360 g/m2处理土壤,150 d时的农田周边自然土壤(NS)、不施硫处理土壤和施硫360 g/m2处理土壤进行微生物测序。根据E.Z.N.A.® soil试剂盒(Omega Bio-tek, Norcross, GA, U.S.)说明书进行总DNA抽提,DNA浓度和纯度利用NanoDrop2000进行检测,利用1% 琼脂糖凝胶电泳检测DNA提取质量;用515F (5'-GTGCCAGC MGCCGCGG-3')和907R (5'-CCGTCAATTCMTTTR AGTTT-3')引物对V4可变区进行PCR扩增,扩增程序为:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s),最后72 ℃延伸10 min(PCR仪:ABI GeneAmp® 9700型)。扩增体系为20 μl,4 μl 5×FastPfu缓冲液,2 μl 2.5 mmol/L dNTPs,0.8 μl正反向引物(各5 μmol/L),0.4 μl FastPfu聚合酶,0.2 μl BSA(牛血清蛋白);10 ng DNA模板,ddH2O补足至20 μl。每个样品3个重复,将同一样品的PCR产物混合后用2% 琼脂糖凝胶回收PCR产物,然后纯化。利用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)。
原始测序序列使用Trimmomatic对序列进行质量控制,设置50 bp的窗口,如果窗口内的平均质量值低于20,从窗口前端位置截去后端所有序列,之后再去除质控后长度低于50 bp的序列。然后使用FLASH软件进行拼接。拼接时overlap之间的最大错配率为0.2,长度需大于10 bp,去除无法拼接的序列;根据序列首尾两端的barcode和引物将序列拆分至每个样本,得到有效数据。使用UPARSE软件(version 7.1 http://drive5.com/uparse/),根据97% 的相似度对序列进行OTU聚类,并在聚类的过程中去除单序列和嵌合体。利用RDP classifier (http://rdp.cme.msu.edu/) 对每条序列进行物种分类注释,比对Silva数据库(SSU128),设置比对阈值为70%。通过计算各个处理中各菌属门类所含序列占所在样品总序列的比例,得到各菌属水平的相对丰度,据此绘制类群的比例条形图。用Mothur计算微生物群落的多样性和丰度指数(Chao,Ace,InvSimpson指数,Shannon指数)和各个样品微生物群落结构之间的比较。通过主坐标轴分析(PCoA),利用Bray-Curtis距离矩阵阐明样品间整体群落的差异。
1.5 数据统计分析
本文所有数据为3次重复的平均值± 标准差,试验所得数据采用Excel 2016和SPSS 19.0软件进行分析,不同处理间差异性分析采用LSD法进行多重比较,显著性水平为<0.05。
2 结果与分析
2.1 不同硫处理对土壤pH、有效态镉和硫的影响
从图1A可以看出,在试验进行的0 ~ 150 d,除对照处理(施硫0 g/m2)外,土壤pH均随硫磺剂量和时间的增加不断下降。在150 d时,与对照处理相比,180、360、720 g/m2硫磺处理的土壤pH分别降低了1.85、2.11和2.89个单位,硫磺处理土壤pH显著低于对照(图1A)。因此,中性土壤施用硫磺能够显著降低土壤pH,土壤pH的降低幅度与硫磺剂量和施加时间有关。本试验最高剂量硫磺处理(720 g/m2)土壤pH可以在150 d内从6.85降低到3.69,最大降幅达到3.16个单位;在试验进行的0 ~ 40 d,土壤pH范围是6.40 ~ 6.85,下降幅度略小,这与相关研究前30 d内土壤pH明显降低的结果不同[22],主要是因为本试验的前30 d是冬春季节,野外温度低,微生物活性低,所以硫磺氧化速度缓慢。在0 ~ 90 d所有硫磺处理土壤pH范围是5.53 ~ 6.85,不会发生过酸的土壤环境而抑制伴矿景天生长[6]。
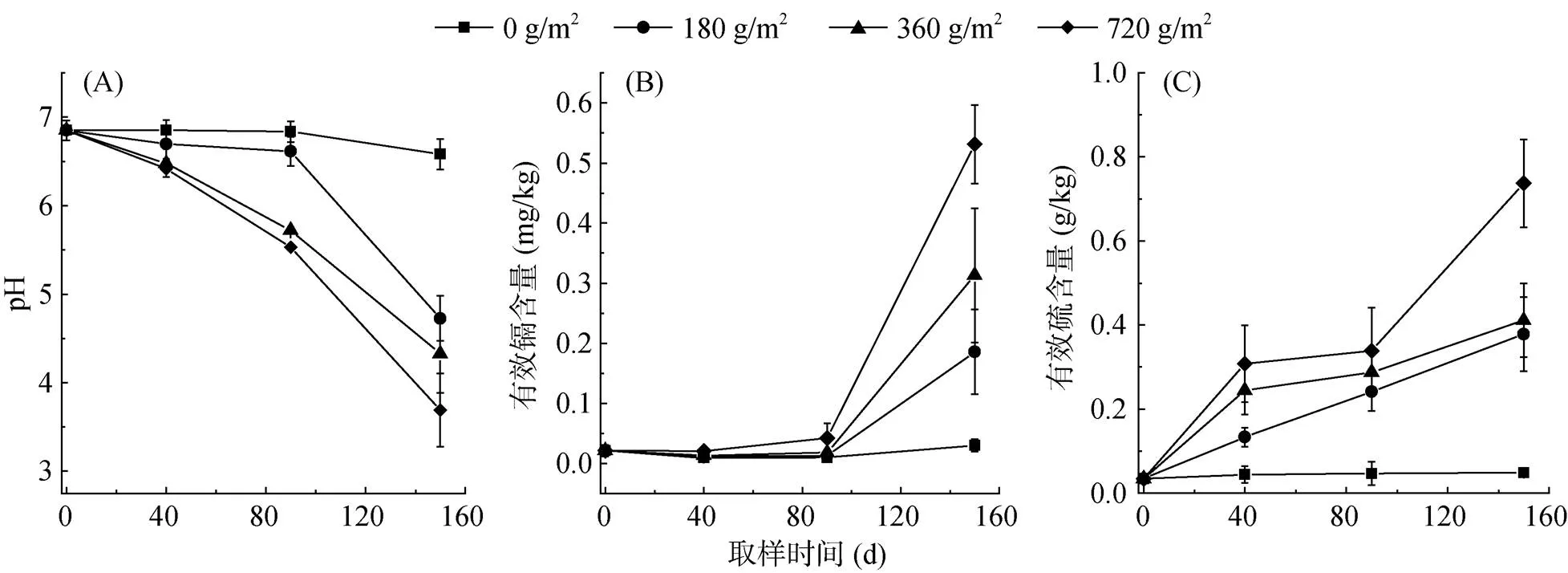
图1 不同硫处理土壤性质的变化
与对照处理相比,施硫处理土壤有效镉含量在0 ~ 90 d没有显著变化(图1B),但在90 ~ 150 d时土壤有效镉含量随施硫时间和用量的增加而增加。在150 d时,施硫180、360、720 g/m2处理,土壤有效镉含量分别达0.19、0.31、0.53 mg/kg,均显著高于对照,而此时土壤pH范围是3.69 ~ 4.73,显著低于对照(6.58)。土壤有效镉含量与土壤pH极显著负相关,与其他研究结果一致[23]。土壤有效镉含量在90 ~ 150 d时显著提高,有利于伴矿景天地上部对镉的吸收和积累。
硫磺在自然微生物的作用下被氧化产生硫酸根,增加土壤有效硫含量。从图1C可以看出,有效硫含量随着施硫时间和硫磺用量的增加而升高。在试验40 d时,硫磺处理土壤有效硫含量和对照差异显著。硫磺用量最高(720 g/m2)处理土壤有效硫含量在试验40 d和150 d时分别达0.31 g/kg和0.74 g/kg,分别是对照的7.0倍和15.0倍。所有硫磺处理土壤有效硫含量在90 ~ 150 d均呈上升趋势,且上升幅度大,表明硫磺氧化过程仍在进行且氧化速度快,这也与土壤pH在这一时段内下降幅度较大这一现象吻合。5月农田环境适宜的水分和温度条件更适合微生物的生长繁殖,提高了硫磺氧化速度。可见,随着施硫量增加和植物种植时间的延长,土壤pH逐渐下降,有效镉和有效硫含量则逐渐升高。
2.2 不同硫处理对伴矿景天生长和地上部镉吸收的影响
伴矿景天在土壤pH 4.5 ~ 8.5的范围内均能生长[6]。但当土壤pH过高时,土壤镉生物有效性低,会降低伴矿景天修复效率,当土壤pH过低时,强酸性的土壤环境不利于伴矿景天的生长。表2数据显示,各处理间伴矿景天地上部干物质量无显著差异,但是过高的硫磺处理会略微降低伴矿景天地上部干重,从而影响伴矿景天的修复效率。在伴矿景天收获时,360 g/m2硫磺处理土壤有效镉含量为0.31 mg/kg,伴矿景天地上部干物质量为653 g/m2,地上部Cd含量最高,为70.9 mg/kg,是对照(38.3 mg/kg)的1.85倍,同时修复效率也最高(19.4%),是对照(10.5%)的1.85倍;而720 g/m2硫磺处理土壤有效镉含量为0.53 mg/kg,伴矿景天地上部干物质量为530 g/m2,地上部Cd含量为51.4 mg/kg。这说明土壤中添加的硫磺剂量需要兼顾伴矿景天地上部生物量和土壤有效镉含量这两个因素,只有合适剂量的硫磺处理才能起到强化伴矿景天修复效率的作用,过高或者过低的硫磺剂量都会降低伴矿景天修复效率。
2.3 硫磺对土壤微生物群落的影响
2.3.1 微生物群落结构和多样性分析 本研究只选用修复效率最高的硫磺处理(360 g/m2)、对照处理(0 g/m2)及自然背景土壤(NS)进行微生物群落分析比较。PCoA分析结果表明,添加硫磺处理与对照处理土壤微生物群落在试验90 d时聚集在一起,但当试验时间达到150 d时,硫磺处理与对照处理土壤微生物群落相互分异(图2)。多样性分析也有相似的结果,和对照及自然土壤(NS)相比,微生物群落的丰富度指数Chao和Ace及多样性InvSimpson和Shannon指数,在硫磺处理90 d时无显著变化;但硫磺处理150 d后,微生物丰富度和多样性指数显著下降(<0.05)(表3)。这些现象说明硫磺氧化时间越长对微生物群落结构及多样性影响也越大,这可能是因为随着硫磺氧化时间的延长,土壤微生物的生存条件变化越来越大,特别是土壤pH。由于大多数微生物生长最佳pH范围很窄[24],并且不适合在强酸性环境生长。因此随着施硫肥时间的延长,土壤pH逐渐下降时,不适宜环境的微生物会逐渐消亡,进而使得土壤微生物群落结构及多样性发生改变。另外,由于土壤中的微生物对营养摄取及生长速率不尽相同,使得与硫代谢相关的微生物快速繁殖生长,而竞争能力差及无关的微生物逐渐被淘汰,这种选择性的刺激作用是土壤微生物群落对环境的适应性表现。

表2 不同硫处理对伴矿景天生长和镉吸收以及土壤镉去除的影响
注:同列数据后不同小写字母表示处理间差异达到<0.05 显著水平,下表同。土壤Cd去除率= (×1) / (2×103),为伴矿景天地上部干物质量(g/m2);1为伴矿景天地上部镉含量(mg/kg);2为每平方米耕层土壤Cd含量(239.4 mg),即镉全量(1.33 mg/kg)×耕层厚度(15 cm)×容重(1.2 g/cm3)×面积(10000 cm2)。

图2 各硫处理土壤中微生物群落在 97% 水平上的 OTUs 基于 Bray-Curtis 距离矩阵的PCoA分析
2.3.2 微生物群落组成及硫代谢细菌分析 硫磺是一种中性化学物质,它能以较低的成本有效地降低土壤pH[25]。土壤中硫磺的氧化反应主要是由包括硫杆菌在内的各种微生物介导的[26-28]。由图3可以看出,150 d硫磺处理(360 g/m2)土壤中的变形菌门(Proteocbacteria)比较丰富(46%),同时在变形菌门下检测到多种硫代谢相关的细菌(表4)。其中硫氧化菌属(sp.)属于嗜酸性氧化亚铁硫杆菌目(Acidiferrobacterales)。有研究表明该菌在生长过程中可以氧化单质硫和硫代硫酸盐获得电子,并且其最佳生长温度范围为42 ~ 45 ℃,但是最佳土壤pH为6.8 ~ 8.2[29]。因此,虽然硫磺处理为其提供了充足底物,但是150 d时的低pH可能抑制了该菌属微生物的生长,从而导致硫磺处理土壤中sp.数目要低于无硫磺处理。另外,硫单胞菌属(sp.)是可以将硫磺和硫代硫酸盐氧化为硫酸以获得电子进行化学无机营养生长的微生物,并且其要求土壤pH为2.7 ~ 6.8,温度为35 ~ 50 ℃,但最佳土壤pH为4左右[30-31],这就使得该菌在150 d硫磺处理(360 g/m2)土壤中含量要显著高于自然土壤(NS)和对照处理土壤,分别是两者的1 107倍和107倍。这可能主要是因为硫磺处理土壤pH为4.47,为微生物提供了一个强酸性和底物充足的生长环境。同样的原因导致可以氧化硫代硫酸盐为硫酸并且在土壤pH为2的条件下也能生长的罗丹诺杆菌属(sp.)[32-33]出现相同的变化趋势,即其含量在150 d硫磺处理土壤中要显著高于无硫磺处理,分别是自然土壤和对照处理土壤的153倍和44倍。这两种菌通过自身代谢加速了硫肥的氧化,降低了土壤pH,提高了土壤中镉的生物有效性,进而间接地促进了伴矿景天对镉的吸收。同时,硫肥氧化过程为这两种硫代谢菌提供了充足的底物和适宜的酸性条件,有利于菌的代谢和繁殖。以上结果说明,向土壤中添加硫磺不仅可以通过改变土壤理化性质,还可通过调节土壤中与硫代谢相关的功能微生物,提高土壤镉生物有效性,从而强化植物吸取重金属镉。

表3 不同时间各硫处理微生物群落多样性指数
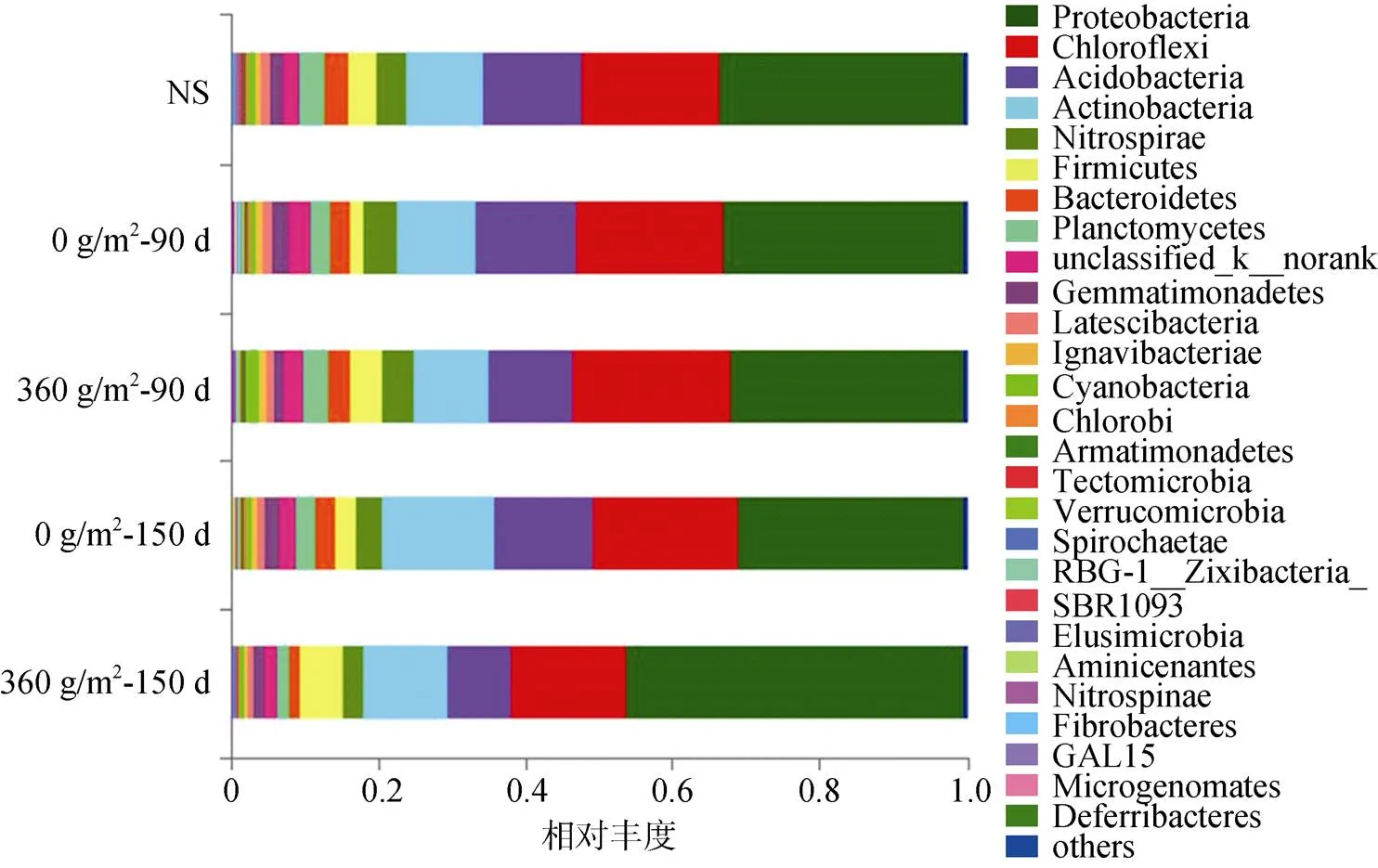
图3 各硫处理土壤中细菌门相对丰度的比较
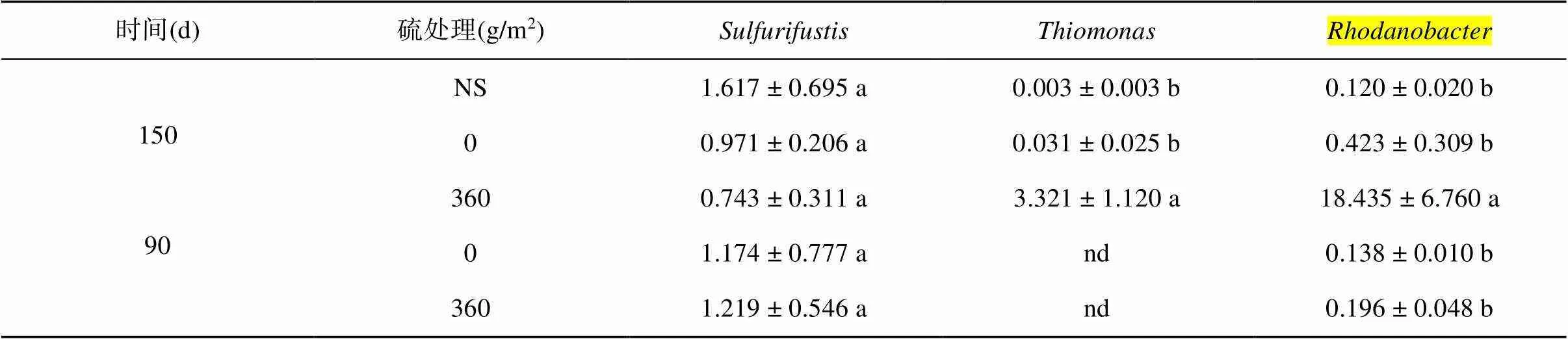
表4 各硫处理硫氧化细菌差异(OUT,%)
注:nd表示未检出。
3 结论
施硫可降低中性镉污染土壤pH、增加镉的生物有效性,进而提高伴矿景天的修复效率。本试验最佳施硫量为360 g/m2,伴矿景天地上部镉含量为70.9 mg/kg,耕层土壤全量镉去除率为19.4%,是对照(10.5%)的1.85倍。硫磺处理为土壤微生物提供了强酸性和底物充足的生长环境,硫磺氧化后期(150 d),与硫代谢相关的功能细菌和含量显著高于自然和对照土壤,表明适量硫磺添加是提高中性土壤镉污染植物吸取修复效率的有效措施。
[1] 麦麦提吐尔逊·艾则孜, 阿吉古丽·马木提, 买托合提·阿那依提, 等. 博斯腾湖湿地边缘带农田土壤重金属的污染风险评价[J]. 土壤, 2018, 50(2): 369–375.
[2] 陈宏坪, 戴碧川, 杨新萍, 等. 土壤与水稻籽粒镉含量相关性分析及水稻产地土壤镉临界值的研究[J]. 土壤, 2018, 50(2): 361–368.
[3] 陈卫平, 杨阳, 谢天, 等. 中国农田土壤重金属污染防治挑战与对策[J]. 土壤学报, 2018, 55(2): 261–272.
[4] Mahar A, Wang P, Ali A, et al. Challenges and opportunities in the phytoremediation of heavy metals contaminated soils: a review[J]. Ecotoxicology and Environmental Safety, 2016, 126: 111–121.
[5] Wu L H, Luo Y M, Liu Y J, et al.(): A new species from Zhejiang Province, China[J]. Plant Systematics and Evolution, 2013, 299(3): 487–498.
[6] Wu L H, Zhou J W, Zhou T, et al. Estimating cadmium availability to the hyperaccumulatorin a wide range of soil types using a piecewise function[J]. Science of the Total Environment, 2018, 637–638: 1342–1350.
[7] Anwar S, Khan S, Ashraf M Y, et al. Impact of chelator-induced phytoextraction of cadmium on yield and ionic uptake of maize[J]. International Journal of Phytoremediation, 2017, 19(6): 505–513.
[8] Attinti R, Barrett K R, Datta R, et al. Ethylenediaminedisuccinic acid (EDDS) enhances phytoextraction of lead by vetiver grass from contaminated residential soils in a panel study in the field[J]. Environmental Pollution, 2017, 225: 524–533.
[9] Khaokaew S, Chaney R L, Landrot G, et al. Speciation and release kinetics of cadmium in an alkaline paddy soil under various flooding periods and draining conditions[J]. Environmental Science & Technology, 2011, 45(10): 4249–4255.
[10] Fulda B, Voegelin A, Kretzschmar R. Redox-controlled changes in cadmium solubility and solid-phase speciation in a paddy soil as affected by reducible sulfate and copper[J]. Environmental Science & Technology, 2013, 47(22): 12775–12783.
[11] Hashimoto Y, Furuya M, Yamaguchi N, et al. Zerovalent iron with high sulfur content enhances the formation of cadmium sulfide in reduced paddy soils[J]. Soil Science Society of America Journal, 2016, 80(1): 55–63.
[12] Vassilev A, Schwitzguebel J P, Thewys T, et al. The use of plants for remediation of metal-contaminated soils[J]. The Scientific World Journal, 2004, 4: 9–34.
[13] Chen G L, Feng T, Li Z X, et al. Influence of sulfur on the arsenic phytoremediation using(.) hara[J]. Bulletin of Environmental Contamination and Toxicology, 2017, 99(3): 411–414.
[14] de Oliveira L M, Ma L Q, Santos J A G, et al. Effects of arsenate, chromate, and sulfate on arsenic and chromium uptake and translocation by arsenic hyperaccumulator[J]. Environmental Pollution, 2014, 184: 187–192.
[15] Saito K. Regulation of sulfate transport and synthesis of sulfur-containing amino acids[J]. Current Opinion in Plant Biology, 2000, 3(3): 188–195.
[16] Cui Y S, Dong Y T, Li H F, et al. Effect of elemental sulphur on solubility of soil heavy metals and their uptake bymaize[J]. Environment International, 2004, 30(3): 323–328.
[17] Martínez C E, Yáñez C, Yoon S J, et al. Biogeochemistry of metalliferous peats: sulfur speciation and depth distributions of dsrAB genes and Cd, Fe, Mn, S, and Zn in soil cores[J]. Environmental Science & Technology, 2007, 41(15): 5323–5329.
[18] 李光宇, 吴次芳. 土壤微生物研究在农田质量评价中的应用[J]. 土壤学报, 2018, 55(3): 543–556.
[19] 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000.
[20] 周健民, 沈仁芳. 土壤学大辞典[Z]. 北京: 科学出版社, 2013.
[21] 环境保护部. 农用地土壤污染风险筛选值和管制值(试行): GB 15618—2018 [S]. 北京: 中国标准出版社, 2018
[22] 林葆, 李书田, 周卫. 影响硫磺在土壤中氧化的因素[J]. 土壤肥料, 2000(5): 3–8.
[23] 曹胜, 周卫军, 罗思颖, 等. 酸碱度调节剂对稻田土壤中有效态镉的影响研究[J]. 中国农学通报, 2017, 33(30): 97–102.
[24] Ramirez K S, Craine J M, Fierer N. Nitrogen fertilization inhibits soil microbial respiration regardless of the form of nitrogen applied[J]. Soil Biology and Biochemistry, 2010, 42(12): 2336–2338.
[25] McKenna B A, Kopittke P M, MacFarlane D C, et al. Changes in soil chemistry after the application of gypsum and sulfur and irrigation with coal seam water[J]. Geoderma, 2019, 337: 782–791.
[26] Dowdle P R, Oremland R S. Microbial oxidation of elemental selenium in soil slurries and bacterial cultures[J]. Environmental Science & Technology, 1998, 32(23): 3749–3755.
[27] Wilderer P A, Flemming H C, Davids L. Microorganisms and their role in soil: Fundamentals and applications of bioremediation[M]. Routledge, New York, 2017: 283–332.
[28] Kato S. Biotechnological aspects of microbial extracellular electron transfer[J]. Microbes and Environments, 2015, 30(2): 133–139.
[29] Kojima H, Shinohara A, Fukui M.gen. nov., sp. nov., a sulfur oxidizer isolated from a lake, and proposal offam. nov. andord. nov[J]. International Journal of Systematic and Evolutionary Microbiology, 2015, 65(10): 3709–3713.
[30] Moreira D, Amils R. Phylogeny ofand other mixotrophic thiobacilli: Proposal forgen. nov[J]. International Journal of Systematic Bacteriology, 1997, 47(2): 522–528.
[31] Vésteinsdóttir H, Reynisdóttir D B, Orlygsson J.sp. nov., a moderately thermophilic, hydrogen- and sulfur-oxidizing betaproteobacterium isolated from a hot spring[J]. International Journal of Systematic and Evolutionary Microbiology, 2011, 61(Pt 1): 132–137.
[32] Lee C S, Kim K K, Aslam Z, et al.sp. nov., isolated from a biofilm on sulfur particles used in an autotrophic denitrification process[J]. International Journal of Systematic and Evolutionary Microbiology, 2007, 57(Pt 8): 1775–1779.
[33] van den Heuvel R N, van der Biezen E, Jetten M S M, et al. Denitrification at pH 4 by a soil-derived-dominated community[J]. Environmental Microbiology, 2010, 12(12): 3264–3271.
Sulfur Assisted Cadmium Phytoextraction byand Its Effect on Microbial Community in Neutral Paddy Soil
WU Guangmei1, 2, WANG Qingling1, HU Pengjie1, YANG Yuying1, DONG Bei1, ZHANG Xumei3, SHEN Wenzhong3, WU Longhua1 *, LUO Yongming1
(1 Key Laboratory of Soil Environment and Pollution Remediation, National Engineering Laboratory of Soil Pollution Control and Remediation Technologies, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China; 2 University of Chinese Academy of Sciences, Beijing 100049, China; 3Taicang Agricultural Technology Extension Center, Taicang, Jiangsu 215400, China)
Afield plot experiments was conducted to investigate the effects of sulfur(S) application on cadmium(Cd) phytoextraction by, soil properties and microbial community in neutral paddy soil. The results showed that soil pH decreased while available Cd and available S increased with time and S dosages. The treatment of S at 360 g/m2obtained Cd concentration of 70.9 mg/kg in shoots, which was enhanced by 85.1% compared to the control group (38.3 mg/kg). The removal rate of total Cd from surface soil was 19.4%, which was 1.85 times as high as that of the control group (10.5%). The relative abundance ofandin soil treated with 360 g/m2S at 150 day were significantly higher than those of natural and control groups. This study shows that adding appropriate amount of S to neutral soil can not only significantly improve Cd bioavailability in soil, but also enhance the efficiencies of phytoremediation by regulating the functional microorganisms related to S metabolism.
Sulfur; Cadmium;; Phytoremediation; Microorganisms
S19
A
10.13758/j.cnki.tr.2020.05.007
吴广美, 王青玲, 胡鹏杰, 等. 镉污染中性土壤伴矿景天修复的硫强化及其微生物效应. 土壤, 2020, 52(5): 920–926.
国家重点研发计划项目(2016YFD0801104)、江苏省科技计划项目(BE2017778)、苏州市产业技术创新专项农业科技创新项目(SNG2017076)和太仓市重点研发计划项目(TC2018SF06)资助。
吴广美(1993—),女,山东临沂人,硕士研究生,主要从事土壤污染与修复研究。E-mail: wgmnkymm@163.com

