基于药物亲和反应靶标稳定性技术的综合型实验探索
黄 瑾,吴丽莉,徐仲玉
(华东理工大学药学院,上海 200237)
0 引言
在我国全面推动实施高校“双一流”建设的战略背景下,提高本科教育人才的综合素质是新形势下高等教育实现内涵式发展的核心任务[1]。围绕这一核心任务开展的高等教育课程设计与教学实践需与时俱进,以任务目标为导向,开展相应的教学改革,设计重体验、易交互的课程教学内容是当前本科教学课程改革的主要方向[2-4]。
2018 新修订的“药学类专业教学质量国家标准”[5]中明确提出药学类专业人才培养需与药物研发、生产、流通、管理、质量控制和药学服务等相关。结合我国高等教育素质人才培养及药学专业人才培养要求,药物化学生物学作为药学专业人才培养的核心课程,在教学实践中将药物化学生物学实验新技术设计成多种综合型实验,推广并深入扎根到药学相关专业本科学生的学习及科研实践中,将有助于学生形成科学概念、认识科学规律、掌握科学方法[6-7]。在对本科生实验教学内容和低年级研究生的实验操作技能进行充分调研的基础上,以“科研反哺教学,教学促进科研”[8]的教学改革思想为出发点,将药物亲和反应靶标的稳定性(drug affinityresponsive target stability,DARTS)技术对小分子药物靶标进行验证的相关科研内容进行了系统梳理与整合,设计了在链霉菌蛋白酶作用下阳性小分子T0901317 有效增强RORγt靶标蛋白稳定性的综合型实验。
DARTS技术的概念由Lomenick等[9]于2009 年首次提出,可用于药物靶标的发现和鉴定。药物靶标是存在于生命机体内能与药物分子发生相互作用并产生药效的特定生物大分子,其发现与确定是新药研发的核心和关键[10]。DARTS技术通过观察小分子药物与蛋白酶处理后蛋白样品中受小分子药物保护的蛋白含量变化,可有效确证细胞内小分子药物与靶标蛋白之间的相互作用[11]。
经过近10 年的发展,DARTS 技术无需进行药物保护性修饰且无药物活性依赖性等优点引起了广大科研工作者的广泛关注,其在现代药物靶标发现和确证研究中的应用日益广泛,如白藜芦醇、雷帕霉素、双硫仑(disulfiram)等多个经典小分子药物的靶标蛋白已通过DARTS 技术确证[9,12-13]。然而这一新技术在本科教学实验中却鲜有涉及,为与时俱进,切实做好药学本科专业的实践教学工作,探索将该新技术应用于药物化学生物学实验教学实践,在实际教学中注重引导学生用理论知识来分析实验结果,优化实验条件。实践表明,实验整体流程规范严谨,有效激发了学生对于新知识新技术的强烈探索欲望,增强了学生的实验规范性操作意识,进一步拓展了学生的知识领域并提高了学生实践动手能力。
1 基于科研项目流程的DARTS 综合型实验原理及设计思路
1.1 DARTS实验原理
DARTS实验原理具体如下:在蛋白酶存在时,细胞内蛋白易被蛋白酶水解,而小分子药物与靶标蛋白结合后,由于疏水性、氢键或静电相互作用的变化常诱导靶标蛋白的构象形态改变,使靶标蛋白稳定性增加,蛋白酶对靶标蛋白的水解作用减弱[13](见图1)。因此通过观察蛋白酶处理后细胞样品中受小分子保护的蛋白含量变化,可发现小分子药物的潜在作用靶点,确证小分子药物与靶标蛋白的相互作用(见图2)。
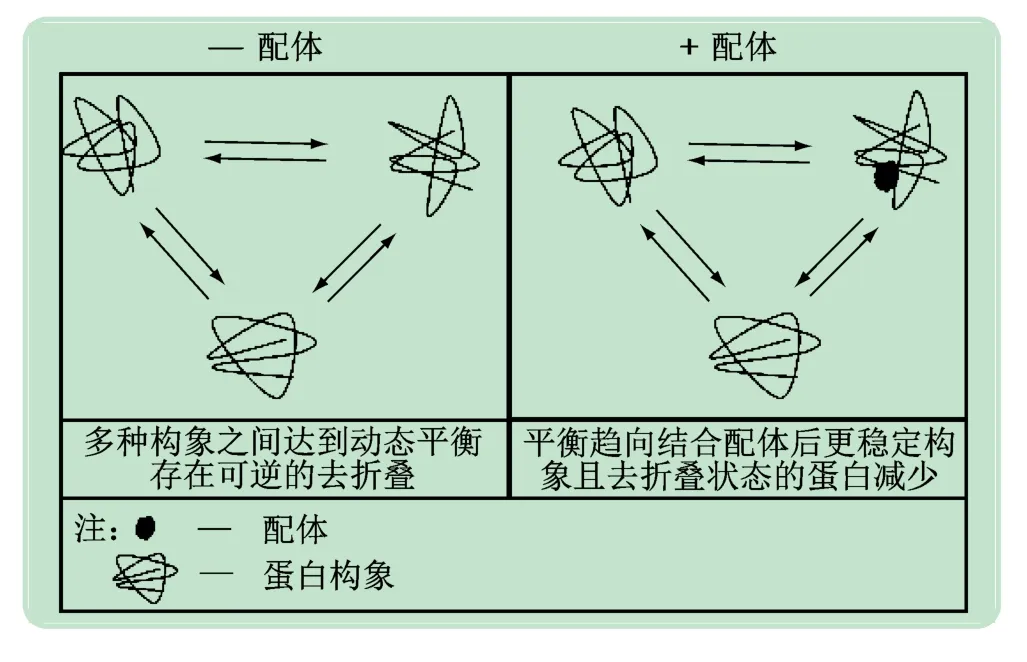
图1 小分子诱导靶标蛋白稳定性变化示意图
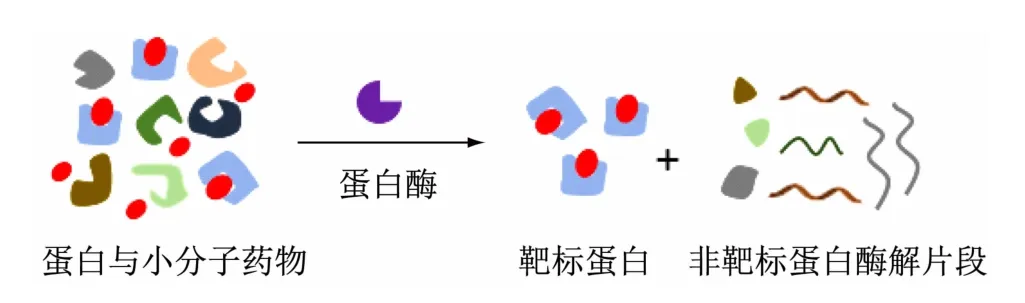
图2 DARTS原理示意图
1.2 DARTS综合型实验设计思路
综合考虑本科教学实验的可操作性,实验选用本课题组科研实验已多次验证过的RORγt 阳性小分子抑制剂T0901317 为活性小分子,以其在Jurkat细胞中可稳定维甲酸受体相关孤儿受体γt(RORγt)蛋白为基础,设计了教学案例,实验主要操作流程如图3 所示,具体实验过程分为细胞内蛋白提取与浓度测定、药物与蛋白结合、细胞蛋白混合物的酶解及靶标蛋白稳定性检测,整个实验过程安排8 学时,在实验过程中注重实际动手能力与合作精神的培养,因此安排以2 人为1 小组进行实验。
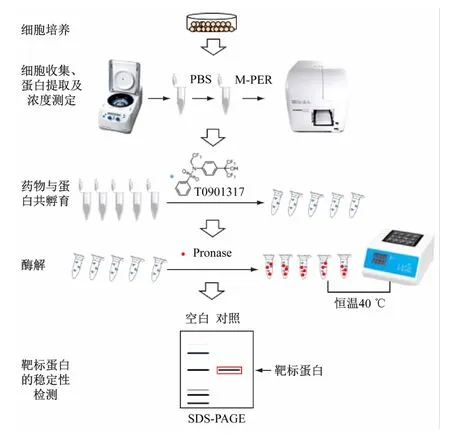
图3 DARTS实验操作流程图
DARTS 实验中,蛋白酶的选择是操作的关键之一。据文献报道,应用于DARTS实验的蛋白酶主要有枯草杆菌蛋白酶(subtilisin)、嗜热菌蛋白酶(thermoysin)与链霉菌蛋白酶(pronase)[14-16]。枯草杆菌蛋白酶在化工、医药和酿造等多个领域有较广泛的应用,但其成分复杂,且需在碱性条件下使用[17-18];嗜热菌蛋白酶在使用时需加入锌离子和钙离子维持酶结构的稳定,且主要酶解非折叠状态的蛋白质底物[19],常导致较高的假阳性[16];链霉菌蛋白酶在中性pH下具有较强活性,是现今DARTS 实验中优先使用的蛋白酶[20]。故本实验中选用链霉菌蛋白酶进行相关实验操作。
2 实验仪器及试剂
2.1 实验仪器
台式冷冻离心机Eppendorf5427R(艾本德中国有限公司);普通金属浴(上海硕盟生物技术有限公司);蛋白电泳仪EPS3000(上海天能科技有限公司);多功能酶标仪BioTeKSynergy Neo HTS(美国伯腾仪器有限公司)。
2.2 实验主要材料及试剂
人急性T淋巴细胞白血病细胞(Jurkat 细胞)(中科院上海生命科学研究院购);哺乳动物蛋白提取及非变性细胞裂解缓冲液(mammalian protein extraction reagent,M-PER)、PBS 磷酸缓冲液、蛋白Marker(Thermo Scientific 公司);改良型RPMI-1640 培养皿(美国Hyclone 公司);蛋白酶抑制剂、磷酸酶抑制剂(陶素生化有限公司);BCA 蛋白浓度测定试剂盒(上海翊圣生物科技有限公司);链霉菌蛋白酶(上海源叶有限公司);SDS-PAGE蛋白上样缓冲液(5X)、考马斯亮蓝染色液及脱色液(碧云天生物科技有限公司);12%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDSPAGE)预制胶(伯乐生命医学产品上海有限公司)。
3 实验步骤及注意事项
3.1 细胞内蛋白提取与浓度测定
Jurkat 细胞悬浮于含10%胎牛血清的改良型RPMI-1640 培养皿中,于95%湿度、37 ℃、5% CO2培养箱中培养,用细胞计数仪检测细胞密度,当细胞密度为2 ×106个/mL 时进行传代。细胞传代时,将含有Jurkat细胞的培养基1 500 r/min、5 min 离心,去旧培养基后重新加入新鲜培养基悬浮,1∶5传代至5 个T25瓶,添加完全培养基至10 mL/瓶即可。
于4 ℃、1 500 r/min、5 min 离心培养好的Jurkat细胞中加入适量预冷的PBS,吹匀后4 ℃、1 500 r/min、2 min离心进行细胞清洗,重复2~3 次。加入预冷的M-PER(含1%蛋白酶抑制剂与1%磷酸酶抑制剂),温和混匀置于冰上静置裂解15 min,12 000 r/min、4 ℃、离心10 min,取上清置于新离心管中,利用BCA蛋白定量试剂盒测定蛋白浓度。实验蛋白浓度用M-PER缓冲液稀释至1.5 g/L备用。
注意事项:为避免蛋白降解,所有操作需在冰上或4 ℃环境下操作。以上步骤的实验样品由教师提前准备完成。
3.2 药物与蛋白结合
按蛋白酶的加入与否,将上述提取蛋白(1.5 g/L)分为样品及对照组共7 组,每组200 μL,每组总蛋白300 μg。样品组分别加入终浓度0、1.25、2.5、5、10、20 μmol/L的小分子化合物T0901317,化合物浓度为0的样品组及对照组需加入等体积DMSO,混匀后于冰上孵育1 h,转移至40 ℃金属浴迅速升温。
3.3 细胞蛋白混合物的酶解
上述样品置于40 ℃金属浴上预热10 min,随后向各样品组中分别加入相应量的链霉菌蛋白酶PBS 溶液(链霉菌蛋白酶浓度为5 mg/mL,酶与蛋白质量比为1∶50),40 ℃金属浴上酶解15 min 后立即加入50 μL SDS-PAGE蛋白上样缓冲液终止酶解反应。
注意事项:链霉菌蛋白酶的最适酶解温度为40℃,小分子与蛋白混合物混匀后迅速升温至40 ℃有助于酶解反应,酶解反应结束时需立即取样用于后续实验。
3.4 靶标蛋白稳定性检测
靶标蛋白稳定性检测采用SDS-PAGE和考马斯亮蓝凝胶染色法进行。具体实验操作为:将预制的SDSPAGE胶板,放入蛋白电泳槽,每管样品取20 μL沸水中加热3 min离心后上样,电泳槽中加入缓冲液,接通电源后电泳,电泳结束后,取出胶板染色1 h后脱色至蛋白条带清晰,对蛋白质条带进行比较。本实验中,RORγt的蛋白分子量为30 kDa,选用12%的预制胶可以对25~35 kDa分子量的蛋白进行较好的分离。
注意事项:蛋白电泳结果是优化实验条件、分析实验结果的关键,因此在本部分实验过程中需重点关注以下实验细节:①搭置SDS-PAGE电泳凝胶装置后需对电泳槽进行检漏;②打开电泳装置电压前,需确保电泳槽正负电极是否连接正确;③电泳过程中需将电泳槽至于冰水浴中,并建议设置电压90 V、电流45 mA、120 min匀速跑至临近胶板底部,避免高电压产生的热量导致胶层变形。
4 结果与分析
4.1 蛋白酶浓度对DRATS实验结果的影响
向准备好的系列样品中加入不同浓度的链霉菌蛋白酶(酶与蛋白质量比1∶1、1∶10、1∶20、1∶30、1∶40、1∶50),参照酶解操作步骤进行酶解,于酶解15 min后立即取样电泳,染色、脱色后的胶图结果如图4所示。

图4 酶与蛋白质量比对酶解结果的影响
从图4 中可见,链霉菌蛋白酶可以水解蛋白混合物,蛋白质被水解的程度随酶浓度的提高明显增加。酶与蛋白质量比为1∶1、1∶10,1∶20,1∶30 时,蛋白几乎全部被水解;当酶与蛋白质量比为1∶50 时,酶解作用较温和,有稳定蛋白条带(如图中星号所指示)出现,故将酶与蛋白质量比1 ∶50 作为检测小分子化合物T0901317 与靶标相结合的最适酶解浓度。
4.2 蛋白酶解时间对DRATS实验结果的影响
参照酶解操作步骤,将酶与蛋白质量比设定为1∶50,改变酶解时间,分别于酶解35、30、25、20、15、10 min后立即取样电泳,染色、脱色后的胶图结果如图5所示。
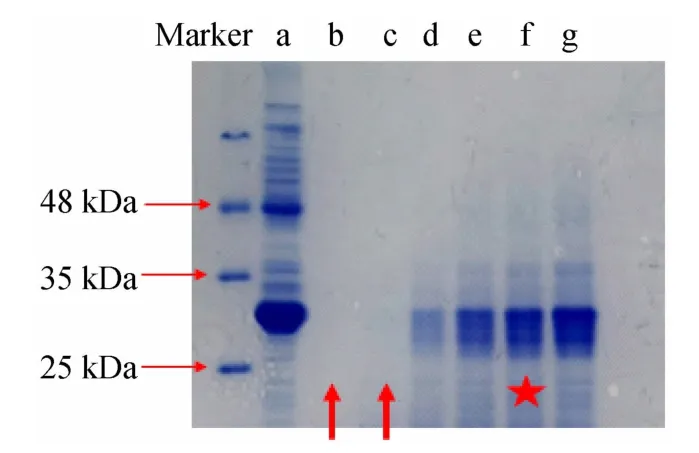
图5 酶解时间对酶解结果的影响
图5 显示当酶与蛋白质量比为1∶50 时,酶解时间超过25 min后,几乎所有的蛋白均被完全水解,未见条带(如图中箭头所指示),酶解10 min 时,剩余的蛋白条带较多,不利于实验结果的分析。酶解15 min 和20 min的结果无明显区别,考虑本科学生实验组别较多,为节约时间,故选用酶解时间为15 min 作为最适酶解时间。
4.3 小分子化合物T0901317 与靶标蛋白RORγt 相结合的检测实验
确定了酶解浓度与酶解时间后,将不同浓度小分子药物与细胞裂解液孵育、酶解后,通过SDS-PAGE检测小分子药物在细胞中的潜在作用靶标,SDS-PAGE实验结果如图6 所示。
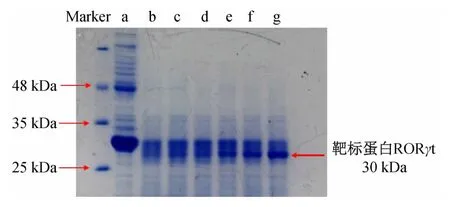
图6 不同浓度T0901317与细胞裂解液孵育酶解后SDS-PAGE结果
图6 结果显示,当酶与蛋白质量比为1∶50、酶解时间15 min时,可看到在30 kDa附近有一蛋白条带随T0901317 浓度的增加而变粗,说明了T0901317 可浓度依赖性地增加该条带蛋白的酶解稳定性。该条带蛋白已经过质谱鉴定为RORγt。
5 结语
为社会培养更多能从事药学基础性研究与创新药物研究,具有原始创新和产业研发能力的高级药学人才是现阶段高校药学专业人才培养的重要目标。药学是一门综合性及实践性均极强的学科,专业知识容量大,相关技术发展迅速,这一培养目标的实现需实时辅以专业课程尤其是实践类课程的全面改革提升,及时将科研前沿新知识转化为本科实践教学内容。DARTS技术在药物靶标发现及确证研究中的优势日益明显,有着日益广泛的应用。将DARTS 技术这一药物发现研究领域中的前沿成果引入本科实验教学,让学生了解及掌握这项药物研发新技术的起源、原理及实际应用,可有效丰富学生的专业理论知识、激发学习热情、提升发现问题及分析解决问题的能力,培养学生的自主创新意识。

