MRI征象鉴别IDH-1突变型与野生型较低级别胶质瘤
薛彩强,柯晓艾,邓娟,李昇霖,刘显旺,周俊林
1.兰州大学第二医院放射科,甘肃兰州730030;2.兰州大学第二临床医学院,甘肃兰州730030;3.甘肃省医学影像重点实验室,甘肃兰州730030
前言
脑胶质瘤作为成人颅脑最常见的原发性肿瘤,2016年WHO 在胶质瘤形态学分类基础上纳入了基因分型,将脑胶质瘤分为WHO I~Ⅳ级,随着级别升高,恶性程度不断增加[1]。WHO Ⅱ~Ⅲ级的胶质瘤,由于其肿瘤起源和胶质母细胞瘤不同,可以定义为较低级别胶质瘤[2-3]。异柠檬酸脱氢酶-1(Isocitrate Dehydrogenase-1, IDH-1)突变作为脑胶质瘤重要的分子标记,与患者预后及靶向治疗息息相关[4-5]。研究显示,超过70%的WHO Ⅱ~Ⅲ级胶质细胞瘤及由这些较低级别胶质瘤演变而来的胶质母细胞瘤中存在IDH 突变[3]。而关于较低级别胶质瘤IDH-1 突变型与野生型的MRI特征研究较少。通过研究较低级别胶质瘤IDH-1 突变型及野生型MRI征象,可以术前对肿瘤进行评估,为实现患者精准治疗及预后评测提供可能。本文将探讨MRI征象在术前对较低级别胶质瘤IDH-1 突变状态中的评估价值,旨在为IDH-l表型术前无创评估提供影像学预测手段。
1 资料与方法
1.1 一般资料
回顾性分析2016年3月~2019年9月经手术病理初次确诊的69 例较低级别胶质瘤的临床、病理及MRI资料。WHO Ⅱ级胶质瘤38例、WHO Ⅲ级31例。IDH-1 野生型34 例,其中男性19 例、女性15 例,年龄12~74 岁,平均45.3 岁;IDH-1 突变型35 例,其中男性26 例、女性9 例,年龄16~68 岁,平均41.5 岁。患者术前 均 行T1WI、T2WI、液体反转恢复序列(Fluid Attenuated Inversion Recovery, FLAIR)及T1WI增强序列扫描。
1.2 仪器与方法
采用Siemens Verio 3.0 T 超导MR 扫描仪,扫描参数:T1WI(GRE 序列)TR 550 ms,TE 11 ms,层厚及层间隔分别为5.0、1.5 mm,FOV 260 mm×260 mm,矩阵为256×256;T2WI(TSE序列)TR 2 200 ms,TE 96 ms,层厚及层间隔分别为5.0、1.5 mm,FOV 260 mm×260 mm,矩阵为256×256。T2WI-FLAIR,TR 9 000 ms,TE 110.0 ms,层厚及层间隔分别为5.0、1.5 mm,对比剂采用Gd-DTPA,静脉团注,0.1 mmol/kg,流率3.0 mL/s,扫描参数与平扫一致。
1.3 图像分析
由2 名10年以上神经影像诊断经验的医师以盲法进行阅片,意见分歧时经讨论达成一致。分别对肿瘤的位置、病变数目、直径(c 轴位最大径)、囊变坏死、肿瘤边界、出血、瘤周水肿、是否跨越中线、强化程度(轻、中、重度强化)进行分析。其中,根据肿瘤主体所占据脑叶位置,将肿瘤部位分为为额叶、颞叶、顶叶、枕叶及其他五部分。病变数目分为单或多发(2 个及以上)。肿瘤直径为实性部分轴位最大径。与脑脊液信号相类似的囊性病灶记录为囊变。肿瘤边界记录为清晰或模糊。水肿定义为在T2WI和T2WI-FLAIR 图像上呈高信号,增强扫描不强化区域,观察并记录水肿最大径。肿瘤强化程度:低于海绵窦为轻度强化,接近海绵窦但瘤内结构可辨认为中度强化,瘤内结构辨认不清为重度强化[6]。
1.4 病理分析
所有患者均行手术病理检查,切除标本经甲醛溶液固定后行HE 及免疫组化染色,并采用聚合酶链式反应(Polymerase Chain Reaction, PCR)扩增测序检测IDH-1突变状态。
1.5 统计学分析
对较低级别胶质瘤突变型及野生型肿瘤的MRI征象及临床资料使用SPSS 23.0 软件进行统计学分析。对2 名观察者对于MRI征象观测的一致性使用Kappa 检验,Kappa>0.6 为一致性高。进行组间比较时,计数资料采用卡方检验或Fisher 确切概率法,计量资料采用独立样本t检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 临床指标
经统计,较低级别胶质瘤IDH-1突变型与野生型在肿瘤的发病年龄、性别差异均不具有统计学意义(P>0.05),见表1、表2。
2.2 MRI定量及定性指标
两名神经专家意见在肿瘤位置、囊变坏死、边界、病变数目、瘤周水肿、出血、是否跨越中线、强化程度方面一致性高(Kappa 为0.774~1.000)。较低级别胶质瘤IDH-1 突变型发生于额叶、颞叶、顶叶、枕叶、其他部分分别占比为80%、20%、0、0、0,IDH-1 野生型分别占比为47%、12%、6%、12%、33%,差异具有统计学意义(P<0.05),突变型比野生型更好发于额叶。IDH-1 突变型强化程度为轻度强化、中度强化、重度强化分别占比约83%、14%、3%,而野生型分别占比约41%、44%、15%,差异具有统计学意义(P<0.05)。IDH-1 突变型坏死最大径(19.14±17.51)mm 大于野生型(10.62±12.43)mm,差异具有统计学意义(P<0.05)。两组间患者发病年龄、性别、病变个数、肿瘤边界、是否跨越中线、有无出血、肿瘤最大径、水肿最大径、囊变最大径等差异无统计学意义(P>0.05),见表1、表2。较低级别胶质瘤IDH-1突变型与野生型影像分别见图1、图2。
3 讨论
在既往研究中,人们曾认为胶质瘤的预后主要取决于组织病理学分级。随着分子病理学发展,人们发现特定分子分型对胶质瘤无进展生存期(Overall Survival,OS)具有显著影响[7]。分子分型比传统的组织病理学分级具有更为丰富的信息,对胶质瘤的个性化诊疗具有很大价值。IDH 突变状态已被证实可以用于胶质瘤的预后及治疗反应的预测。研究显示,IDH-1 突变与胶质瘤分级呈负相关,WHOⅡ级突变率77%,Ⅲ级55%,Ⅳ级6%,在较低级别胶质瘤中IDH-1 突变更为常见[8]。由于组织病理学分级和分子检测均需要采取侵入性措施(如活检、手术切除),利用无创手段进行肿瘤基因型检测的研究成为热点。其中MRI扫描是胶质瘤诊断及预后评估的重要辅助手段,可以提供丰富信息[9-10]。目前已经发现了部分MRI特征与IDH-1 突变状态具有密切关联,为利用无创手段对胶质瘤IDH-1突变状态进行分类提供了希望[11-12]。目前,关于IDH-1 突变型及野生型较低级别胶质瘤MRI特征的研究尚在探索状态。本文通过对比分析较低级别胶质瘤IDH-1 突变型及野生型MRI征象,为术前评估IDH-1 突变状态提供了新途径,为患者的精准治疗及预后预测提供帮助。
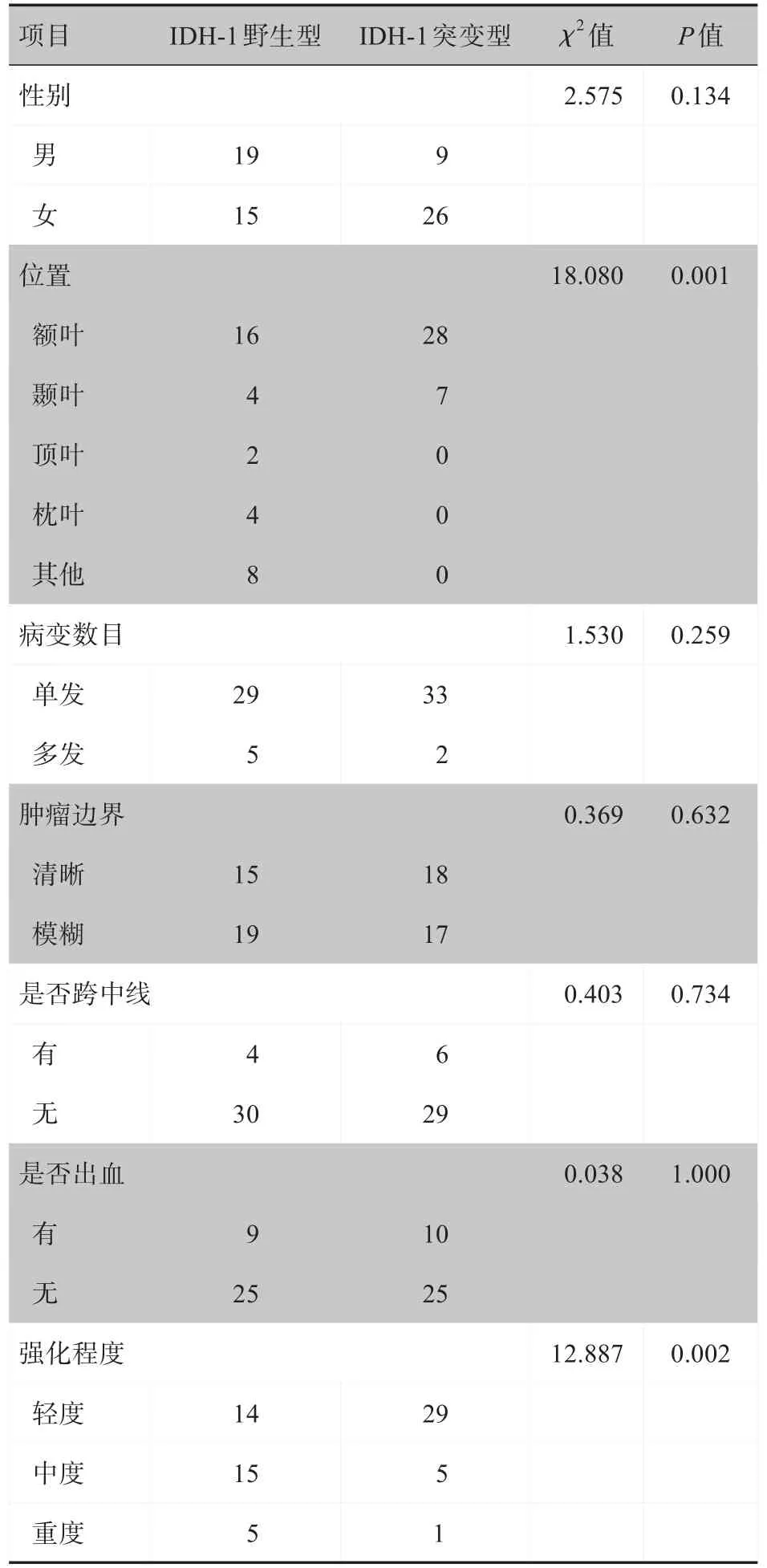
表1 IDH-1野生型与突变型较低级别胶质瘤患者主要定性指标Tab.1 Main qualitative indicators of lower grade glioma IDH-1 wild type and mutant patients
脑胶质瘤的位置与预后密切相关[13],而肿瘤的位置与其遗传特征之间具有关联。目前研究表明,IDH突变状态与肿瘤发生位置有关[13-15]。Sonoda等[14]发现,IDH 突变型的WHO Ⅲ级胶质瘤更好发于额叶,且突变型全部位于大脑皮层。Delfanti 等[15]对40 例较低级别胶质瘤分析后发现IDH 突变型肿瘤发生于额叶更为常见。本组研究中IDH-1 突变型较低级别胶质瘤均位于额叶、颞叶,而野生型好发于额叶之外,与文献报道一致。原因可能是IDH-1突变型胶质瘤起源于某种特定神经前体种群[16],而这种“起源细胞”可能分化能力有限,分化潜能主要限于侧脑室吻侧延伸部分[17]。由于IDH-1 突变型更多发生于额叶,手术更易于切除,因而患者预后更好。
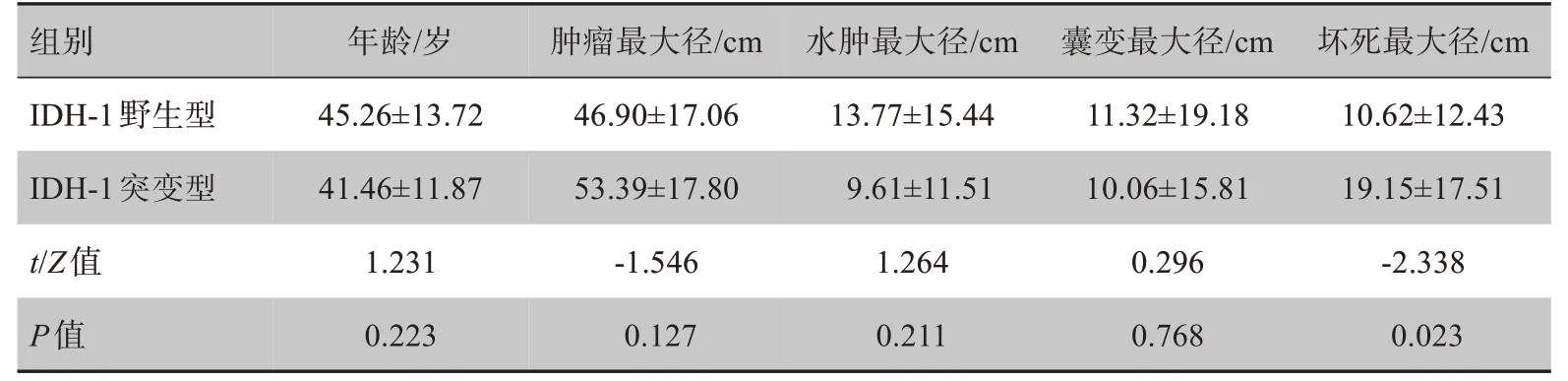
表2 IDH-1野生型与突变型较低级别胶质瘤患者主要定量指标Tab.2 Primary quantitative indicators of lower-grade glioma IDH-1 wild-type and mutant-type patients
在既往研究中,人们发现IDH突变状态与强化程度相关[13、18-19]。宋双双等[13]对92例IDH突变型及野生型胶质瘤MRI表现进行分析后发现,突变型比野生型强化程度更低,与Qi等[19]研究一致。本研究发现,较低级别胶质瘤IDH-1突变型比野生型强化程度更低,与既往文献一致。脑肿瘤的强化程度与微血管密度及肿瘤增殖浸润程度有关。有研究证明IDH突变型胶质瘤新生血管明显减少[20],而且IDH-1突变型具有相对更低的恶性生物学行为及更好的预后,以上可能导致了IDH-1 突变型强化程度相对较低。
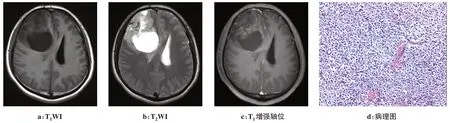
图1 患者男,38岁,右侧额叶间变性少突胶质细胞瘤IDH-1突变型Fig.1 A 38-year-old man:right frontal IDH-1 mutant type anaplastic oligodendroglioma
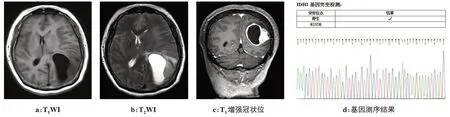
图2 患者女,54岁,左侧顶叶间变性少突胶质细胞瘤IDH-1野生型Fig.2 A 54-year-old woman:left parietal IDH-1 wild type anaplastic oligodendroglioma
在本研究中,较低级别胶质瘤IDH-1突变型坏死最大径大于野生型,差异具有统计学意义(P<0.05)。目前,较少研究表明坏死程度与IDH-1突变具有直接的相关性[18]。笔者考虑IDH-1 突变型坏死最大径直径更大可能与突变型新生血管减少,瘤体组织氧气及养分缺少有关,还需要进一步研究证实。
总之,较低级别胶质瘤的位置、强化程度、坏死最大直径对鉴别IDH1 突变型及野生型状态有一定临床价值,对较低级别胶质瘤精准治疗及预后评估具有重要意义。但是,本组病例数较少,且未采用功能成像序列,在增加病例数及纳入多模态磁共振成像技术后可增加结果可信性。

