抗α-1C微管蛋白抗体在系统性硬化症中的表达及临床意义
赵 静,孙 峰,李 云,赵晓珍,徐 丹,李英妮,李玉慧,孙晓麟
(北京大学人民医院风湿免疫科,北京 100044)
系统性硬化症(systemic sclerosis,SSc)是一种罕见的结缔组织病,以全身器官血管炎和纤维化为主,临床上主要表现为皮肤和内脏的硬化,SSc患病率约为1/10 000,是死亡率高的风湿病之一,肺间质纤维化和肺动脉高压是导致SSc死亡的主要并发症[1-2]。SSc发病机制复杂,多种细胞因子和自身抗体参与了SSc的发生、发展[3],其中一些已知的自身抗体,如抗着丝点抗体(anti-centromere antibodies, ACA)和抗Scl-70抗体等,在一定程度上对诊断和评价疾病有帮助,但这些抗体在自身免疫病中广泛存在,缺乏特异性,作用的机制尚不清楚[4]。SSc病情进展快,预后差,早期诊断和对症治疗至关重要。发现并确定特定的生物标志物,将有助于提高SSc的诊疗水平,尽早改善临床症状,及时缓解皮肤、脏器纤维化等并发症。
微管蛋白(tubulin)是细胞的一种骨架蛋白。微管蛋白超家族[5]包括6个不同的家族,即α,β,γ,δ,ε和ζ-微管蛋白。α和β-微管蛋白是微管的主要成分,而γ-微管蛋白在微管组装的成核中起主要作用。Tubulin-α-1C又称微管蛋白α-6[6],是α-微管蛋白家族成员之一,广泛表达于包括骨髓在内的27个组织中,tubulin-α-1C对维持细胞形态、物质运输和定位等起关键作用。早期抗tubulin抗体主要集中在神经精神疾病、感染和肿瘤中,在自身免疫病中的研究甚少。近年有研究发现,在系统性红斑狼疮(systemic lupus erythematosus, SLE)中抗tubulin-α-1C抗体升高,可能加重患者皮肤病变和血管炎症状,而在其他结缔组织病中,抗tubulin-α-1C抗体是否有同样的效应,没有进一步研究。本研究通过酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)检测了SSc患者、SLE患者、原发性干燥综合征(primary Sjögren’s syndrome, pSS)患者和健康人外周血中抗tubulin-α-1C抗体的表达水平,分析抗tubulin-α-1C抗体与SSc临床及实验室指标的相关性,并探讨抗tubulin-α-1C抗体在SSc诊断中的临床意义。
1 资料与方法
1.1 研究对象
本研究纳入2014年1月至2018年11月就诊于北京大学人民医院风湿免疫科的住院SSc患者62例为实验组,平均年龄(54.8±13.11)岁,其中男性5例,女性57例,入选患者均符合2017年美国风湿病学会/欧洲风湿病联盟联合发布的《系统性硬化症诊疗指南》中SSc新诊疗标准[7],其临床及实验室资料完善,同时排除合并心血管病及其他自身免疫病。选取年龄性别相匹配SLE患者38例、pSS患者24例以及体检中心的健康人(health control, HC)30例作为对照组。
本研究获得北京大学人民医院医学伦理委员会的批准(2018PHB147-01), 研究对象包括患者和健康人均签署知情同意书。
1.2 实验室和临床相关指标
记录患者临床和实验室指标,包括性别、年龄、病程、红细胞沉降率(erythrocyte sedimentation rate,ESR)、C反应蛋白(C-reactive protein, CRP)、免疫球蛋白A(immunoglobulin A, IgA)、免疫球蛋白M(immunoglobulin M, IgM)、免疫球蛋白G(immunoglobulin G, IgG)、补体C3、补体C4、类风湿因子(rheumatoid factor, RF)、抗核抗体(antinuclear antibody,ANA)、ACA、抗心磷脂抗体(anticardiolipin, aCL)、抗双链DNA抗体(抗dsDNA抗体)、抗Sm抗体、抗RNP抗体、抗Scl-70抗体、抗Ro-52抗体、抗SSA抗体、抗SSB抗体、着丝点蛋白A(centromere protein A,CENP-A)、着丝点蛋白B(centromere protein B,CENP-B)、雷诺现象等指标,用改良的Rodnan评分(modified Rodnan skin score, MRSS)评估SSc患者皮肤改变。检测前所有的血清样本均保存在-80 ℃冰箱。
1.3 血清中抗tubulin-α-1C抗体检测
用ELISA方法检测血清中抗tubulin-α-1C抗体的浓度。首先,用浓度为10 mg/L的重组tubulin-α-1C蛋白(Origene公司, 北京) 包被96孔板,放置在4 ℃过夜。用含0.05%(体积分数)吐温的磷酸缓冲盐溶液(phosphate buffer saline, PBS)洗4遍后,加入3% (体积分数)PBS稀释的牛血清白蛋白常温封闭3.5 h。血清用PBS 1 ∶100稀释后加入微孔板反应,加入酶标二抗,洗涤后加TMB(3,3’,5,5’-tetramethylben-zidine liquid substrate)显色液,室温避光反应10 min;每孔加入2 mol/L硫酸终止,10 min内放入双波长酶标仪(检测滤光片450 nm, 参考滤光片630 nm)中读取光密度(D)值。所有样品均做复孔,每板设置空白对照,同时为减少板间差异,设置标准血清对照,标准血清由10份SSc患者血清混合组成,所得D值换算成arbitary units(AU)值:
AU值=[待测血清(D抗tubulin-α-1C-D空白)/标准血清(D抗tubulin-α-1C-D空白)] ×100。
1.4 统计学分析
所有数据采用SPSS 16.0和GraphPad Prism 5软件处理,计量资料描述为均数±标准差,多组间比较先进行F检验,如果方差齐用LSD法两两比较,如果方差不齐用Dunett-t法进行比较;两组间差异的比较采用两独立样本t检验或Mann-WhitneyU检验;计数资料用率或构成比描述,组间率或构成比的比较采用卡方检验或Fisher确切概率法,双变量采用Spearman相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 抗tubulin-α-1C抗体在SSc、SLE、pSS及HC血清中的浓度比较

2.2 分析抗tubulin-α-1C抗体对于诊断SSc价值
绘制受试者工作特征(receiver operating characteristic, ROC)曲线,曲线下面积 (area under the curve, AUC)为0.805,对应的敏感性是43.55%~46.77%,特异性是86.54%。
2.3 SSc患者血清抗tubulin-α-1C抗体阳性组与阴性组间临床及实验室指标的分析
根据阳性阈值的设定将62例SSc患者分为抗tubulin-α-1C抗体阳性组(29例)和阴性组(33例),结果显示抗tubulin-α-1C抗体阳性组与抗tubulin-α-1C抗体阴性组间有多个实验室和临床指标存在明显差异,抗tubulin-α-1C抗体阳性组中抗Scl-70抗体、ACA、aCL的阳性率、ESR、雷诺现象明显高于抗tubulin-α-1C抗体阴性组,差异有统计学意义(P<0.05)。CRP、免疫球蛋白(IgA、IgG、IgM)、补体(C3、C4)及RF等水平差异无统计学意义(表1)。
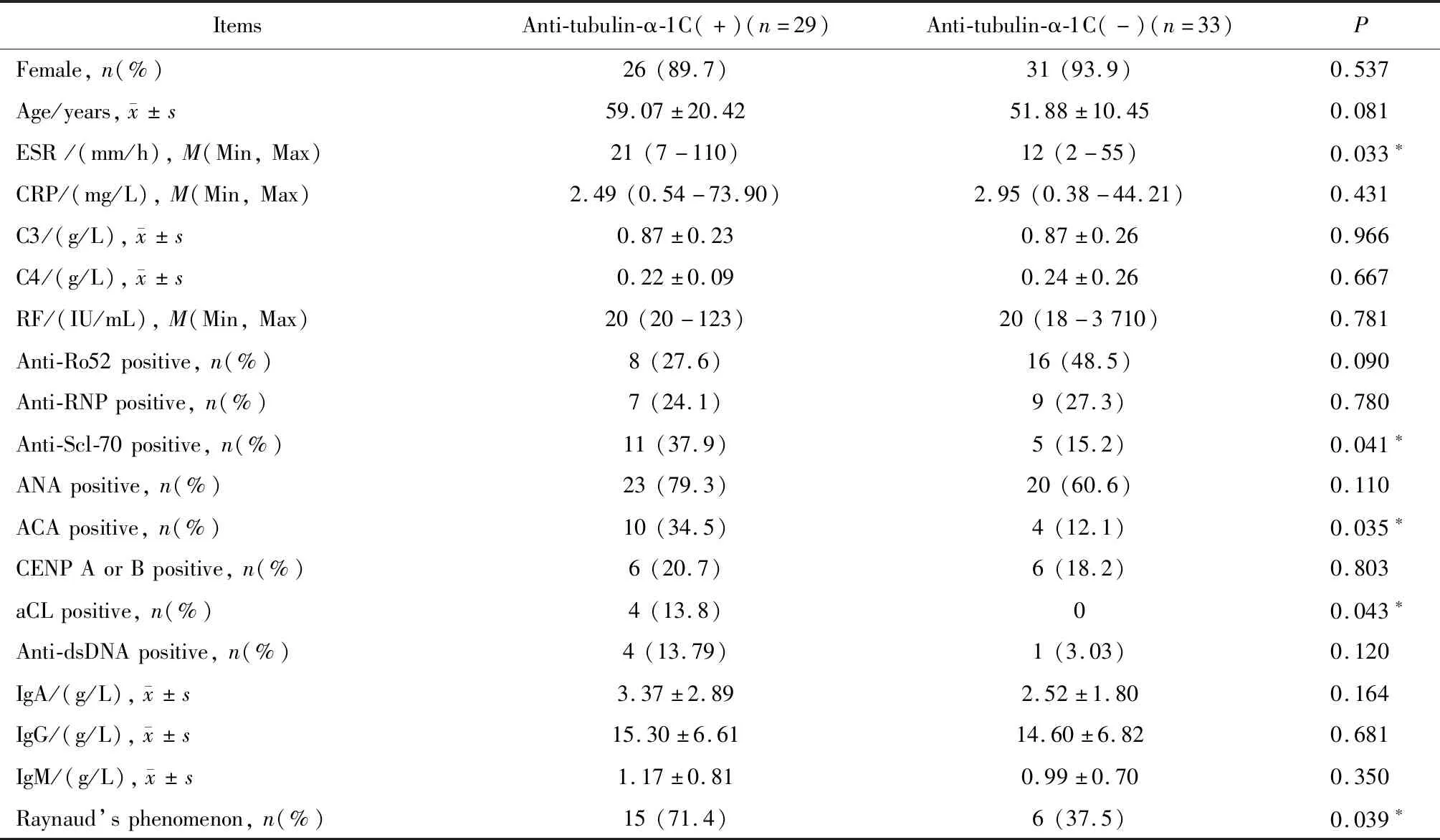
表1 抗tubulin-α-1C抗体阳性组与阴性组间实验室指标的比较Table 1 Clinical and laboratory characteristics of SSc patients with the elevated and normal levels of serum anti-tubulin-α-1C
2.4 SSc患者血清抗tubulin-α-1C抗体水平与实验室和临床指标相关性分析
对SSc患者的临床和实验室指标进行相关性分析,显示血清中抗tubulin-α-1C抗体水平与疾病活动指标相关:ESR (r=0.313,P=0.019)、MRSS (r=0.636,P<0.001),其他临床及实验室指标均无相关性(表2)。
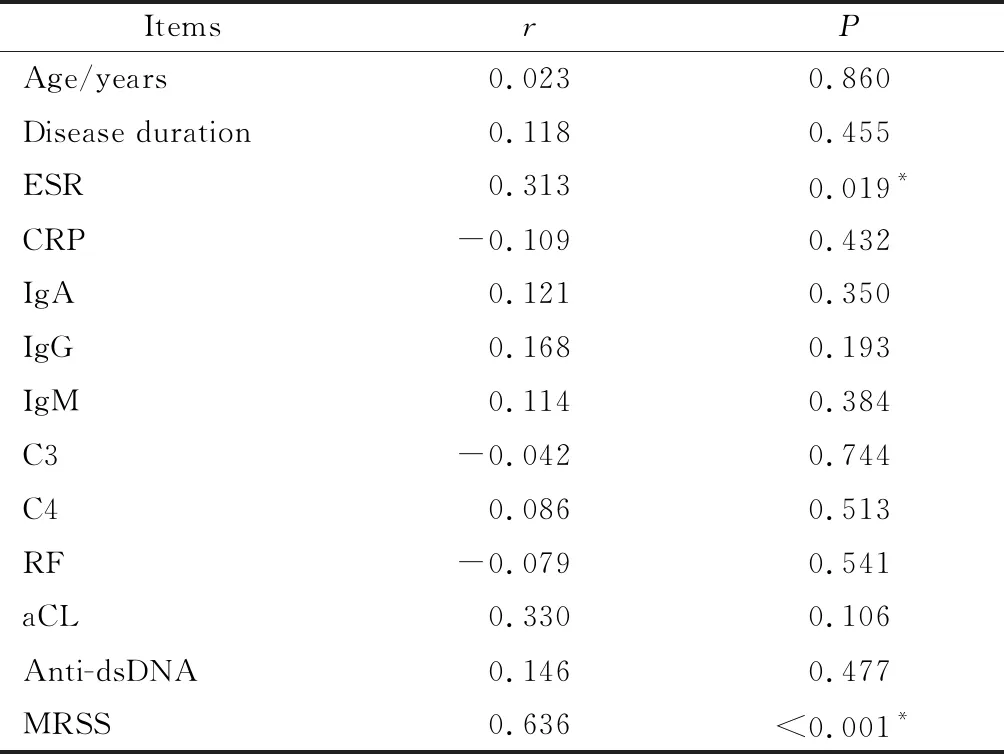
表2 血清抗tubulin-α-1C抗体与SSc患者其他临床和实验室指标间的相关性Table 2 Correlation of serum anti-tubulin-α-1C with clinical features of SSc patients
3 讨论
SSc以血管损伤、免疫功能失调及多器官纤维化为主要病理机制,最终导致皮肤及内脏器官过量纤维化,可导致严重的功能障碍和几乎所有内脏器官衰竭,严重影响患者的生活质量和生命安全。SSc的病因及发病机制十分复杂,目前研究主要包括遗传与环境因素、免疫的影响、胶原产生过度及成纤维细胞功能异常、血管功能异常等。微管蛋白是微管的基本单位,它构成细胞骨架的一部分,在细胞分裂过程中形成纺锤体纤维,有证据表明,抗微管蛋白抗体存在于包括人类在内的正常哺乳动物的血清中[8-12],但这些天然的抗微管蛋白自身抗体通常在体内含量很低[13],这些自身抗体异常升高常与其他器官特异性自身免疫性疾病有关,包括毒性弥漫性甲状腺肿(Graves病)、桥本甲状腺炎、脱髓鞘疾病等[14],患者自身的微管蛋白在炎症条件下从受损细胞中释放出来,可引发一系列自身免疫反应。抗tubulin-α抗体是针对微管蛋白分子成员之一tubulin-α的特异性自身抗体,早期仅在肺移植后的慢性同种异体排斥反应患者中观察到[8-9]。最新研究发现,在确诊的SLE患者血清中抗tubulin-α-1C抗体异常升高,并且升高的抗tubulin-α-1C抗体与SLE皮肤病变的发生率有关,包括皮疹和口腔溃疡[15]。
本研究中,我们测定和比较了SSc、SLE、pSS患者和健康对照者的血清抗tubulin-α-1C自身抗体水平。与pSS患者和健康对照组相比,抗tubulin-α-1C抗体在SSc患者血清中显著升高,但是和SLE区别不大。我们进一步揭示了这种新的自身抗体在SSc中的临床相关性,发现抗tubulin-α-1C抗体的升高与ESR和反映皮肤病变的MRSS有关。SSc炎症环境中存在大量受损或未清除的死亡细胞,细胞裂解释放出tubulin-α-1C,抗tubulin-α-1C抗体可能与释放的tubulin-α-1C形成免疫复合物,导致免疫复合物沉积,随后发生放大的炎症反应和组织破坏,促进胶原表达的细胞因子增多(如转化生长因子β、血小板源性生长因子等), 增加胶原和其他结缔组织大分子物质合成,沉积在结缔组织中,引起组织纤维化,出现皮肤和内脏损害的表现。
除通过免疫复合物形成的致病作用外,抗tubulin-α-1C与细胞表面抗原的直接结合也可能引起炎症反应。以往的研究显示抗Kα-1微管蛋白与上皮细胞结合可导致转录因子5(TCF5)的表达增加,TCF5是一种转录因子,参与炎症反应基因的调控和纤维增生级联[16-17],诱导下游促炎效应因子如血管内皮生长因子的表达,释放大量的炎症细胞和免疫介质。这些免疫介质刺激纤维母细胞,产生大量胶原及细胞外基质,沉积在组织中,加重组织损伤(如肺间质纤维化),并损伤血管内皮细胞,造成血管腔狭窄及闭塞,在疾病的早期出现雷诺现象。然而,抗tubulin-α-1C在SSc血管炎中的确切发病机制是否遵循上述相同的机制仍有待实验研究,下一步的组织培养或动物模型研究将用于解决抗tubulin-α-1C 在SSc血管炎发展中的作用。
本研究仅仅反映了抗tubulin-α-1C抗体在SSc中可能的临床意义,没有阐明具体的病理生理途径,进一步扩大样本并开展更深入的机制研究有可能为SSc的诊断及风险预测提供一个血清学标志的有益补充,并可能进一步揭示SSc发病机制中的重要环节。

