基于转录组测序的西瓜果肉硬度相关基因表达分析
郑雪梦 时月 王雪敏 马越 赵晓燕 张超
摘 要:以脆肉型‘京欣3号西瓜和硬肉型‘甜王西瓜为样品,评价果肉硬度表型差异,并利用转录组测序技术检测2个品种间差异表达基因。结果发现,‘甜王西瓜品种果肉硬度是‘京欣3号西瓜的1.9倍,表型与‘京欣3号西瓜具有显著性差异。转录组测序结果显示,与‘京欣3号西瓜相比,‘甜王西瓜样品有5 342个基因差异表达,其中2 360个基因上调表达,2 982个基因下调表达。差异基因主要注释在碳水化合物代谢、信号转导、脂质代谢等途径,其中与果肉硬度变化的候选基因主要包括果胶酯酶、果胶裂合酶、聚半乳糖醛酸酶、纤维素酶、纤维素合酶、β-半乳糖苷酶、β-葡萄糖苷酶、酸性几丁质酶、几丁质酶、木葡聚糖内转葡糖基酶/水解酶和脂氧合酶基因。钙调蛋白、乙烯反应转录因子、乙烯不敏感样蛋白、WRKY转录因子、MYC2转录因子、过氧化氢酶、呼吸爆发氧化酶和脱落酸受体PYR1参与果肉细胞活动信号转导,可能与果肉硬度相关。
关键词:西瓜;硬度;转录组;差异表达基因
中图分类号:S651 文献标识码:A 文章编号:1673-2871(2020)10-015-08
Abstract: Firmness of pulp is an important index for the sensory quality and shelf life of watermelon. In this study, watermelon (Citrullus lanatue) of ‘Jingxin No. 3 variety and ‘Tianwang variety were used to analyze the firmness and differentially expressed genes by transcriptome sequencing .‘Tianwang variety showed a different firmness phenotype to the ‘Jingxin No. 3 variety with the firmness 1.9 times of that of the ‘Jingxin No. 3 variety. Transcriptome sequencing analysis showed that, a total of 5 342 genes differentially expressed was detected in ‘Tianwang variety, of which 2 360 genes were up-regulated and 2 982 genes were down-regulated compared with ‘Jingxin No. 3 variety. Differential genes were mainly annotated in carbohydrate metabolism, signal transduction, lipid metabolism and other pathways. Candidate genes that may be related to the firmness of pulp were screened. Pectinase, Pectin lyase, polygalacturonase, cellulase, cellulose synthase, β-galactosidase, β-glucosidase, acid chitinase, chitinase, xylan endoglucanase/hydrolase and lipoxygenase genes participate in cell wall degradation. Calmodulin, ethylene reactive transcription factor, ethylene insensitive like protein, WRKY transcription factor, MYC2 transcription factor, catalase, respiratory burst oxidase and abscisic acid receptor PYR1 related genes were involved in signal transduction pathways and mediate the firmness of pulp.
Key words: Watermelon; Firmness; Transcriptome; Differentially expessed genes
西瓜是葫芦科西瓜属(Citrullus lanatus)植物,广泛种植于全球热带和亚热带地区。我国是西瓜的主要产区,2015年全国西瓜播种面积186万hm2,产量为7 714万t,占全球西瓜产量的67%[1]。目前,西瓜全基因组测序已经完成[2],促进转录组测序技术在西瓜表型方面的应用,现已在西瓜果皮颜色、果实糖分积累、乙烯调控、有机酸积累和果实品质形成等[3-8]关键基因定位均取得一定成绩。但是,转录组测序技术在西瓜果肉硬度方面的研究还鲜有报道。
西瓜果肉硬度是影响西瓜品质和货架期的重要因素[9-13],是一个多基因参与、多种代谢过程相互影响的复杂过程,与细胞壁和细胞膜的完整性,细胞内外的渗透压平衡等因素密切相关[14]。质构分析仪可以较为客观准确的反映果肉硬度表型,并廣泛应用于果蔬制品硬度测定,包括葡萄、莴笋、枣、甜瓜、西瓜等[15-19]。
目前,对西瓜果肉硬度的转录组测序研究主要集中在野生西瓜和栽培西瓜比对方面[19-21],笔者选择亲缘关系相近,但果肉硬度表型差异较大的脆肉型‘京欣3号西瓜和硬肉型‘甜王西瓜为试验材料,其中‘京欣3号西瓜果肉松脆,而‘甜王西瓜果肉较硬。研究以‘京欣3号西瓜作为对照组,比较果肉硬度表型间差异,并通过转录组测序分析差异表达基因参与的代谢途径,以期挖掘与西瓜果肉硬度相关的关键基因。
1 材料与方法
1.1 材料
供试西瓜品种为脆肉型‘京欣3号,京研益农(北京)种业科技有限公司提供;硬肉型‘甜王,育种和生产单位不详。试验选择新鲜、大小相近、无显著性机械伤的果实作为试验材料。
1.2 方法
1.2.1 西瓜果肉取样 试验于2019年9月在北京市农林科学院蔬菜研究中心加工楼实验室进行。首先用蒸馏水清洗果实表面灰尘,再在150 μL·L-1次氯酸钠溶液中清洗2 min,蒸馏水漂洗2次,静置沥水。在超净工作台下,将西瓜纵向切开,果肉切割成边长约3 cm的小果块,混合均匀,装入聚乙烯保鲜盒内,每盒约300 g,放置于4 ℃的冰箱中冷藏,随机抽取整块果块,混合取样,测定果肉硬度。在贮藏期第5天,随机抽取整块果块,混合取样,部分用于测定果肉硬度,其他果块使用液氮速冻,保存于-80 ℃冰箱备用。
1.2.2 果肉质构测定 使用 TA-XT plus 质构分析仪的 P/5 探头测定样品硬度:设定最小感知力 5 g,测试前速度 10 mm·s-1;测试速度 2 mm·s-1;测试后速度 10 mm·s-1,下压距离 10 mm,以下压过程中平均力大小代表硬度,每次测试位置均匀,每个样品取 5 个点,取平均值。
1.2.3 转录组测序 以‘京欣3号西瓜果肉作为CK组,‘甜王西瓜果肉作为HF(Hard flesh)组进行转录组测序,为确保转录组测序的准确性和可靠性,每个处理组作3次重复,分别标记为CK1、CK2、CK3、HF1、HF2和HF3。采用 TRIzol法提取西瓜总 RNA。转录组文库构建、高通量测序和序列组装工作均由上海美吉生物医药科技有限公司完成。
对各样本的对原始测序数据进行过滤,得到高质量的测序数据(clean data),与西瓜97103基因组(Watermelon_97103 ,http://cucurbitgenomics.org/organism/1)进行序列比对。使用软件RSEM对基因的表达水平进行定量分析,计算各基因的表达水平,定量指标为TPM(Transcripts Per Million reads)。利用DESeq2软件进行基因差异表达分析,以P adjust < 0.05 & |log2FC| ≥ 1为标准筛选差异表达基因(differentially expressed gene,DEG)。将差异表达基因与GO和KEGG数据库进行比对,对差异表达基因进行功能富集分析,采用软件 Goatools 进行GO富集分析,采用美吉自主研发流程对基因集中进行KEGG PATHWAY富集分析,以P adjust<0.05为阈值,满足此条件则认为此GO功能/KEGG通路存在显著富集情况。
1.3 数据分析
采用Microsoft Excel进行数据整理,利用SPSS 26.0 进行统计分析,采用Duncan新复极差法对数据进行显著性检验,采用Origin 9.0 软件绘制图像。
2 结果与分析
2.1 西瓜果肉硬度表型分析
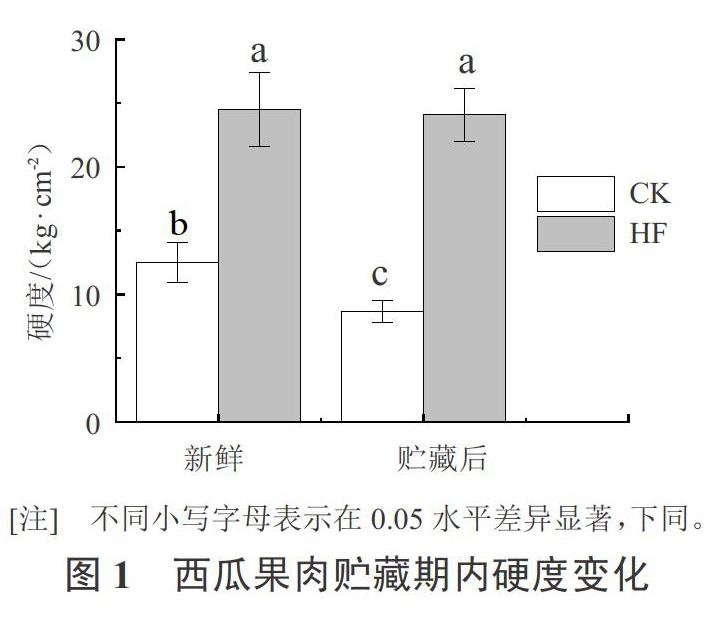
图1显示,‘京欣3号西瓜和‘甜王西瓜在贮藏期期间硬度变化情况。‘京欣3号西瓜和‘甜王西瓜具有相同的母本,属于近缘品种,‘京欣3号西瓜果肉松脆,而‘甜王西瓜果肉较硬。测定结果显示‘甜王西瓜果肉硬度显著高于‘京欣3号西瓜,是‘京欣3号西瓜果肉硬度的1.9倍;在贮藏期间,‘甜王西瓜果肉硬度未见显著性变化,而‘京欣3号西瓜的果肉硬度有显著性的降低。因此,‘甜王西瓜果肉硬度表型与‘京欣3号西瓜具有显著性差异。
2.2 转录组数据质控分析
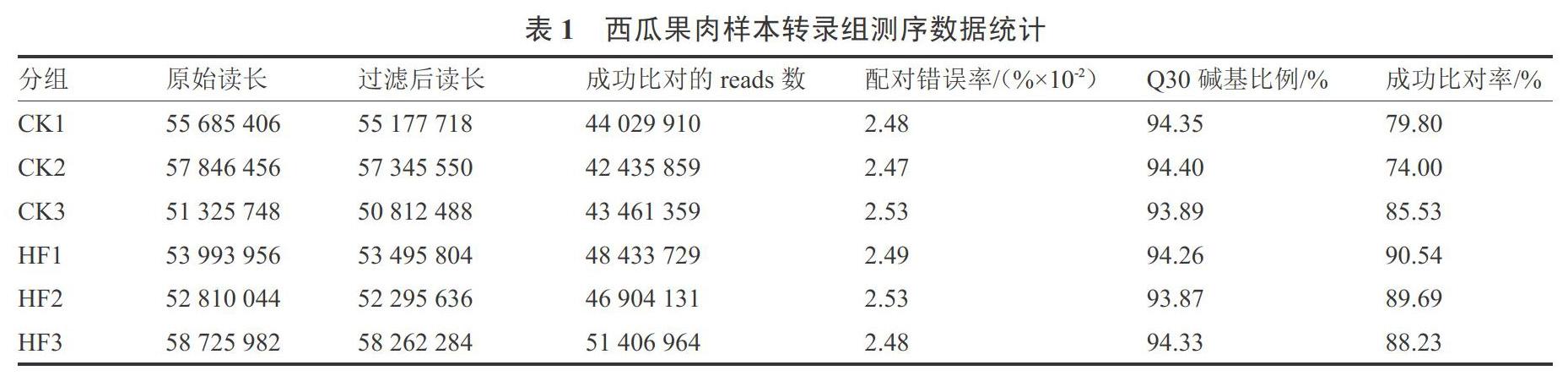
通过Illumina平台对‘京欣3号西瓜、‘甜王西瓜果肉样本测序(表1),使用SeqPrep和Sickle软件对原始测序数据进行质控,使用TopHat2和HISAT2软件将质控后的clean reads与参考基因组比对,获得用于后续转录本组装、表达量计算等的 mapped reads,对转录组测序的比对结果进行质量评估。表1显示,6个样品共获得 330 387 592个原始数据,通过过滤和质量控制的原始数据共产出327 389 480个的clean reads,并且配对错误率均小于0.025 3%,Q30碱基比例在93.87%以上,与参考基因组的比对率在74.00%以上,比对效率较高。因此,6个西瓜样本转录组测序数据质量较好,可以用于后续生物学分析。
2.3 基因表达量分析
通过相关性热图,对样本间基因表达量的生物学重复相关性进行评估,将皮尔逊相关系数r作为评估指标,r2越接近1,说明2个重复样品相关性越强。图2显示,每个样本间的3次生物学重复的相关性较强,其中CK组样本的3个组间重复相关性最好。同时,对6个样本的基因表达量进行主成分分析,找出离群样本,判别相似性高的样品簇。如图3所示,相同处理的样本之间聚集在一起,相似度较高,而不同处理之间基因表达差异显著,分别形成不同的集群,与图2结果一致。
2.4 差异表达基因分析
通过对不同西瓜样本的表达基因进行比较,筛选出差异表达基因。将FC(差异倍数)≥2且P adjust < 0.05作为筛选标准,差异表达基因的数目统计如表2所示,2组间共有5 342个基因差异表达,其中2 360个基因上调表达,2 982个基因下调表达。差异基因火山图(图4)可以简明地看出各组别的差异基因分布。
2.5 差异表达基因的GO功能富集
GO(Gene Ontology, http://www.geneontology.org/)是基因本体论联合会建立的将全世界所有与基因有关的研究結果进行分类汇总的综合数据库,利用GO数据库,可以将基因按照它们参与的生物学过程、构成细胞的组分和实现的分子功能进行分类。如图5所示,对富集程度前20的GO term做散点图,差异基因显著富集在寡糖的生物合成过程(14个)、海藻糖代谢过程(12个)、二糖生物合成过程(12个)、海藻糖的生物合成过程(11个)、含磷酸盐的化合物代谢过程(389个)、磷代谢过程(391个)、寡糖代谢过程(19个)、二糖代谢过程(17个)、转录调节活性(102个)、磷酸化(284个)、转移酶活性(674个)方面。
2.6 差异表达基因的KEGG富集分析
利用 KEGG (Kyoto Encyclopedia of Genes and Genomes,http://www.genome.jp/kegg/)数据库,可将基因按照参与的pathway通路分类,通过对代谢通路的分析,更好地揭示差异表达基因的生物学功能。对‘京欣3号西瓜与‘甜王西瓜的差异表达基因进行功能富集分析,共富集到131个代谢通路中,选择富集程度较前的代谢通路散点图(图6)展示。差异基因在DNA复制(23个)、果糖和甘露糖代谢(25个)、甘油脂代谢(25个)、半乳糖代谢(23个)、N-聚糖生物合成(14个)、精氨酸和脯氨酸代谢(18个)、MAPK信号传导途径-植物(44个)、丙氨酸,天冬氨酸和谷氨酸代谢(18个)、氨基糖和核苷酸糖代谢(40个)、磷酸戊糖途径(16个)、植物激素信号转导(83个)、糖酵解/糖异生(33个)、植物病原体相互作用(45个)、淀粉和蔗糖代谢(47个)通路富集。
2.7 与果肉硬度相关的候选基因筛选
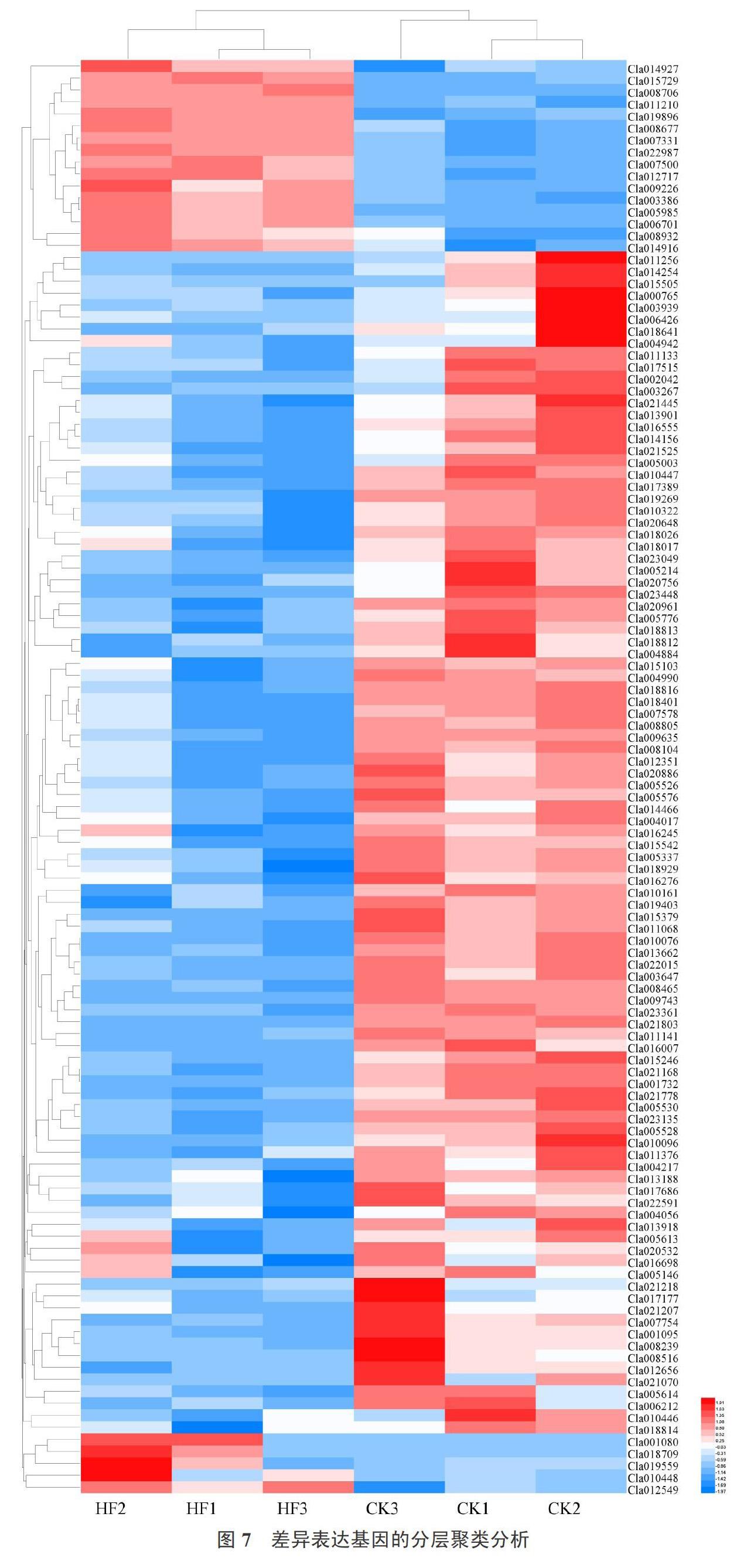
如表3所示,根据‘京欣3号西瓜和‘甜王西瓜样品差异基因的表达情况,筛选了一些与果肉硬度有关的基因。对筛选出的差异表达基因做层次聚类分析,如图7所示,将具有相同或相似表达模式的基因进行聚类,图中每列表示1个样本,每行表示1个基因,图中的颜色表示该基因在每个样本中标准化处理后的表达量值,可以看出多数候选基因在‘京欣3号西瓜样本中有更高的表达,具体基因注释详情见表3。
果膠酯酶、果胶裂合酶、聚半乳糖醛酸酶、纤维素酶、纤维素合酶、β-半乳糖苷酶、β-葡萄糖苷酶、酸性几丁质酶、几丁质酶、木葡聚糖内转葡糖基酶/水解酶、脂氧合酶基因参与细胞壁降解,且大部分基因在‘京欣3号西瓜果肉中有更高的表达,这可能是造成2个品种西瓜果肉硬度差异的主要原因。此外,还发现一些与信号转导相关的钙调蛋白、乙烯反应转录因子、乙烯不敏感样蛋白、WRKY转录因子、MYC2转录因子、过氧化氢酶、呼吸爆发氧化酶、脱落酸受体PYR1基因在2个样本间也有较大差异,这可能是因为信号分子与受体结合后,激活细胞内生化反应,介导细胞活动,进而对果肉硬度造成影响。
3 讨论与结论
硬度是衡量西瓜果实感官和商业品质的重要指标。如果肉质太硬,则汁液偏少,口感较差;如果肉质过于酥松,则口感绵软,爽口度下降,且不耐贮藏,货架期短[6]。在本研究中,‘甜王西瓜果肉硬度是‘京欣3号西瓜果肉硬度的1.9倍,同时发现有2 360个上调基因和2 982个下调基因,与KEGG数据库比对发现,差异基因注释在碳水化合物代谢、脂质代谢、信号转导、聚糖的生物合成与代谢、氨基酸代谢、核苷酸代谢方面。碳水化合物代谢可能是造成细胞壁降解的主要原因,细胞壁降解与水果软化紧密相关,差异基因可能是通过参与果实碳水化合物代谢影响果实硬度。
植物细胞壁降解涉及原细胞壁和中层膜的一系列协调多糖修饰,果胶质是构成细胞壁和胞间层的主要成分,木葡聚糖是植物细胞壁半纤维素的主要成分,几丁质是高等植物细胞壁中除纤维素外的重要多糖。果胶酯酶、多聚半乳糖醛酸酶、β-半乳糖苷酶、纤维素酶是植物细胞壁降解的关键酶,参与果实软化。Chen等[22]发现,冷藏可以抑制PG、纤维素酶、β-半乳糖苷酶和α-甘露糖苷酶的酶活性,延缓果胶解聚,进而延缓蓝莓果实软化。沈颖等[23]发现,原果胶的降解和纤维素的水解是甜樱桃果实软化的关键因素。在本研究中发现果胶酯酶、果胶裂合酶、聚半乳糖醛酸酶、纤维素酶、纤维素合酶、β-半乳糖苷酶、β-葡萄糖苷酶、酸性几丁质酶、几丁质酶、木葡聚糖内转葡糖基酶/水解酶、脂氧合酶基因参与细胞壁降解,且大部分基因在‘京欣3号西瓜中有更高的表达。
脂氧合酶参与植物脂肪酸氧化,与植物的抗病和抗伤害反应密切相关。钙调蛋白可以调节细胞内钙离子的浓度,介导细胞活动。乙烯响应转录因子是植物中广泛存在的转录因子,对植物的生长发育、次生代谢过程和植物的抗胁迫能力具有重要的调控作用[24]。Gao等[19]对‘PI186490和‘Sanbai品种不同的成熟阶段的西瓜果肉转录组测序分析,发现除果胶酯酶基因、聚半乳糖醛酸酶、果胶酸裂合酶、糖基转移酶基因、纤维素合酶、β-半乳糖苷酶基因、木葡聚糖转移酶外,脂氧合酶基因、植物激素、转录因子的差异表达与西瓜果实的成熟和软化有关。类似的,在本研究中发现钙调蛋白、乙烯反应转录因子、乙烯不敏感样蛋白、WRKY转录因子、MYC2转录因子、过氧化氢酶、呼吸爆发氧化酶、脱落酸受体PYR1相关基因参与信号转导,介导果肉细胞活动,可能与2个品种西瓜果实的硬度表型有关。
西瓜果肉的硬度是一个多基因参与、多种代谢过程相互影响的复杂过程,研究结果从转录水平为解析货架期西瓜果肉硬度变化的分子机理提供参考,为挖掘西瓜硬度相关的关键功能基因提供基因资源。
参考文献
[1] 中华人民共和国农业部.中国农业统计资料(2015)[M].北京:中国农业出版社,2016.
[2] GUO S,ZHANG J,SUN H,et al.The draft genome of watermelon (Citrullus lanatus) and resequencing of 20 diverse accessions[J].Nature Genetics,2013,45(1):51-58.
[3] 杨侃侃.基于RNA-seq技术对西瓜果皮色泽差异表达基因的分析[D].南昌:江西农业大学,2015.
[4] 任毅.西瓜果实含糖量QTL定位及糖转运蛋白基因功能初析[D].北京:中国农业科学院,2016.
[5] 周明.西瓜果实成熟乙烯调控的生理及分子机制初探[D].北京:中国农业科学院,2017.
[6] 高磊.西瓜果肉硬度和酸味性状的转录组分析及主效基因的精细定位[D].北京:中国农业科学院,2018.
[7] 王准,郭绍贵,许勇,等.栽培西瓜与野生西瓜果实发育过程中的转录组比较分析[J].中国瓜菜,2019,32(8):202.
[8] 丁双玉,许勇,郭绍贵,等.西瓜果实发育过程中转录组的初析[J].中国瓜菜,2019,32(8):182-183.
[9] PERKINS-VEAZIE P,COLLINS J K.Flesh quality and lycopene stability of fresh-cut watermelon[J].Postharvest Biology & Technology,2003,31(2):159-166.
[10] MAO L,JEONG J,QUE F,et al.Physiological properties of fresh-cut watermelon (Citrullus lanatus) in response to 1-methylcyclopropene and post-processing calcium application[J].Journal of the ence of Food & Agriculture,2006,86(1):46-53.
[11] GONZALEZ M E,JERNSTEDT J A,SLAUGHTER D C,et al.Influence of cell integrity on textural properties of raw,high pressure,and thermally processed onions[J].Journal of Food science,2010,75(7):409-416.
[12] 張超,蔡文倩,李云飞,等.1-MCP处理对不同品种鲜切西瓜品质的影响[J].农产品加工,2015(17):1-4.
[13] 时月,张慧君,马越,等.货架陈列期红光照射延缓鲜切西瓜品质劣变[J].中国瓜菜,2018,31(6):11-15.
[14] 姚佳,胡小松,廖小军,等.高静压对果蔬制品质构影响的研究进展[J].农业机械学报,2013,44(9):118-124.
[15] 朱丹实.葡萄采后软化机制及风味劣变的研究[D].沈阳:沈阳农业大学,2014.
[16] 姚佳.超高压下莴笋质构的变化及机制研究[D].北京:中国农业大学,2014.
[17] 赵爱玲,薛晓芳,王永康,等.质构仪检测鲜枣果实质地品质的方法研究[J].果树学报,2018,35(5):631-641.
[18] 潘好斌.薄皮甜瓜果实质地品质综合评价及质地差异分析[D].沈阳:沈阳农业大学,2019.
[19] GAO Y,GUO Y,SU Z,et al.Transcriptome analysis of genes related to fruit texture in watermelon[J].Scientia Horticulturae,2020,262:109075.
[20] ZHU Q,GAO P,LIU S,et al.Comparative transcriptome analysis of two contrasting watermelon genotypes during fruit development and ripening[J].BMC Genomics,2017,18(1):3.
[21] GUO S,SUN H,ZHANG H,et al.Comparative transcriptome analysis of cultivated and wild watermelon during fruit development[J].PLoS One,2015,10(6):e0130267.
[22] CHEN H,CAO S,FANG X,et al.Changes in fruit firmness,cell wall composition and cell wall degrading enzymes in postharvest blueberries during storage[J].Scientia Horticulturae,2015,188:44-48.
[23] 沈颖,李芳东,王玉霞,等.甜樱桃果实发育过程中细胞壁组分及其降解酶活性的变化[J].果树学报,2020,37(5):65-74.
[24] 蔡玉迎,宫钰,王娟,等.苹果中乙烯响应转录因子基因的克隆及序列分析[J].中国园艺文摘,2018,34(4):8-10.

