α-生育酚脂质体的配方优化及其稳定性分析
徐伟丽,朱元昊,张玉琪,唐寅朝,韩晓军
(1.哈尔滨工业大学 化工与化学学院,哈尔滨 150001; 2.城市水资源与水环境国家重点实验室 (哈尔滨工业大学),哈尔滨 150001)
α-生育酚(α-tocopherol,α-TOC)是动物生长发育过程中必需的脂溶性维生素[1],具有很强的抗氧化性及抗癌、防衰老、增强免疫力等生理功能[2],常作为营养强化剂及抗氧化剂应用于食品、医药及化妆品行业.然而,α-TOC水溶性差且易受光、氧、热等因素的干扰[3],进入人体后吸收利用率低[4],这使其在应用方面存在局限性.
脂质体是磷脂双分子层定向排列成的一种小型囊泡,对人体无免疫原性,可以明显改善非水溶性营养素的溶解情况[4]并提高其有效载量和生物利用率[5-7],广泛应用于食品、化妆品和医药产业[8-9].但由于脂质体进入人体后极易被分解代谢,因此需要改变其膜材选用及制备工艺以提高其质量和应用价值.磷脂(Phosphatidylcholine,PC)是构成脂质体膜的常用材料,蛋黄卵磷脂与目前常用的大豆卵磷脂相比具有更好的稳定性[10],且有研究表明,胆固醇(Cholesterol,CHOL)作为脂质体制备的附加剂可以有效提高脂质体稳定性和内部药物的生物利用率[11].因此本文以蛋黄卵磷脂和胆固醇为壁材,结合单因素实验与响应面分析法优化α-TOC脂质体制备工艺,并在此条件下研究糖浓度、盐浓度、离子浓度、pH、加热温度及时间、储藏温度及时间对脂质体稳定性的影响.
1 材料与方法
1.1 材料与试剂
α-TOC:美国Sigma公司;蛋黄卵磷脂:国药集团化学试剂有限公司;胆固醇:北京索莱宝科技有限公司;无水乙醇、蔗糖、NaCl、HCl、NaOH(均为分析纯试剂):天津市天力化学试剂有限公司;吐温80:天津市光复精细化工研究所;PBS缓冲液:北京索莱宝科技有限公司.
1.2 仪器与设备
BSA223S电子分析天平:赛多利斯科学仪器(北京)有限公司;UV-2100紫外可见分光光度计:尤尼柯(上海)仪器有限公司;TGL-16G台式高速离心机:上海安亭科技有限公司;HHS-11-4电热恒温水浴锅:常州市人和仪器厂;BCD-221冰箱:河南新飞电器集团有限公司;RE 52-05真空旋转蒸发仪:上海亚荣生化有限公司;pHS-3C电子pH计:上海伟业仪器厂;QL-902漩涡震荡仪:海门其林贝尔仪器制造有限公司;HZS-HA恒温振荡器:哈尔滨东联电子技术开发有限公司;Zetasiter Nano ZS90纳米粒度仪,Bohlin GeminiⅡ旋转流变仪:英国Malvern公司;79-3恒温磁力搅拌器上海司乐仪器厂;S3400N扫描电子显微镜:日立高新技术公司.
1.3 方法
1.3.1α-TOC脂质体的制备
通过薄膜水化法制备脂质体[12].将100 mg蛋黄卵磷脂、20 mg胆固醇、10 mgα-TOC、100 mg吐温80溶于5 mL无水乙醇中,55 ℃水浴搅拌15 min后50 ℃减压蒸发1 h.加入pH =7.4的磷酸缓冲液20 mL,40 ℃旋转蒸发1 h.将样品4 ℃超声2 min并过0.45 μm滤膜,静置后得到α-TOC常规脂质体混悬液,4℃避光保存.
1.3.2 单因素实验
固定其他条件,按上述制备方法分别改变PC与CHOL的质量比、PC与α-TOC的质量比、无水乙醇(EA)的体积制备脂质体进行单因素实验.室温静置2 h后观察脂质体混悬液的状态,4 ℃避光24 h后以包封率、粒径大小及分布、Zeta电位为指标考察PC、α-TOC、CHOL的质量比及无水乙醇体积对脂质体质量的影响.
1.3.3 响应面实验设计
在单因素实验的基础上,以α-TOC脂质体的包封率为响应值,采用三因素三水平的响应面实验设计进一步优化配方.各因素及水平实验设计见表1.

表1 因素与水平
1.3.4α-TOC脂质体表征及稳定性分析
1.3.4.1 形态学及结构观察
将冻干后的脂质体喷金,在S3400N扫描电镜下(加速电压为104 kV)观测其外部形态.
1.3.4.2α-TOC标准曲线的绘制
精确称取α-TOC 100 mg溶于正己烷,并于100 mL容量瓶中定容以配制1 mg/mL的标准溶液.分别吸取0.5、1.0、1.5、2.0、2.5、3.0 g标准溶液于10 mL容量瓶中定容.以正己烷作空白对照,于290 nm处测定吸光度.以α-TOC浓度为横坐标,吸光度为纵坐标绘制标准曲线,所得回归方程为y=0.003 6x+0.028 7,R2=0.997 7.
1.3.4.3α-TOC包封率的测定
通过有机溶剂萃取法测定脂质体包封率.取0.4 gα-TOC脂质体混悬液于15 mL离心管中,加入4 g正己烷(0.685 mg/mL),涡旋2 min后机械震荡10 min,3 500 r/min离心10 min,取上清液测定吸光度. 实验重复3次.将吸光度值代入α-TOC标准曲线计算其含量,按下式计算脂质体包封率.
包封率=(Ca-Cb)/Ca×100%.
式中:Ca为样品中α-TOC总体积分数,μg/mL;Cb为正己烷中游离α-TOC的体积分数,μg/mL.
1.3.4.4 Zeta电位和粒径的测定
取4 ℃避光储藏24 h的α-TOC脂质体0.1 g,用蒸馏水稀释到1%(w/w).用Zetasiter Nano ZS90纳米粒度仪室温测定稀释脂质体的粒径和电位.
1.3.4.5α-TOC保留率(conserving rate)测定
保留率是指处理前后脂质体含α-TOC量的比值.测定方法同α-TOC包封率(entrapment efficiency)的测定,具体计算公式如下:
保留率=Cr/C0×100%.
式中:C0为初始状态下脂质体中α-TOC体积分数,μg/mL;Cr为经实验条件处理后脂质体中α-TOC体积分数,μg/mL.
1.4 数据处理与分析
结果表示为3次独立实验结果的平均值±SD,采用Microsoft Excel 2016软件进行数据统计分析,采用Design Expert 8.0软件进行响应面的方差分析,采用LSD-T检验进行显著性分析,P<0.05为显著水平.
2 结果与分析
2.1 单因素实验结果
2.1.1 PC与CHOL的质量比对脂质体性质的影响
脂质体的壁材主要是PC和CHOL,二者的比例显著影响脂质体性质.固定PC与α-TOC的质量比为10∶1,改变PC与CHOL的质量比制备脂质体并测定其性质,结果如图1所示. 结果表明,在质量比为2∶1时溶液浑浊,颜色暗沉,出现轻微絮凝.其他比例脂质体混悬液均呈乳白色且均一稳定,粒径大小及分布比较均匀.在PC与CHOL质量比为3∶1~6∶1时,包封率随CHOL加入量的增加而上升,在质量比为6∶1时达到最高(84.20±1.42%).

图1 不同配比CHOL的脂质体性质比较
2.1.2 PC与α-TOC质量比对脂质体性质的影响
固定PC与CHOL的质量比为6∶1,改变PC和α-TOC的质量比制备脂质体并测定其性质,结果如图2所示.各组脂质体混悬液静置2 h后均未发生絮凝或分层,其中当PC与α-TOC质量比为20∶1时脂质体呈乳白色,乳光现象最明显,包封率最高(85.1±1.48%).
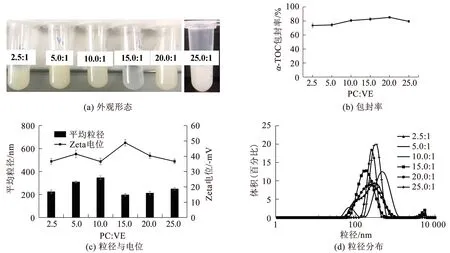
图2 不同配比α-TOC的脂质体性质比较
2.1.3 无水乙醇体积对脂质体性质的影响
固定PC与CHOL质量比为6∶1,PC与α-TOC质量比为20∶1,改变无水乙醇(EA)体积制备脂质体并测定其性质,结果如图3所示.新鲜制备的各组脂质体混悬液均呈乳白色,乳光现象明显且无絮凝.放置2 h后,无水乙醇添加量为2.5 mL的脂质体明显分层且包封率最低(42.40±1.96%),当添加量为15 mL时包封率(85.20±1.45%)最高,Zeta电位绝对值(39.10 ±1.11 mV)较高,平均粒径在200 nm左右(PDI=0.203±0.014).

图3 不同体积无水乙醇的脂质体性质比较
2.2 响应面分析实验结果及脂质体表征
2.2.1 响应面法优化α-TOC脂质体制备工艺
根据单因素实验结果,以α-TOC脂质体的包封率为响应值进行三因素三水平响应面分析实验,实验结果见表2.

表2 响应面分析实验结果
对上述实验结果进行回归拟合分析,建立数学模型,得到以包封率Y为因变量,X1、X2、X3为自变量的二次多项回归方程,得到的回归方程为
Y=86.25-0.44X1+0.95X2-0.76X3+
0.34X1X2+0.59X1X3-0.05X2X3-
对得到的回归方程的回归项分别进行方差分析以判断每个因素对维生素E-脂质体的显著性强弱,结果见表3.
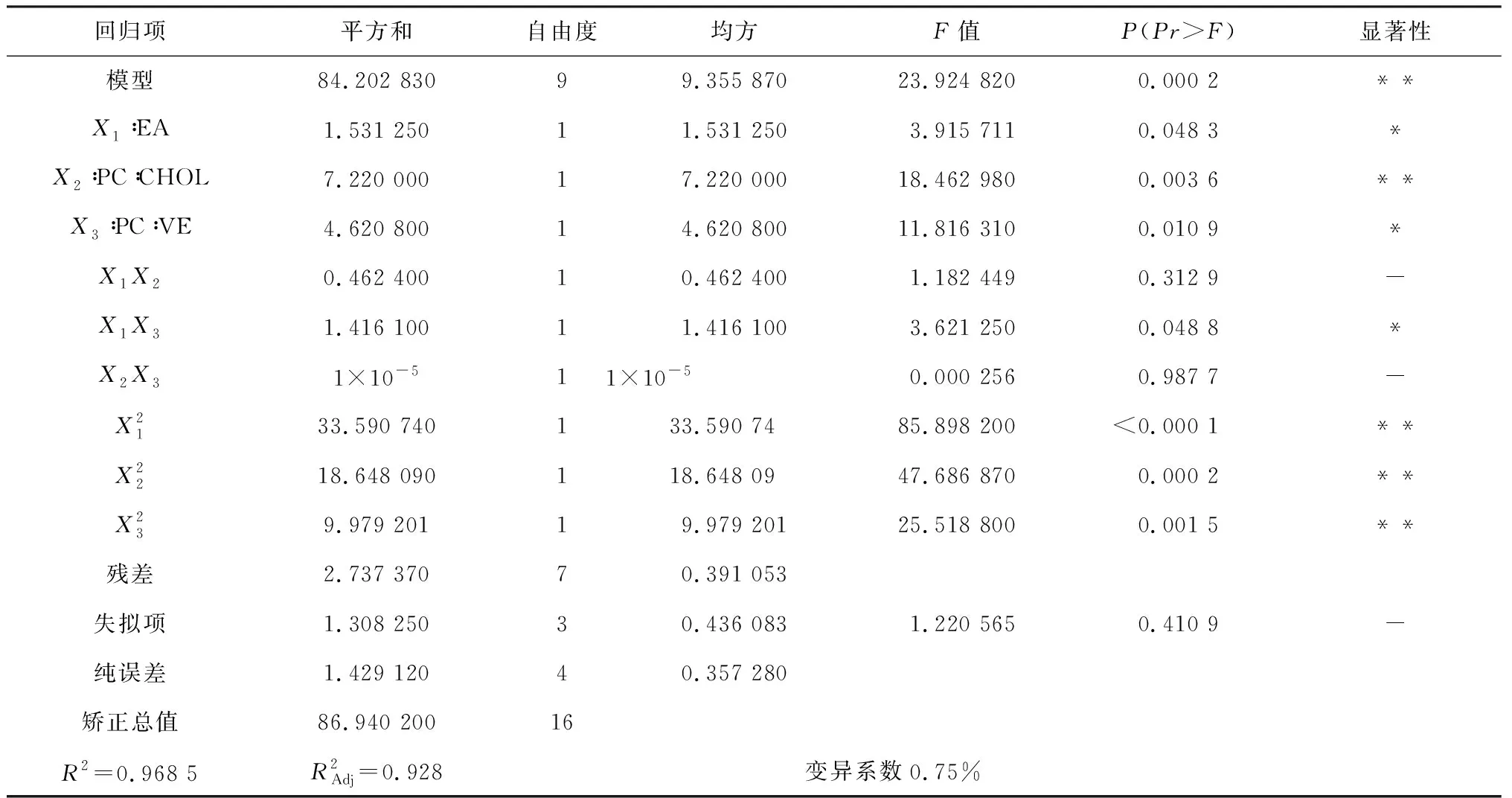
表3 回归模型方差分析

分别使影响脂质体包封率的两个因素在中心水平,由此得到等高线图和响应面立体分析图(如图4所示).结果表明,PC与α-TOC质量比和无水乙醇体积的交互作用显著,也进一步印证了表3的结果.这可能是因为α-TOC易溶于有机溶剂,无水乙醇的用量决定了其溶解度的大小.

图4 各因素交互作用对脂质体包埋率的影响
2.2.2α-TOC脂质体的表征
采用优化后的工艺制备α-TOC脂质体,其粒径为181.30±3.45 nm(PDI=0.201±0.013),Zeta电位值为-38.90±0.32 mV,包封率为87.39±1.12%.脂质体混悬液呈乳白色,有腥气味,静置一段时间后无絮凝或分层,流动性好,乳光现象明显(结果未显示).
形态学观察(如图5所示)发现脂质体微粒基本呈椭球形,且表面光滑.以往研究显示以大豆卵磷脂为材料采用不同方法制备的维生素E脂质体的粒径及包埋率是不同的,但薄膜水化法制备的维生素E脂质体的包封率最高[14].赵丽萍[15]采用薄膜均质法根据最优配方制得的大豆卵磷脂维生素E脂质体包封率为90.53%,而采用聚乙二醇包覆维生素E的脂质体,不仅包封率较高(91.03%),且脂质体的透皮性能增强,生物利用率得以提高.

图5 冻干样品的扫描电镜图
2.3 脂质体稳定性分析
2.3.1 糖稳定性
不同浓度的蔗糖对脂质体形态学、Zeta电位、粒径及保留率的影响如图6所示. 5%及以下浓度的蔗糖对脂质体溶液的表观形态无明显影响,乳液澄清且颜色均一,乳光作用明显且无沉淀产生,脂质体平均粒径稳定在186.20±3.59 nm~210.37±16.05 nm之间,Zeta电位稳定在-36.17±2.97 mV~-38.47±1.25 mV之间,保留率并未发生明显改变.这可能是因为糖具有稳定磷脂双分子层的作用,可以保持脂质体结构[16].
2.3.2 盐稳定性
不同浓度的NaCl对脂质体性质的影响如图7所示.脂质体在250、300 mM的NaCl浓度下颜色偏暗,出现絮凝沉淀.随着NaCl离子浓度的增大,脂质体的Zeta电位绝对值和保留率明显下降,平均粒径随之增大,体系趋于不稳定[17],即NaCl会破坏负载α-TOC脂质体的稳定性.这种现象出现的原因是带负电的蛋黄卵磷脂使得脂质体复合物本身带负电, Na+离子被吸附到脂质体膜上使蛋黄卵磷脂带有的负电荷被中和.此外,高渗也会影响脂质体的稳定性.
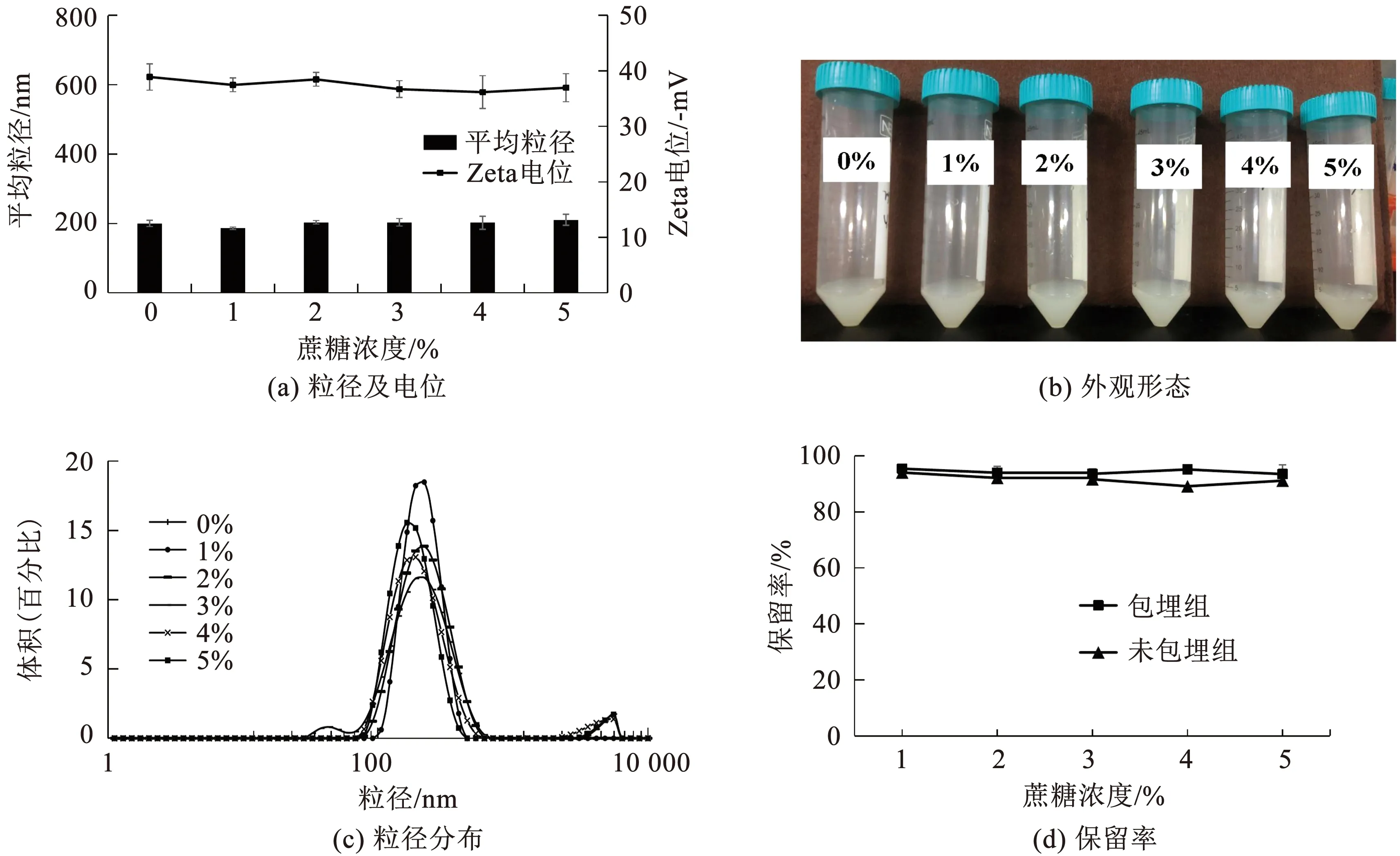
图6 脂质体在不同糖浓度下的物理性质

图7 脂质体在不同NaCl浓度下的物理性质
2.3.3 pH稳定性
不同pH对脂质体性质的影响如图8所示.脂质体在pH=1.5或pH=2.0时溶液底部浑浊且出现絮凝沉淀,即在强酸环境中,过多的H+中和了磷脂头部的负电荷[19],体系趋于不稳定;在pH介于3~8的范围内,随着pH的升高,脂质体的Zeta电位绝对值和保留率呈增加趋势,在pH=7时Zeta电位绝对值和保留率达最大(分别为38.73±0.57 mV和93.97±1.33%),粒径最小(185.73±4.82 nm),此时脂质体体系的状态最为稳定;pH调至8即偏碱性时,体系中的OH-破坏了平衡,脂质体结构被破坏,Zeta电位的绝对值和包埋率明显下降,平均粒径升高.结果显示脂质体溶液在强酸或偏碱的环境下不稳定,在中性环境下最稳定.
2.3.4 热稳定性
于65 ℃恒温水浴处理不同时间对脂质体稳定性的影响,结果如图9所示.65℃恒温45 min后脂质体出现少许絮凝沉淀,Zeta电位的绝对值达到最小(25.90±1.44 mV),平均粒径达到最大(274.30±6.15 nm),粒径分布较为紊乱(PDI=0.403±0.019).这是因为热处理使脂质体的双层膜膨胀导致脂质体粒径增大,膜表面的负电荷密度相对下降,脂质体Zeta电位的绝对值降低,体系趋于不稳定,而且脂质体在其临界温度以上长时间受热时,其膜上的磷脂分子运动明显增强,可能会翻转、摆动等导致致密的双分子层趋向疏松无序,脂质体膜变薄,渗透性变强[20].α-TOC的保留率随加热时间的延长而降低,而相同加热时间下,脂质体组的保留率均高于未包埋组,这说明脂质体包覆可以有效防止内容物因为外界环境不稳定而发生泄漏.
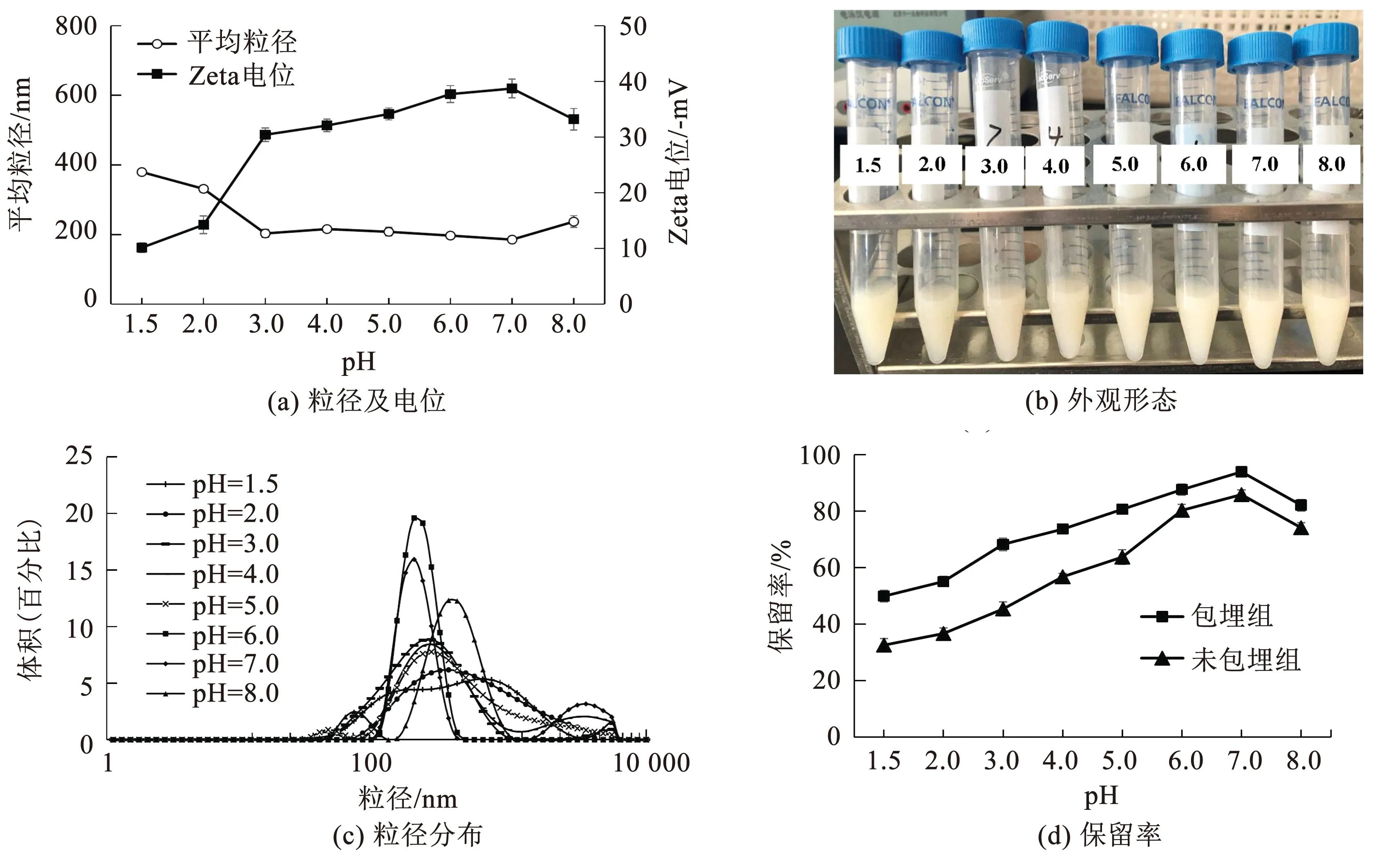
图8 脂质体在不同pH下的物理性质
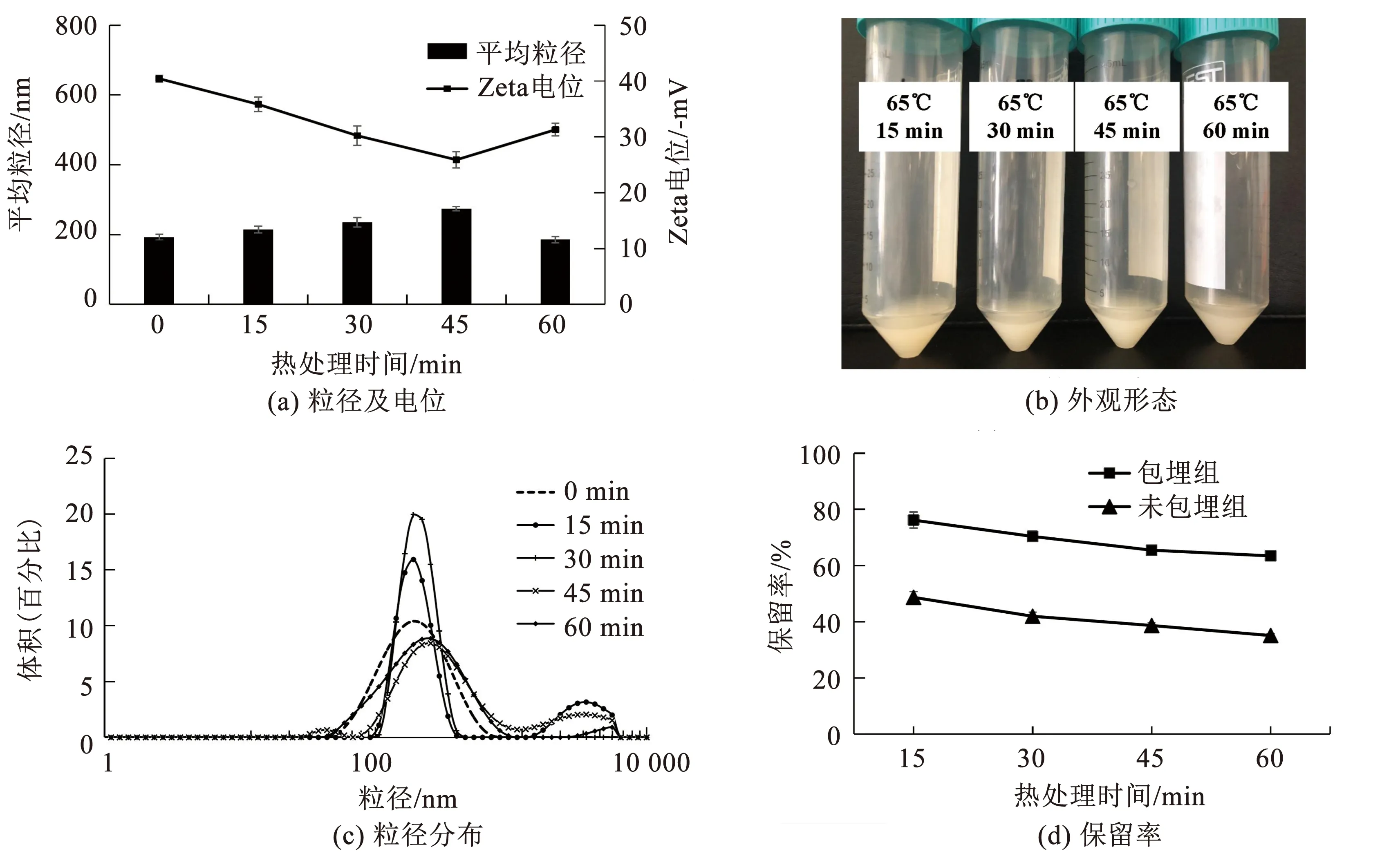
图9 脂质体在不同加热时间下的物理性质
2.3.5 温度稳定性
探究不同温度处理15 min对脂质体稳定性的影响,结果如图10所示.随着处理温度的逐渐升高,脂质体的平均粒径不断增大,粒径分布趋于无序,且Zeta电位的绝对值逐步减小,体系趋于不稳定.这是因为提高热处理温度会加速脂质体膜内磷脂的分子运动,增加微粒碰撞几率和分子聚集现象[21].此外,α-TOC的保留率随处理温度的升高明显下降,表明α-TOC在持续加热期间会发生泄漏,但相同处理条件下脂质体组的保留率明显高于未包埋组,这说明脂质体包覆可以有效保护高温引起的内容物的损失.
2.3.6 储藏稳定性
不同储藏温度及时间对脂质体稳定性的影响如图11所示,在25℃储藏的脂质体溶液底部于第20 d颜色暗沉,第30 d时出现少量沉淀,而4℃储藏的乳液澄清均一,呈乳白色,乳光现象明显.随着储藏时间的延长,脂质体的粒径增大,Zeta电位的绝对值下降,微粒间发生碰撞絮凝,粒径增大,分布趋于无序.保留率随储藏时间的延长呈降低趋势,即脂质体微粒随着储藏时间延长发生碰撞,从而导致内容物泄漏[21].相较于25℃下储存相同时间的脂质体,4℃存放脂质体的平均粒径更小,Zeta电位的绝对值和保留率更高,4℃储存30 d后脂质体保留率可达81.36±1.25%,说明4℃储藏的脂质体更加稳定,脂质体适宜冷藏.颜景全等[14]发现采用壳聚糖、羧甲基壳聚糖包覆维生素E脂质体可有效提高维生素E脂质体的储存稳定性,这为提高维生素E-脂质体的稳定性提供了新的思路.
3 结 论
1)采用薄膜水化法制备包埋α-TOC的脂质体的最优工艺参数为:PC用量为280.00 mg,PC与CHOL的质量比例为6.22∶1,PC与α-TOC的质量比为18.7∶1,无水乙醇体积为14.65 mL,此时脂质体包封率为87.39±1.12%,平均粒径为181.30±3.45 nm(PDI=0.201±0.013),Zeta电位为-38.90±0.32 mV.脂质体微粒呈球状结构且分散均匀,成膜现象明显.
2)稳定性分析表明蔗糖浓度低于5%时对脂质体稳定性基本没有影响,但偏酸或偏碱的环境、NaCl浓度的升高、加热及储藏温度的升高、储存时间的延长均会破坏脂质体的稳定性,脂质体在4℃储存时具有较好的稳定性.
3)脂质体中α-TOC的损失都明显少于未包埋组,说明脂质体能够很好地保护α-TOC活性和稳定性,有效提高其效用并扩大其应用范围.

