抗新冠肺炎(COVID-19)药物研究进展
赵 君,许律捷,张宝月,王 喆,刘艾林,杜冠华
(中国医学科学院北京协和医学院药物研究所,北京市药物靶点研究与新药筛选重点实验室,北京 100050)
目前,由新型冠状病毒(SARS-CoV-2)引起的新冠肺炎(coronavirus disease-19,COVID-19)一直在全世界范围内不断蔓延,但尚未研制出针对该病毒特效治疗药物或疫苗。针对此次疫情,在缺乏明确和具体的治疗方案的情况下,早期诊断、及时报告、隔离和支持性治疗是对抗SARS-CoV-2感染的重要策略。国家所采取的一些行动包括及时发布疫情信息和维持社会秩序,以及提醒个人改善卫生、戴口罩等,对COVID-19患者的治疗主要是使用现有的治疗药物,并根据症状情况进行治疗。据世界卫生组织(World Health Organization,WHO)报道,截至2020年7月2日,全球累计确诊病例已逾1 000万例,累计死亡人数超过51万例[1]。该病毒的迅速传播和上升的死亡率驱动全球加快实施相关干预措施,发现潜在和可用的药物,以控制和减轻此次疫情。
目前主要的药物治疗策略,包括老药新用、广谱抗病毒药物筛选以及新型靶向药物的筛选等[2]。本文基于冠状病毒生物学特点和病毒复制过程中的关键蛋白,介绍了代表性药物作用机制及研究进展,为抗SARS-CoV-2药物的临床应用提供信息依据,为抗冠状病毒新药研发提供思路。
1 冠状病毒介绍
1.1 冠状病毒形态、分类及基因特征冠状病毒为100 nm左右的球形或其它形状的颗粒,基因组长度在30kb左右,为目前已知RNA病毒基因组中最大,不同病毒外包膜上存在各异的像日冕的刺突,形状类似皇冠,故称为冠状病毒。冠状病毒可划分为α、β、γ和δ共4个属,加上最近爆发的SARS-CoV-2,目前对人类有感染性的冠状病毒共有7种,另外6种为α属的HCoV-229E和HCoV-NL63;β属的HCoV-OC43、HCoV-HKU1、SARS-CoV(严重急性呼吸综合征相关冠状病毒)和MERS-CoV(中东呼吸综合征相关冠状病毒),其中后两者可引起较严重的临床症状。SARS-CoV-2为β属冠状病毒,是未分节段的单正链RNA病毒,根据基因组结构显示,SARS-CoV-2与SARS基因组全序列同源性约为79.5%[3],精确迅速的基因变异检测可为筛选抗病毒药物提供重要依据。
1.2 冠状病毒复制周期冠状病毒侵入机体并在靶细胞中复制,主要包含有吸附结合、融合进入、遗传物质脱壳、生物合成、装配释放等程序。
1.2.1病毒与宿主细胞受体结合 冠状病毒颗粒主要包含有4种结构蛋白,分别是体积较大的纤突蛋白(spike, S)、病毒体中最丰富的囊膜蛋白(membrance,M)、小包膜蛋白(envelope,E)和磷酸化的核蛋白(nucleocapsid,N),其中三聚体S糖蛋白介导病毒与宿主受体的连接,此外S蛋白在病毒的宿主嗜性和毒力等方面也具有重要作用,所以S蛋白成为研究相关疫苗最多的靶点。血管紧张素转换酶2(angiotensin converting enzyme-2,ACE2)被证实为SARS-CoV的受体,该受体胞外结构域与SARS-CoV包膜上刺突蛋白连接,而后病毒包膜和细胞膜经过融合使SARS-CoV穿入细胞,有研究发现,SARS-CoV-2与ACE2的结合能力是SARS的10~20倍[4],这样的高结合能力加快其在人与人之间的传播,也合理解释了SARS-CoV-2的高传染性。
1.2.2病毒与宿主细胞膜融合穿入 SARS-CoV-2进入细胞的确切机制仍然未知,但有研究表明,病毒与ACE2联结后,细胞膜表面一种跨膜丝氨酸蛋白酶(TMPRSS2)会剪切S蛋白成不同亚基:S1(受体结合结构域)和S2(膜融合结构域),使之暴露出融合肽,与细胞膜融合,释放遗传物质进行复制[5]。而也有研究发现SARS-CoV-2也可能存在Furin蛋白酶切割位点,即与HIV病毒相似的酶切割位点,病毒在组装时Furin蛋白酶可将其S蛋白切分为不同亚基(S1和S2),而后被释放出去感染其它细胞,SARS-CoV中缺少Furin蛋白酶识别位点,其S蛋白在合成后大部分处于未切割状态[6]。所以可能由于组装机制不同,SARS-CoV-2具有更强亲膜融合能力,入胞效率更高。
1.2.3病毒复制、装配与释放 宿主细胞可为病毒复制提供相应环境和资源,病毒在胞内合成大量遗传物质和相关蛋白,然后在细胞质内装配成成熟病毒颗粒释放到细胞外。冠状病毒基因组单正链RNA可直接被细胞核糖体识别并翻译出大分子多蛋白,然后通过相关蛋白酶,大分子多蛋白被切分为功能蛋白(RNA聚合酶RdRp等)和结构蛋白,基因组RNA在聚合酶存在下合成大批负链RNA,然后以负链RNA作为模板复制下一代病毒RNA,以亚基因组正链RNA翻译晚期蛋白(衣壳蛋白、其他结构蛋白和非结构蛋白),进而进行组装与释放。
其中糜蛋白酶样蛋白酶(3CLpro)也称主蛋白酶(Mpro),是冠状病毒复制所必需的酶,其在切割多聚蛋白中具有重要作用,还可能干扰宿主天然抗病毒免疫反应,通过抑制该酶的活性,可有效干扰病毒的复制和增殖。另外,抑制RdRp等可阻断病毒RNA合成,从而抑制病毒复制。
2 SARS-CoV-2潜在治疗药物及其研究进展
基于冠状病毒的复制过程,靶向病毒蛋白或宿主细胞受体筛选药物和疫苗以及老药新用寻找广谱抗病毒药物等成为研发抗SARS-CoV-2潜在治疗药物的主要策略。下面将针对ACE2、S蛋白、RdRp、蛋白酶等不同靶点,综述其代表性药物及其研究进展,为临床治疗及新药研究提供参考。
2.1 靶向病毒入胞过程的药物
2.1.1ACE2受体抑制剂 抗疟疾药物氯喹(chloroquine)和羟氯喹(hydroxychloroquine)作为治疗COVID-19的候选药物一直在临床试验中进行相关观察,2020年3月28日,美国食品药品监督管理局(Food and Drug Administration,FDA)对该类药物发布应急使用,但目前由于有临床试验显示氯喹和羟氯喹对治疗COVID-19无益处且不良反应较大,WHO于5月25日发表声明宣布暂停了羟氯喹作为新型冠状病毒治疗的团结试验[7],6月15日,美国FDA宣布撤回氯喹和羟氯喹的紧急使用权。氯喹是一种4-氨基喹啉类抗疟疾药物,也可对一些自身免疫性疾病起一定治疗作用,另外具有广谱的抗病毒作用。对于SARS-CoV-2,最初认为其机制可能与减少细胞ACE2受体末端糖基化,阻止病毒与细胞结合,提高胞内体-溶酶体的pH值,抑制病毒脱壳,使pH依赖的蛋白酶丧失活性而阻断病毒复制有关。在体外SARS-CoV-2感染的Vero E6细胞实验中,氯喹和羟氯喹显示出一定抗病毒活性[8]。但随着对药物的研究,目前有多项临床试验表明氯喹与羟氯喹治疗COVID-19的疗效不明显,且存在一定的不良反应,研究者认为氯喹和羟氯喹的疗效需要进一步随机临床试验证实,而在取得正式确认之前,该类药物不应该用于其它疾病。
另外,有学者在研究SARS-CoV时发现ACE2受体小分子抑制剂N-(2-aminoethyl)-1aziridine-ethanamine(NAAE)能有效地阻断冠状病毒S蛋白介导的细胞结合(Tab 1)[9],其可能是一种有效的抗SARS-CoV-2治疗药物。此外,存在于高等植物中的金属离子螯合剂nicotianamine可有效抑制ACE2,且有较高安全性(Tab 1)[10],可作为候选药物之一。在一项对临床级的人重组可溶性ACE2蛋白(hrsACE2)研究中发现其可以抑制SARS-CoV-2对Vero 6细胞的感染,也能显著抑制对体外工程血管和肾脏的感染,阻止SARS-CoV-2感染宿主细胞的早期阶段[11],但该研究未能预测肺器官和疾病的后期阶段以及受限于RAS系统的复杂性,仍需进一步的体外和体内研究验证。
2.1.2TMPRSS2抑制剂 甲磺酸卡莫司他(camostat mesilate)(Tab 1)是由日本小野药品株式会社生产的一种人工合成的TMPRSS2抑制剂,其可抑制胆囊收缩素、炎性细胞因子和TMPRSS2等,用于治疗慢性胰腺炎和药物引起的肺损伤等疾病。一项研究显示,camostat可通过抑制TMPRSS2显著减少SARS-CoV-2对人肺腺癌Calu-3细胞系的感染[5]。此外,一项基于网络药理学和分子对接技术的研究发现两种单体化合物C26H36N8O4S(CID-46899577)和C24H35N7O3S(CID-56677007)和camostat有相似活性,对TMPRSS2有较好的抑制作用,可作用于F2、PLG、HSP90AA1、XIAP、AKT1等靶点调控的凝血、抗炎、细胞凋亡等相关通路,可能对COVID-19有治疗作用[12]。
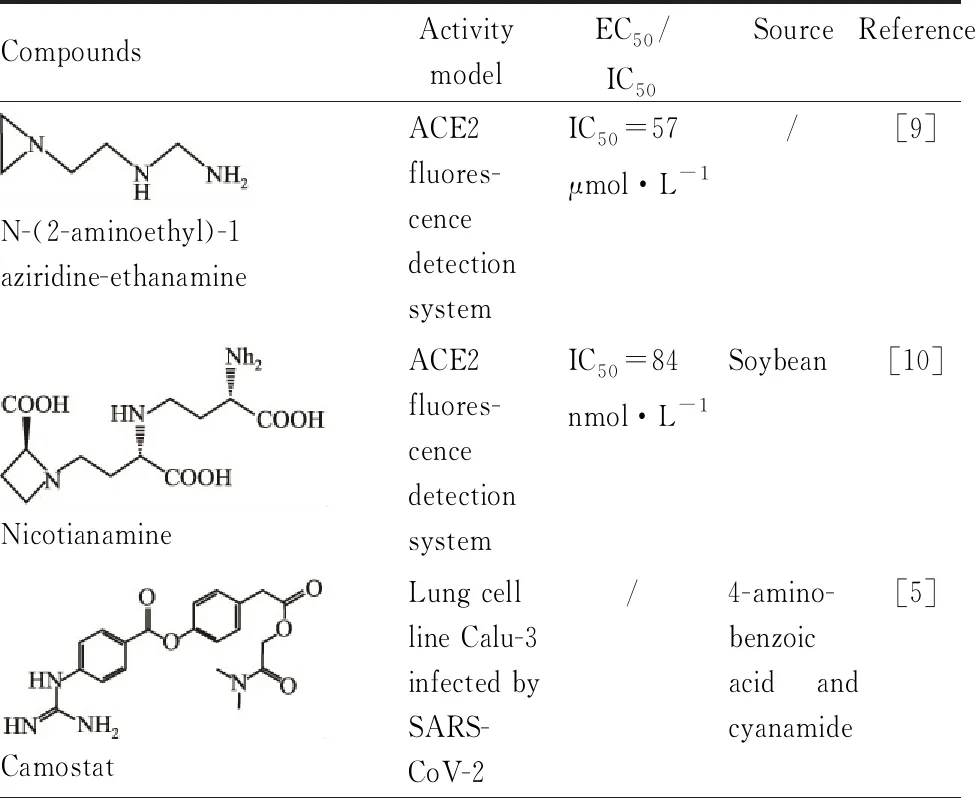
Tab 1 Candidate drugs acting on process of virus entry
2.1.3膜融合抑制剂 阿比多尔(arbidol)是一种非核苷类似物,是于1993年研发合成的抗流感药物,主要用于甲型、乙型流感病毒感染疾病,另外,有研究证明其对SARS-CoV、MERS-CoV等也有抑制作用,具有广谱抗病毒活性。arbidol可以通过干扰病毒网格蛋白内化作用,抑制病毒包膜与细胞膜的融合,从而阻止病毒侵入宿主细胞内;另外,arbidol还可调节免疫反应,可诱导机体产生干扰素(IFN)、控制炎症因子水平等途径发挥间接抗病毒作用。一项基于结构和分子动力学的研究发现,arbidol可以有效地抑制SARS-CoV-2 S蛋白的三聚化,从而阻断病毒对细胞的粘附和进入[13],但其有效性和安全性仍需进一步临床验证。目前,有限的临床试验显示,阿比多尔治疗COVID-19患者的有效性,但不能排除病毒的自然病程,一项对广州市第八人民医院178例COVID-19患者的回顾性分析显示arbidol未能促进COVID-19患者咽拭子病毒核酸转阴或改善症状[14],目前研究样本量有限,缺乏多中心研究数据,存在一定局限性,仍需更多临床数据支持。
2.1.4疫苗和抗体药物 针对SARS-COV-2的S蛋白,进一步精准检测其序列结构,寻找其关键受体结合区域,开发特异性疫苗和抗体是主要研究目标,但结构蛋白编码基因的变异给疫苗研发带来了很多困难,且研发过程涉及病毒株的分离,一系列临床试验等所需时间较长,目前尚无批准上市的有效疫苗。根据WHO在6月29日公布的《COVID-19候选疫苗草图》,全球共有17个SARS-CoV-2疫苗进入了临床试验阶段:由中国研究员陈薇带领的科研团队研制的腺病毒载体疫苗(Ad5-nCoV)在3月16日获批进入临床试验,4月12日,该疫苗进入Ⅱ期临床试验,为全球首个启动二期临床研究的新冠疫苗,并于6月11日完成揭盲,显示良好安全性及较高抗体滴度,但仅限军队内部使用;由国药集团中国武汉生物制品研究所与中国科学院武汉病毒研究所协同研发的灭活疫苗于6月23日进入Ⅲ期临床试验,为全球首个启动国际临床试验(Ⅲ期)的新冠疫苗;我国首个mRNA疫苗于6月19日经过批准开展临床试验;英国牛津大学研发的腺病毒载体疫苗ChAdOx1 nCoV-19已完成Ⅱ期临床试验;另外美国Moderna公司研发的mRNA疫苗(mRNA-1273)预计于7月开展Ⅲ期临床试验等[15]。
近期全球多个科研团队在开展相关抗体药物的研发,并取得一定的进展。5月26日,由中国科学院微生物研究所等机构联合开展的关于SARS-CoV-2中和抗体的重要研究在《Nature》上刊出发表,该研究团队首次在恒河猴体内实验中发现改造后的中和抗体CB6-LALA可以显著抑制SARS-CoV-2病毒复制,并改善相关肺损伤[16],该抗体显示出较好的临床应用前景。6月22日,《Science》期刊发表了由中国陈薇团队研发的首个靶向刺突蛋白N端结构域的单克隆抗体4A8,具有较强的中和活性[17],为发展预防和治疗COVID-19的候选抗体提供希望。
2.2 RNA聚合酶抑制剂RdRp抑制剂在CoVID-19治疗中受到格外关注,目前用于治疗的药物包括瑞德西韦(remdesivir)、法匹拉韦(favipiravir)、利巴韦林(ribavirin)等,其主要信息(结构、来源等)见Tab 2。
2.2.1瑞德西韦 remdesivir是由吉利德科学公司为治疗埃博拉(Ebola)病毒研制的一种新型广谱抗病毒药,已进行了相关Ⅰ期和Ⅱ期临床试验,后在细胞实验和动物实验研究中发现其对SARS-CoV和MERS-CoV有明显的抑制作用。该药物是一种核苷类似物,由该公司之前研制的药物GS-441524磷酸化而来,其在体内被代谢为活性三磷酸核苷(nucleoside triphosphate,NTP),在复制过程中被充当RdRp的底物,起竞争性地抑制作用,进而终止病毒基因组的转录合成,冠状病毒可表达核糖核酸外切酶将掺入病毒RNA的核苷类似物切出,但remdesivir可对该酶产生抗性,可能比其他核苷类似物疗效好些。4月29日,王辰等[18]对中国COVID-19重症患者的随机双盲对照多中心试验结果被发表,研究显示remdesivir治疗与对照组相比并不能减少死亡,但患者可以更快获得临床改善,且耐受性较好,没有发现新的安全问题。同日,美国国立卫生研究院(NIH)公布临床研究结果显示,remdesivir与对照组相比明显缩短患者症状恢复时间,但死亡率下降没有显著差异。同时吉利德公司一项Ⅲ期临床试验比较了接受该药物治疗10 d和5 d的改善情况,结果没有显著差异,未发现新的不良事件。瑞德西韦作为一种初步治疗COVID-19的药物可能相对较安全,但其具体疗效还需更多临床数据支持。
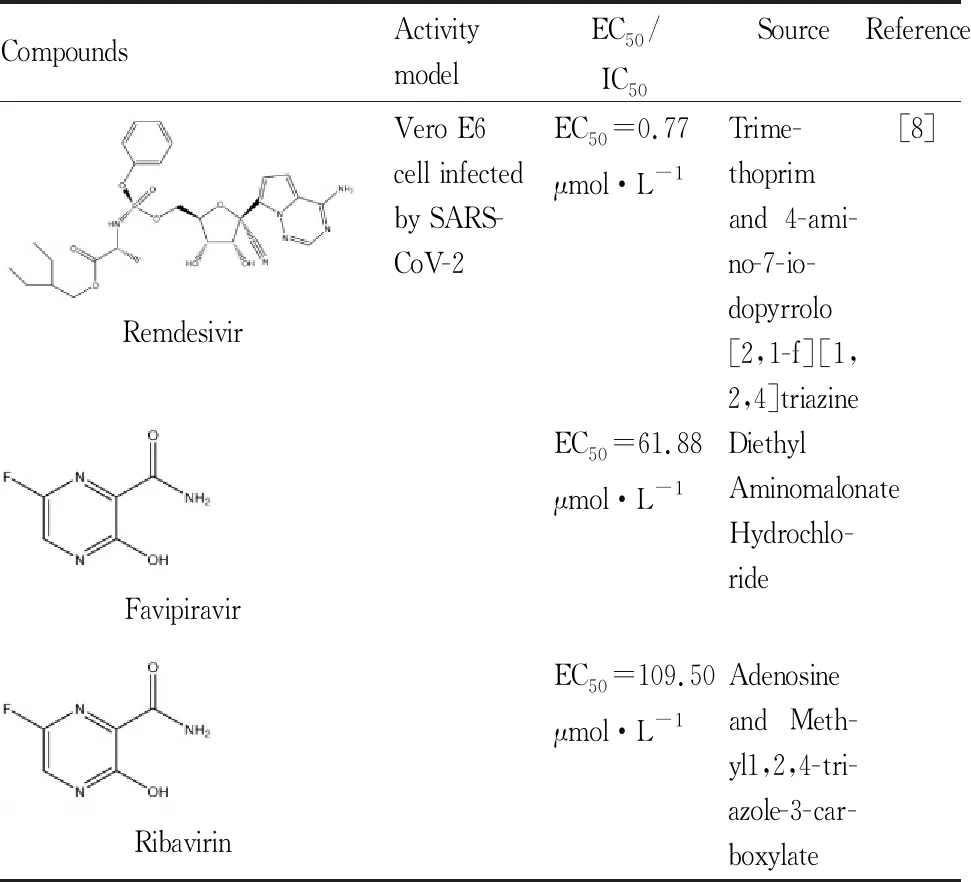
Tab 2 Candidate drugs acting on RNA polymerase
2.2.2法匹拉韦 favipiravir由一种吡嗪类似物化学修饰而来,是一种新型RdRp抑制剂,主要用于治疗甲、乙型流感,研究表明该药对多种RNA病毒也表现出良好的抑制作用。favipiravir抑制RNA病毒的作用机制还不明确,研究认为其可在磷酸核糖转移酶(hypoxanthine guanine phosphoribosyl transferase,HGPRT)的作用下转化为呋喃糖基5′-三磷酸代谢产物(favipiravir-RTP),转化物结构与嘌呤相似,能够插入到病毒的RNA链中,竞争性抑制RdRp;还可因错误掺入引起病毒致病性突变。在一项体外实验中,favipiravir对SARS-CoV-2感染的猴Vero E6细胞显示出一定抗病毒活性[8]。由深圳市第三人民医院开展的一项开放性研究显示,favipiravir治疗组与对照组相比,病毒转阴时间明显缩短,且肺部影像学缓解率较高,表现出良好的耐受性和安全性[19],该研究局限性在于未采用随机双盲安慰剂对照且样本量较小,但结论对于治疗COVID-19也具有一定参考意义。另外一项由武汉大学中南医院开展的多中心、随机、开放、阳性平行对照临床研究显示favipiravir治疗组较arbidol对照组并不能显著提高d 7临床恢复率,但缩短了发热和咳嗽的恢复时间[20]。
2.2.3利巴韦林 ribavirin属于嘌呤核苷类似物,主要用于治疗呼吸道合胞病毒、丙型肝炎病毒等感染疾病,可发挥广谱抗病毒活性。目前对于ribavirin的抗病毒作用机制可能为通过抑制RdRp直接干扰病毒复制,还可使RNA病毒产生错误突变,另外可以抑制宿主单磷酸次黄嘌呤核苷酸脱氢酶 (IMPDH)影响,病毒复制以及调节免疫反应等。此外,ribavirin常与α-干扰素联用发挥抗病毒作用,α-干扰素是由白细胞产生的一种重要的广谱抗病毒细胞因子,可在整个病毒复制过程中发挥抑制作用,增强免疫系统对病毒感染细胞的免疫杀伤活性,ribavirin与其联用有临床协同效果。但是由于冠状病毒可表达外切核糖核酸酶识别核苷类似物,因此有体外实验证明ribavirin对冠状病毒抑制作用很小。而且有研究表明常规剂量的ribavirin在血液中的浓度对MERS-CoV没有抑制作用,加大剂量后可能会造成贫血和肝功能损伤等严重不良反应[21]。其在SARS-CoV-2感染的Vero E6细胞中EC50较高,大大超过了常规口服给药时的血药浓度[8]。就目前实验数据来看,ribavirin联合干扰素和其他抗病毒药物治疗比单独使用有效,但使用时应注意剂量,控制不良反应。
2.3 蛋白酶抑制剂3Clpro在不同的冠状病毒中高度保守,因此,针对3Clpro的药物可显著降低突变介导的耐药性,并显示出广谱的抗病毒活性,寻找或者设计针对该酶的抑制剂是一种潜在的治疗策略。
2.3.1洛匹那韦/利托那韦 洛匹那韦/利托那韦(lopinavir/ritonavir)是首次被批准上市的复合型蛋白酶抑制剂,主要用于治疗HIV感染,商品名为“克力芝”。之前已经有研究显示lopinavir/ritonavir对冠状病毒有一定的抑制作用,一项对lopinavir/ritonavir与SARS-CoV 3CLpro的分子动力学模拟研究发现lopinavir/ritonavir与该酶活性部位有一定结合,在SARS-lopinavir复合体中检测到6个氢键,在SARS-ritonavir复合体中检测到7个氢键[22]。另外有学者在狨猴动物模型中发现lopinavir/ritonavir可对MERS-CoV感染症状有明显改善[23]。因此有学者提出可将lopinavir/ritonavir经验性药物治疗COVID-19。5月8日,《Lancet》上发表了一项来自香港的多中心、前瞻性、开放标签、随机的Ⅱ期临床试验,该研究结果表明早期联合使用IFN β-1b、lopinavir/ritonavir和ribavirin三联抗病毒治疗在减轻轻、中度冠状病毒患者症状、缩短病毒转阴时间和住院时间方面比单用lopinavir/ritonavir更有效,且不同治疗组间不良事件发生率没有显著差异,但该研究未涉及危重症病人,也存在未设安慰剂等局限性[24],总的来说,该项研究为早期联合使用抗病毒药物提供了一定的科学依据。
2.3.2其它3Clpro抑制剂 自从2003年SARS-CoV爆发以来科学家们就在不断寻找和设计作用于3CLpro靶点的药物,但由于结构或理化性质因素,大多数抑制剂都没有得到进一步的抗病毒活性或体内研究,只有少数抑制剂显示有一定的抗病毒活性。之前一项研究总结并阐述了3CLpro的主要抑制剂包括肽类抑制剂和非肽类抑制剂(杂环酯类、吡唑类、靛红衍生物类)[25](Tab 3),可为筛选抗SARS-CoV-2药物提供相关参考信息。目前也已有多篇文章基于3CLpro结构通过计算机虚拟筛选技术寻找可能治疗COVID-19的潜在药物(Tab 3)。Zhang等[26]通过对先前的α-酮酰胺类抑制剂结构进行设计和优化得到抑制剂13a、13b、14b,并与模拟设计的SARS-CoV-2 3CLpro结构进行对接,发现13b具有良好药代动力学和耐药性。一项结合结构辅助药物设计、虚拟药物筛选和高通量筛选的研究发现了一种抑制剂N3并筛选出6个对3CLpro有抑制作用的化合物,IC50值在0.67~21.4 μmol·L-1之间[27]。Elmezayen等[28]发现4种潜在的3CLpro抑制剂,其中包括两种可获得药物酞氨西林(Talampicillin)和鲁拉西酮(Lurasidone);两种新型化合物ZINC000000702323和ZINC000012481889,可能有助于开发和优化更有效的冠状病毒抑制剂。刘妍如等[29]运用分子对接技术模拟预测TCMSP数据库中药成分对SARS-CoV-2 3Clpro的作用,结果筛选出黄酮类、酚酸类、糖苷类等60个小分子化合物,并构建“成分-药材-归经-功效”网络,为相关药物研究提供了数据。
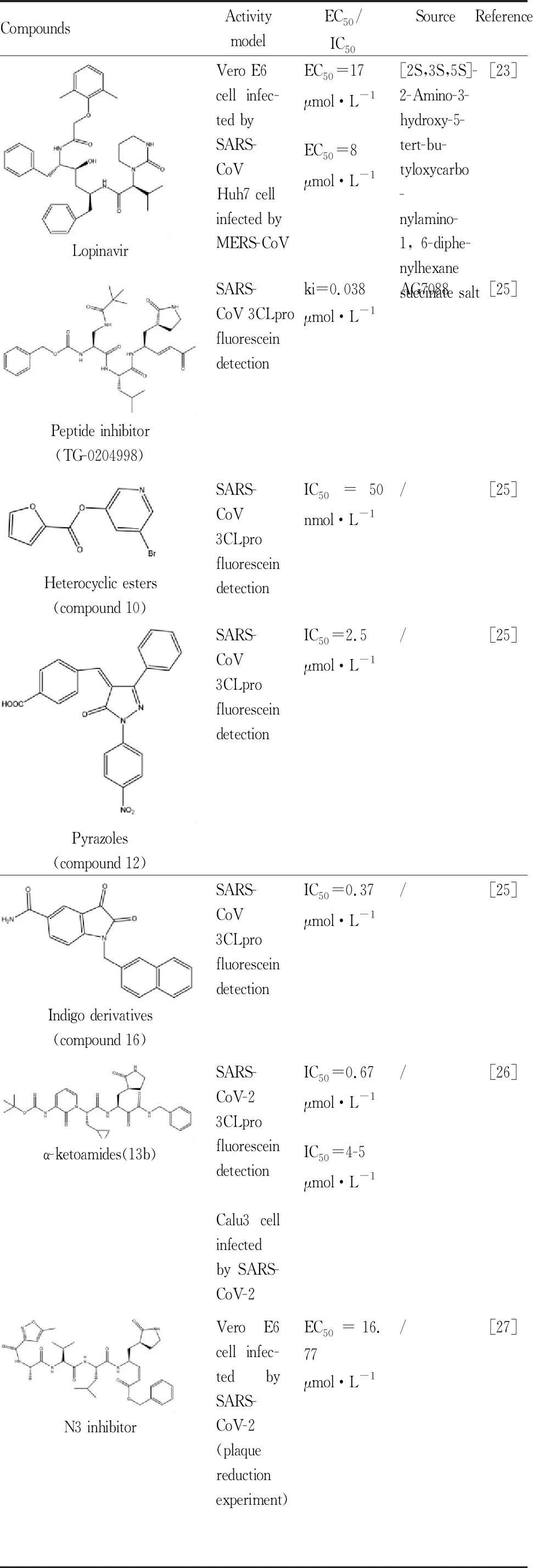
Tab 3 Candidate drugs acting on 3CLpro
2.4 中药治疗中医药用于控制病毒性传染病已有数千年的历史,目前中国超过85%的SARS-CoV-2感染患者正在服用中医药作为补充治疗。中药不仅可以增强呼吸道黏膜免疫功能,还可保护流感病毒诱导的小鼠急性肺损伤,显著改善小鼠肺部炎性病理变化。在SARS爆发期间,中医药已经显示出较好的治疗和预防作用,如甘草根的主要活性成分甘草酸苷可有效地抑制SARS-CoV病毒临床分离株的复制,另外发现黄芩苷也具有抗SARS-CoV活性。从SARS流行到现在,科学家们一直在探索具有抗SARS-CoV活性的中药方剂,并进一步对中药所含化学成分及其作用机制进行了很多研究(Tab 4),这些结果可能对治疗COVID-19具有参考意义[30]。
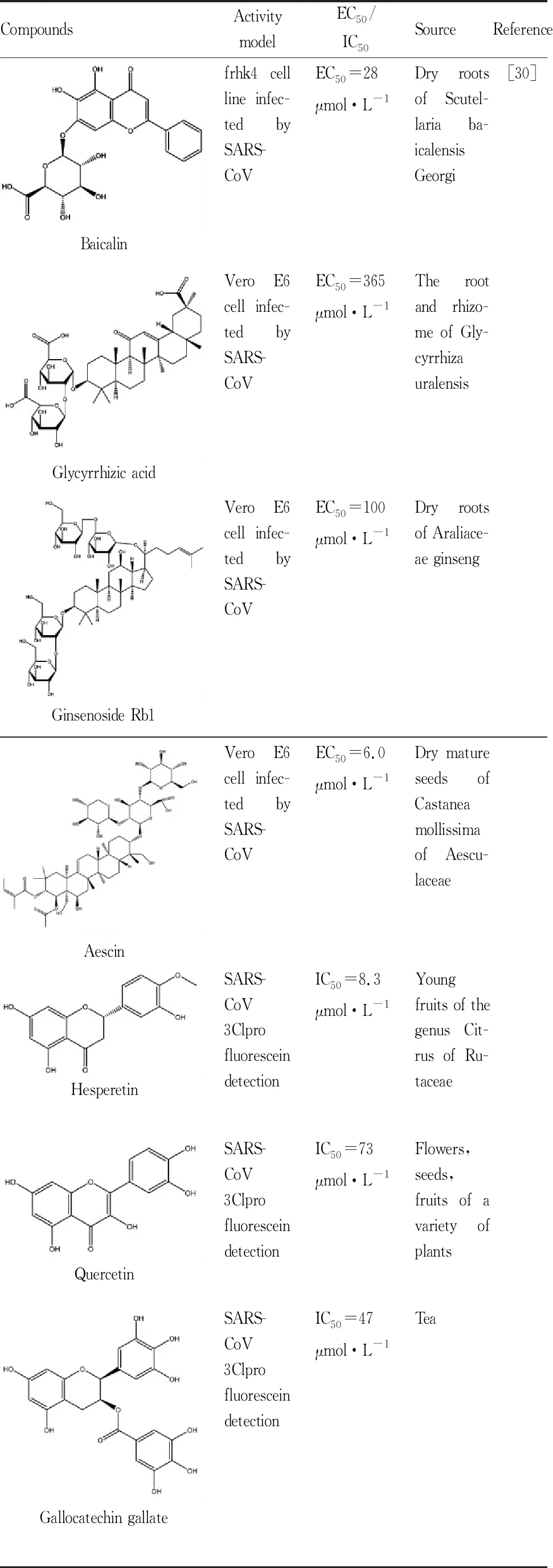
Tab 4 Components of traditional Chinese medicine with anti-coronavirus activity
2.5 其他治疗药物通过对美国临床试验数据库(Clinicaltrials.gov)和中国临床试验注册中心(chictr.org.cn)的检索,还有一些具有潜在疗效的抗SARS-CoV-2药物正在临床试验中,如主要用于治疗HIV的核苷类逆转录酶抑制剂恩曲他滨和丙酚替诺福韦,具有广谱抗RNA病毒活性的腺苷类似物Galidesivir和N4-Hydroxyctidine,抑制HIV-1蛋白酶活性,阻断成熟病毒形成的达芦那韦联用考比司他以及一种新型HIV-1蛋白酶抑制剂TMC-310911等。
3 结语与展望
自1918年西班牙流感大流行后,在过去100年里由病毒引起的传染性呼吸道疾病对全球公共卫生造成巨大威胁,其中由冠状病毒SARS和MERS引起的疾病较为严重。此次SARS-CoV-2的流行再一次对全球卫生构成了较大挑战,全球感染及死亡人数不断上升,但暂时还没有针对COVID-19患者的特效药和疫苗上市,本文对目前经验性使用药物及其它候选药物研究进展进行了综述。
在此次疫情暴发初期,抗疟药氯喹或羟氯喹在体外实验和一些临床研究中显示一定疗效,但随着研究的深入,有学者发现氯喹或羟氯喹可能对COVID-19的临床治疗并无益处,且会增加严重不良反应,已于6月15日被FDA宣布撤销紧急使用权。人重组可溶性ACE2蛋白可能通过限制结合和进入阻断SARS-CoV-2的传播,还有一些小分子ACE2受体抑制剂可能有效阻断SARS-CoV-2的结合。甲磺酸卡莫司他可抑制TMPRSS2从而阻断SARS- CoV-2与细胞膜的融合,减少对人肺腺癌Calu-3细胞系的感染。目前相关疫苗和单克隆抗体的研发显示出良好的应用前景,中国已有1个腺病毒载体疫苗、4个灭活病毒及1个重组蛋白疫苗和1个mRNA疫苗进入临床试验,且人源单克隆抗体CB6在动物实验中显示较好抑制作用,首个靶向刺突蛋白N端结构域的单克隆抗体4A8被报道有较高的中和活性。对于瑞德西韦,有多项临床研究显示其并不能降低死亡率,但可较快改善临床恢复时间,耐受性较好,法匹拉韦相比阿比多尔可缩短发热和咳嗽恢复时间,但具体疗效仍需进一步验证。利巴韦林与干扰素及其它抗病毒药物如洛匹那韦/利托那韦联用比单独使用有效,但联合使用可增加发生不良反应的几率,应合理权衡。通过虚拟筛选得到的3CLpro抑制剂及黄芩苷、甘草酸苷、槲皮素等天然产物也可改善临床症状,对治疗COVID-19提供重要参考信息。
针对ACE2、RdRp、3CLpro及其它蛋白酶等多个抗病毒靶点,进一步利用现代计算机人工智能技术,筛选发现有效药物;靶向病毒S蛋白及人ACE2受体结构研制特异性疫苗和抗体;结合适当的体内外及临床试验对有效治疗新型冠状病毒具有重要意义。

