抑制线粒体丙酮酸载体通过激活AMPK-ACC通路改善棕榈酸诱导的HepG2细胞脂肪变性
李世英,汪 艳,2,3
(南方医科大学 1.药学院、2. 中心实验室,3.南方医院感染内科暨肝病中心,广东 广州 510515)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD) 的主要特征为肝细胞脂肪变性[1-3]。细胞中的脂肪积累和处置之间的失调是导致肝细胞脂肪变性的主要原因[4]。线粒体丙酮酸载体(mitochondrial pyruvate carrier,MPC)于2012年被发现,其主要功能是将细胞质中的丙酮酸转运至线粒体中。丙酮酸是一种重要的代谢中间体,参与糖异生、脂质新生、胆固醇合成以及维持三羧酸循环[5-6]。因此,MPC在糖、脂质代谢中起着关键作用。研究发现,MPC是治疗NAFLD的潜在靶点[7]。抑制MPC可以促进NAFLD患者肝脏的脂质代谢,显著改善患者的脂肪变性情况[8],但是关于MPC抑制剂调控脂肪变的分子机制仍不明确。
以往文献报道,正常小鼠敲除MPC1基因,腺苷酸激活蛋白激酶(AMP-activated protein kinase, AMPK)信号通路、脂肪酸β氧化途径被激活。可见, 肉毒碱棕榈酰基转移酶1A(carnitine palmitoyltransferase 1A,CPT1A)表达上调。而脂质生成的相关基因乙酰辅酶A羧化酶(acetyl CoA carboxylase,ACC)则显著下调[9-10]。这些文献报道提示,MPC与AMPK-ACC通路可能存在调控作用,然而至今尚未有研究证明,这种调控作用是否与肝细胞脂肪变性有关。
棕榈酸(palmitic acid,PA)诱导HepG2细胞建立体外高脂负荷模型常被用作模拟体外NAFLD模型[11]。因此我们选择这一体外模型研究MPC活性的抑制对细胞脂质堆积的影响及其分子机制,旨在探索抑制MPC对PA所致HepG2细胞脂肪变性以及AMPK-ACC通路进的影响,为改善NAFLD肝细胞脂肪变性提供线索。
1 材料
1.1 细胞来源HepG2 细胞(批号:xbz-030),购自美国ATCC公司。
1.2 试剂PBS溶液(批号:C10010500BT)、0.25% 胰酶(批号:25200056)、DMEM高糖培养基(批号:C11995500BT)、胎牛血清(批号:10099-141)购自Gibco公司;PA(批号:P0500-10)购自Sigma 公司;MPC抑制剂UK5099(批号:56396-35-1)购自MCE 公司;CCK8检测试剂盒(批号:C0037)、BCA蛋白浓度测定试剂盒(增强型) (批号:P0010S)购自碧云天公司;总 RNA 提取试剂盒 RNAiso Plus(批号:T9109)、RT-PCR 反应扩增试剂盒(批号:RR047A)购自TakaRa 公司;油红O染色试剂盒(批号:BB-44612-2)购自广州一科生物科技有限公司;p-AMPK(批号;2535T)抗体购自CST公司;AMPK抗体(批号:ab32047)、p-ACC抗体(批号:ab68191)、ACC抗体(批号:ab45174)、SREBP1抗体(批号:ab193318)购自Abcam公司。
1.3 仪器酶标仪(美国 BIO-TEK公司);电子分析天平(BS210S型,北京赛多利斯天平有限公司);高速台式离心机(MIKRO200,Hettich公司);实时荧光定量PCR仪(7500型,ABI公司);PCR扩增仪(ETC811,苏州东盛兴业科学仪器有限公司);NanoDrop2000核酸超微量测定仪(GNM15140,Genom);全自动蛋白质定量检测仪(Wes,美国Protein Simple);倒置相差显微镜(倒置 TS100,NIKON);明场正置显微成像系统(德国Leica)。
2 方法
2.1 细胞培养和主要试剂配制细胞在含有10% FBS的完全培养基中进行培养。等细胞长到接近90%,用0.25% 胰酶对其消化、传代。PA配制为5 mol·L-1的母液,于-20 ℃冰箱中保存备用。将MPC抑制剂UK5099配置为0.05 mol·L-1的母液,于-20 ℃冰箱中保存备用,再根据实验需要稀释为各浓度。
2.2 CCK8测定细胞活力为了确认不同浓度PA以及MPC抑制剂 UK5099是否会对细胞活性产生显著影响,我们在实验之前利用CCK8对HepG2细胞的活力进行检测。将HepG2细胞铺在96孔板中,d 2将培养液改换为以下培养基:正常对照组:高糖完全培养基;PA组:0、0.1、0. 5、1.0 mmol·L-1PA的完全培养基;MPC抑制组:0、10、20、50 μmol·L-1UK5099的完全培养基,培养24 h或者48 h。然后弃去孔板中的培养液,改换为含 10% CCK8 的基本培养基处理细胞 60 min,记录酶标仪450 nm波长处所测得的吸光度。细胞相对存活力为各实验组的所测得的吸光度与正常组所测的的吸光度之比。
2.3 细胞的分组将HepG2细胞使用胰酶消化后,重新种植于6孔板上。次日改为无血清的培养基饥饿24 h。细胞分组:换上含完全培养基为正常对照组,含0.5 mmol·L-1的PA的完全培养基作为体外高脂负荷模型组,添加了10 μmol·L-1UK5099、0.5 mmol·L-1的PA的完全培养基作为抑制剂组,继续培养48 h,收集细胞的总RNA或蛋白用于后续实验。
2.4 Real-time PCR检测目的基因的表达4 ℃条件下使用TRIzol技术提取总RNA,按照说明书操作方法制备cDNA。然后在ABI Prism 7500 PCR仪利用SYBR Green-BSAed Real-time PCR进行分析。检测以下目的基因:AMPK、ACC、SREBP1、CPT1A,以GAPDH为内参基因。以上目标基因的表达,采用2-ΔΔCT法计算相对表达量。每个基因重复测定3次。引物序列见Tab 1。
2.5 全自动蛋白质定量检测仪定量检测相关蛋白表达于4 ℃条件下使用含PMSF抑制剂的RIPA试液提取总蛋白,根据BCA试剂盒检测其浓度,并调整样品最终上样浓度为1 g·L-1。于全自动蛋白质检测仪定量测定AMPK、p-AMPK、ACC、p-ACC、SREBP1蛋白的表达水平,以GAPDH为内参蛋白。运用全自动蛋白质定量检测仪配套软件Compass for SW软件对靶蛋白的条带密度值进行统计分析。
2.6 油红O染色观察脂质堆积用一次性吸管去除各孔原培养液,用适量PBS清洗后加入浓度为4% 的中性甲醛,暗处处置15 min;用蒸馏水洗去固定液;然后加入油红O工作液,密封处理后,在37 ℃避光静置30 min;弃去工作液,蒸馏水冲洗;利用显微镜进行观察,镜下显示脂滴阳性结果为胞质呈橘红色。油红O染色定量方法:弃去6孔板中的PBS,将6孔板置于干燥通风处,使每孔中的水分挥干。用异丙醇对溶解在脂滴中的油红O进行萃取,即每孔加入200 μL异丙醇,密封,置于37 ℃摇床20 min,将提取液转移至96孔板中,200 μL异丙醇作为调零孔,于酶标仪490 nm处检测各组的OD值。

Tab 1 Sequence primer of selected genes
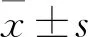
3 结果
3.1 不同浓度PA、MPC抑制剂UK5099对HepG2细胞活力的影响用CCK-8法检测不同浓度PA、UK5099对HepG2细胞活力影响,结果如Fig 1A所示,0、0.1、0.5 mmol·L-1PA处理24、48 h对细胞活力均无影响;1、2 mmol·L-1PA抑制了HepG2细胞活性。如Fig 1B所示,10 μmol·L-1UK5099处理48 h对细胞活力无影响,20、50 μmol·L-1UK5099处理24 h抑制HepG2细胞活力。本实验为了排除UK5099对PA所致肝细胞脂肪变和AMPK-ACC通路的影响是由于抑制HepG2细胞活力引起的,我们最终选择对HepG2细胞活性影响不大的浓度,即0.5 mmol·L-1PA以及10 μmol·L-1UK5099处理48 h为后续实验浓度以及时间点。
3.2 抑制MPC可以改善PA所致HepG2细胞脂质堆积的情况结果如Fig 2显示, 0.5 mmol·L-1PA处理48 h, HepG2细胞胞质内油滴数量大小及含脂滴细胞数量明显增加(P<0.01),呈环状聚集于胞质内;0.5 mmol·L-1PA添加10 μmol·L-1UK5099 处理48 h,胞质内脂滴数量、大小及含脂滴细胞数量明显减少(P<0.01)。可见,MPC抑制剂UK5099可以改善PA所致HepG2细胞胞质内脂质堆积情况。
3.3 体外抑制MPC通过激活AMPK-ACC通路改善脂质堆积情况RT-PCR结果如Fig 3显示,0.5 mmol·L-1PA处理HepG2细胞48 h,可以提高ACC、SREBP1 mRNA的表达水平(P<0.01),并降低AMPK(P<0.01)、CPT1A (P<0.05)mRNA的表达水平;与0.5 mmol·L-1PA组相比,0.5 mmol·L-1PA添加10 μmol·L-1UK5099 处理48 h,可以降低ACC、SREBP1 mRNA的表达水平(P<0.01), 并提高AMPK、CPT1A mRNA的表达水平(P<0.01)。
全自动蛋白分析实验结果如Fig 4所示,0.5 mmol·L-1PA处理HepG2细胞48 h,可以降低细胞的p-AMPK 、p-ACC蛋白表达水平(P<0.01),并且提高AMPK(P<0.05)、ACC(P<0.01)、SREBP1(P<0.01)蛋白表达水平;与0.5 mmol·L-1PA组相比,0.5 mmol·L-1PA添加10 μmol·L-1UK5099 处理48 h,细胞的p-AMPK、p-ACC蛋白表达水平均明显升高(P<0.01),ACC、SREBP1蛋白表达水平均降低(P<0.01),AMPK蛋白表达水平无显著变化。
4 讨论
肝细胞脂肪变性是NAFLD的主要特征,因此探索肝细胞脂肪变性的分子机制对该疾病的诊治尤为重要。在本实验,为了排除高浓度的PA或MPC抑制剂UK5099对HepG2细胞的毒性作用,干扰UK5099改善PA诱导的肝细胞脂肪变性,是由于UK5099对HepG2细胞的毒性作用,还是UK5099通过激活AMPK-ACC通路所导致的,因此我们首先利用CCK-8实验,选出对HepG2细胞的毒性作用较小的低浓度PA(0.5 mmol·L-1)、低浓度UK5099(10 μmol·L-1)进行后续分子机制相关实验。实验结果表明,低浓度UK5099可以明显改善PA所致HepG2细胞脂肪变性。
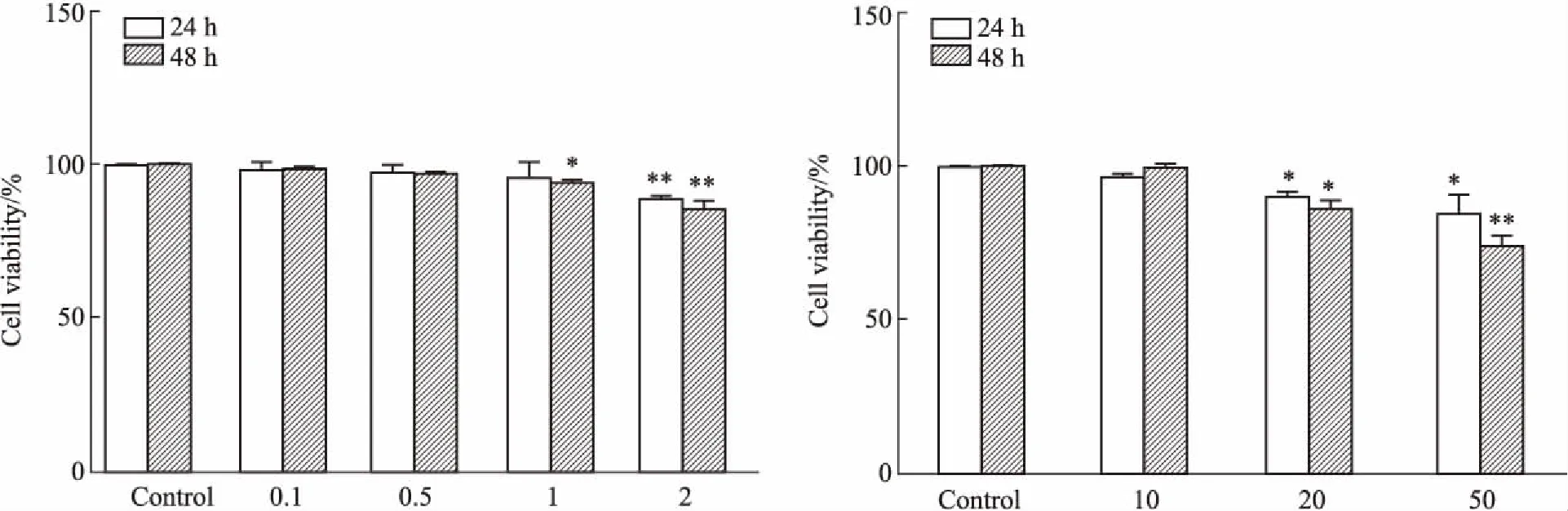
Fig 1 Cell viability of HepG2 cells treated with different concentrations of (A) PA or (B) UK5099 n=6)

Fig 2 Intracellular lipid accumulation in HepG2 cells treated with PA and UK5099 (scale bar 50 μm) n=6)

Fig 3 Effect of UK5099 treatment on relative mRNA levels of AMPK-ACC pathways in HepG2 cells treated with n=6)
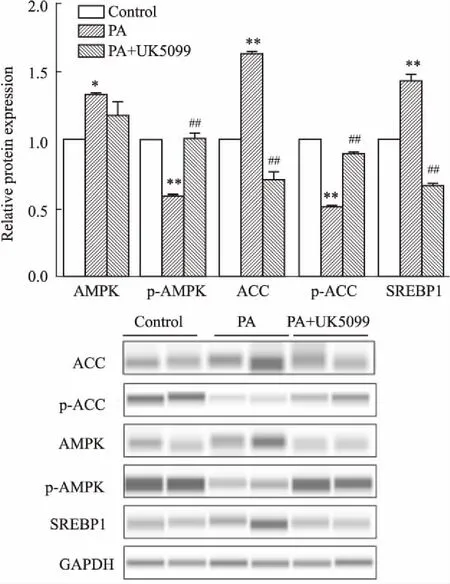
Fig 4 Effect of UK5099 treatment on protein levels of AMPK, p-AMPK, ACC, p-ACC, SREBP1 in HepG2 cells treated with n=3)
AMPK-ACC通路在体内脂质代谢中具有关键调控作用[12]。ACC可以控制丙二酰辅酶A的生成,进而参与脂质新生,并且能下调CPTIA,抑制脂肪酸氧化[13]。AMPK在调控ACC活性中具有关键作用[14-16],AMPK通过磷酸化激活后,进一步磷酸化ACC,使后者失去活性,进而抑制脂质新生,并上调CPT1A的活性,从而促进肝细胞脂质分解[17]。我们选用PA诱导 HepG2细胞建立体外高脂负荷模型,添加MPC抑制剂UK5099加以干预,探究MPC在肝细胞脂肪变性中的作用。本研究通过油红O染色实验、RT-PCR以及全自动蛋白质量分析实验首次发现,0.5 mmol·L-1PA诱导HepG2细胞48 h后,胞质内油脂堆积水平明显提高,p-AMPK、p-ACC蛋白表达水平明显降低,SREBP1蛋白表达水平则明显升高。进一步的抑制MPC,则可逆转榈酸所致HepG2细胞脂质堆积情况,同时能够提高p-AMPK、p-ACC蛋白表达水平,降低脂质合成关键因子SREBP1蛋白表达水平,并提高脂肪酸β氧化关键基因CPT1A mRNA的表达水平。说明MPC抑制剂可以激活AMPK-ACC通路,改善肝细胞脂肪变性情况。
综上可知,体外抑制MPC可以通过激活AMPK-ACC通路,改善细胞脂质堆积情况。本实验初步阐明了MPC与脂质代谢机制,为后续治疗NAFLD肝细胞脂肪变性提供科学依据。由于时间限制,抑制MPC活性对脂质堆积的影响的功能研究中,仅从降低其活性单方面验证了这一现象,尚未进行增强表达 MPC对脂质代谢的影响。今后的研究中将利用细胞转染、转基因小鼠等进一步完善这部分内容,此外,MPC是否可以调控其他脂质代谢相关通路有待进一步探索。

