HIST1H3D基因在宫颈癌中的表达及其临床意义
周滑雪 杜丹丽 叶国柳
宫颈癌(cervical cancer,CC)是最常见的女性生殖道恶性肿瘤。2018年全球女性癌症统计报告显示,每年约有569 847名新的宫颈癌患者被确诊,约有311 365名女性死于宫颈癌[1]。其发病率在近10 多年来逐渐上升[2]。且近年来随着人们生活习惯及生活方式改变,宫颈癌发病的年轻化趋势明显增加,严重危及女性生殖健康。早期疾病通常可以通过手术和/或放化疗治愈,预后良好[3]。对于有骨盆外病变的妇女,5年生存率仅为17%。对于复发性疾病的妇女,预后更差,5年生存率低于5%[4]。因此,寻找治疗宫颈癌的新策略、有效方法和探索影响其预后的因素至关重要。
HIST1H3D基因位于6号染色体上,编码人类H3类组蛋白变体H3.1[5],编码基因中没有内含子,转录本中没有多聚腺苷酸尾[6]。组蛋白是参与真核细胞染色质缩合的基本核蛋白。组蛋白有五种类型:H1/H5、H2A、H2B、H3、H4。早在1970年Turner等研究表明组蛋白参与了各种恶性肿瘤的发病机制[7]。组蛋白通过对氨基酸的共价修饰来调控染色质状态,进而进一步调控基因表达。事实上,越来越多的证据表明组蛋白变体与癌症生物学有关。例如,在许多不同的肿瘤类型中,特定变体的表达水平与肿瘤恶性程度相关[5]。有研究表明,组蛋白H3 mRNA在肿瘤中积累,上调组蛋白H3 mRNA表达可提高肿瘤细胞的增殖活性[8]。最近有研究表明不仅HIST1H3D在原发性胃癌组织中表达上调,在进展期胃癌患者骨髓中组蛋白mRNA表达上调[9]。2017年Rui等研究发现肺癌组织中HIST1H3D的表达较癌旁非癌组织有所增加[6]。但关于HIST1H3D基因在宫颈癌中的表达情况尚未有文献报道。
本文通过免疫组化法检测HIST1H3D基因在宫颈癌和不同宫颈上皮内病变组织中的表达情况,进一步分析HIST1H3D基因在宫颈癌组织中的表达情况与临床病理特征、盆腔转移的关系,为宫颈癌的临床诊断、治疗及判断预后提供理论依据。
1 材料与方法
1.1 临床资料
选取2012年02月至2013年12月在蚌埠医学院第一附属医院接受手术治疗并经过病理确诊为宫颈癌的患者,筛选出病理及资料完善的标本74例。其中年龄≤45岁26例,>45岁48例。鳞癌58例,腺癌16例。FIGO分期:ⅠA期9例,ⅠB期46例,ⅡA期19例。选取同时期经病理确诊的低级别上皮内病变(low-grade squamous intraepithelial lesion,LSIL)标本20例、高级别上皮内病变(high-grade squamous intraepithelial lesion,HSIL)标本20例。同期因子宫肌瘤行子宫切除术,术后病理诊断为正常子宫颈组织20例 。术前均未经过放化疗。其中宫颈癌组年龄(48.34±8.08)岁,LSIL组年龄(47.40±7.92)岁,HSIL组年龄(48.4±7.41)岁,正常宫颈组(47.80±5.16)岁。四组年龄比较无统计学差异(F=0.101,P=0.959>0.05,MS组间=5.852,MS组内=57.745)。
1.2 试剂
Histone H3.1 Antibody(组蛋白H3.1抗体)来自美国R&D公司。免疫组织化学SP法试剂盒和二氨基联苯胺(DAB)显色剂购自北京中杉金桥生物科技有限公司。
1.3 仪器与设备
Olympus BX-41型显微镜购于日本Olympus公司,Leica-RM2235型切片机购自德国。
1.4 方法
1.4.1 操作 所有病理标本先行HE染色,病理组织形态清晰完整,均由2名病理科医生对其组织分化类型进行证实。免疫组化SP法,操作方法按试剂盒及相关说明方法操作。用已知的阳性切片做阳性对照,PBS代替一抗染色后的组织切片作为阴性对照。
1.4.2 结果判断 显微镜下盲选5个视野(×400),每个视野计细胞100个。按照显色细胞之比进行评分:阳性细胞<10%为0分,10%~25%为 1 分,26%~50%为 2 分,51%~75%为 3 分,76%~100%为 4 分。按照细胞的染色程度进行评分:无着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。计算这两项指标相加得到免疫组化评分,0~2分为阴性(-),3分为弱阳性(+),4~5分为阳性(2+),≥6分为强阳性(3+)。本实验≥3分为阳性表达。
1.5 统计方法
应用SPSS 22.0软件,主要采用方差分析、χ2检验、Fisher确切概率法,以P<0.05为差异有统计学意义。
2 结果
2.1 HIST1H3D基因在不同宫颈组织中的表达
HIST1H3D基因表达的组蛋白H3.1定位在细胞核,主要呈棕褐色,其阳性表达率在正常宫颈组织、LISL、HISL及宫颈癌组织中逐渐升高,且差异有统计学意义(P<0.05)。在正常宫颈组织中阳性表达2例(10.0%)。LSIL中阳性表达5例(25.0%)。HSIL中阳性表达8例(40.0%)。宫颈癌中阳性表达53例(71.6%),见表1。
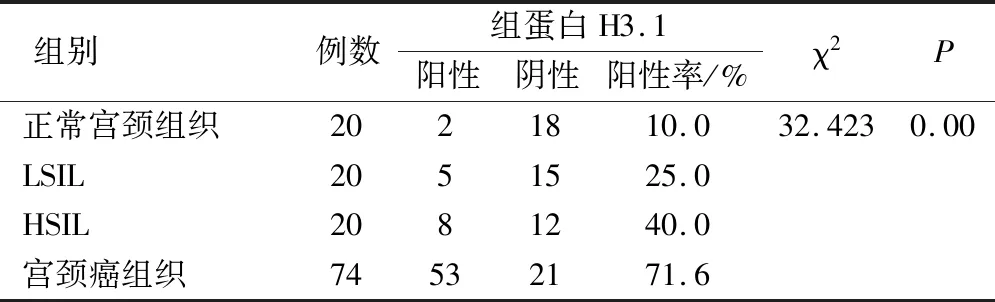
表1 组蛋白H3.1在不同宫颈组织中的表达/例
宫颈癌组织中组蛋白H3.1的阳性表达与正常宫颈组织(χ2=20.769)、LSIL(χ2=14.481)、HISL(χ2=6.911)比较,差异均具有统计学意义,P<0.05。
2.2 HIST1H3D基因表达与宫颈癌临床病理特征的关系
根据免疫组化结果分析,组蛋白H3.1表达与宫颈癌病理分化等级、淋巴结转移、FIGO分期有关,差异有统计学意义(P<0.05)。其与患者年龄、病理分型、肿瘤大小无关,差异无统计学意义(P>0.05),见表2。
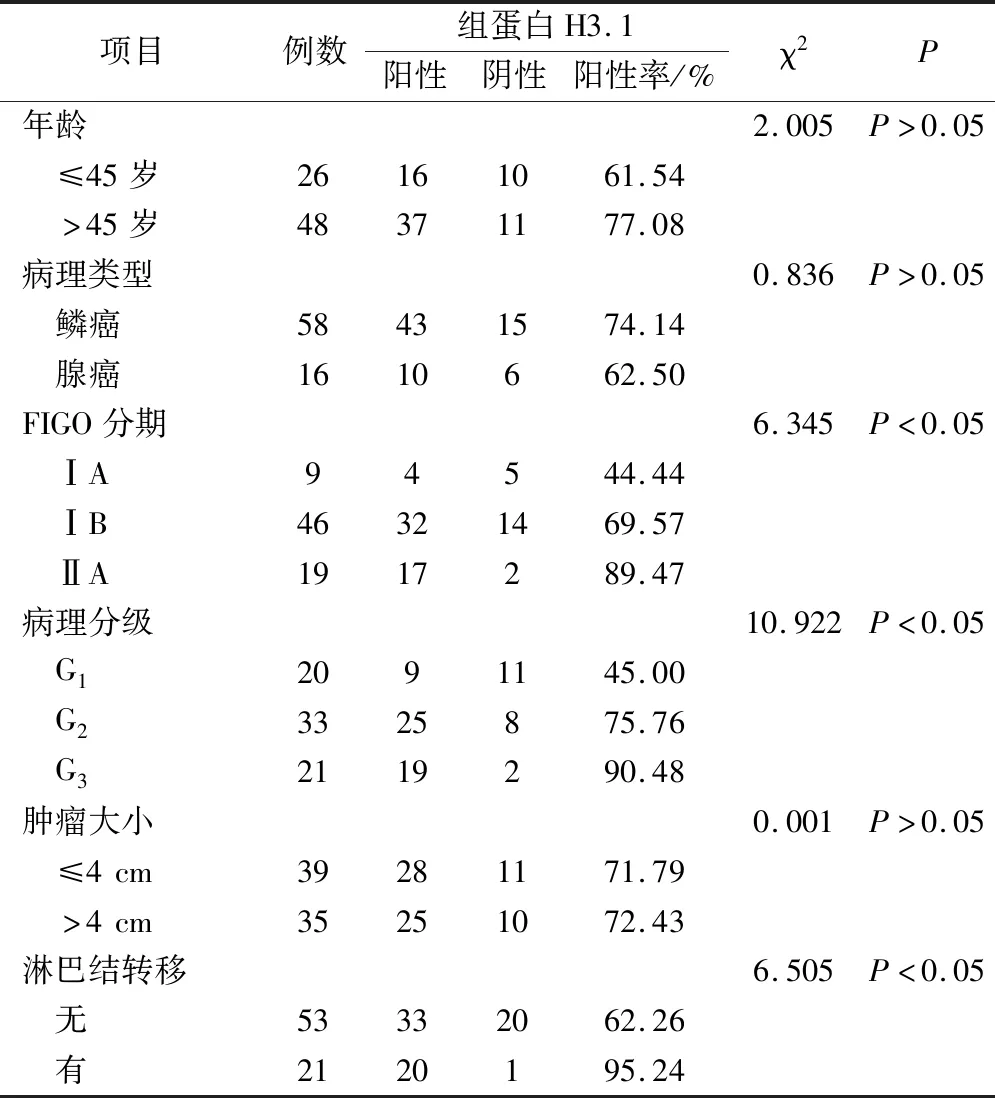
表2 HIST1H3D基因表达与宫颈癌临床病理特征的关系/例
3 讨论
组蛋白是染色质中最丰富的蛋白质。组蛋白有五种类型:H1/H5、H2A、H2B、H3、H4。其中H2A、H2B、H3和H4为核心组蛋白,各两分子构成组蛋白八聚体,其外由一条0~147个碱基对组成的DNA包绕1.65圈,形成真核细胞染色质的基本组成部分-核小体[10]。除了组蛋白H4之外,所有的核心组蛋白都有称为组蛋白变体的非等位亚型[11]。这些组蛋白变体是调节基因组DNA转录、修复、复制和重组的关键表观遗传学参与者。组蛋白变体整合到核小体中,导致核小体结构的多样性,从而导致染色质结构的多样性[12]。
组蛋白H3家族包含216个不同的成员,来自不同的物种。迄今为止在人类细胞中被确认存在的有8个变体:H3.1、H3.2、H3.3、H3T、H3.5、H3.X、H3.Y和CENP-A,其编码基因大多数位于6号染色体上[13]。但最近有研究发现了3个新的人类组蛋白H3变体,命名为H3.6、H3.7和H3.8[14]。其中H3.1、H3.2和H3.3在体细胞中较为常见。这些变体在表达、染色质定位和修饰状态等方面存在较大差异。因此将H3变体分为两个亚组,它们的数量因物种而异。复制组蛋白在S期表达达到高峰,构成S期主要的组蛋白供应DNA复制,它们以DNA合成耦合(DSC)的方式沉积,在人类中主要为H3.1和H3.2。置换变异体通常独立于S期表达,以一种与DNA合成无关(DSI)的方式整合,人类最典型的是为H3.3与着丝粒H3 CENP-A变体[15]。
组蛋白H3由大约136氨基酸组成[15]。组蛋白的非结构化N端尾部由大约30个延伸到核小体外的残基组成,由于其残基突出核小体外这一独特的结构使得N端是非常活跃的,尤其是组蛋白H3和H4的N端,是组蛋白翻译后广泛修饰的位点[16]。已被确定的翻译后修饰(PTMs)包括甲基化、乙酰化、羟基异丁基化、琥珀酰化、丙二酰化、谷氨酸酰化、糖基化修饰、磷酸化和泛素化等[17]。这些修饰改变了染色质结构,在调节基因表达中起着关键作用。例如乙酰化的组蛋白可以中和赖氨酸残基,减少组蛋白结合DNA,使DNA处于更放松的结构,从而促进转录。但组蛋白的异常修饰可导致染色体结构和基因转录的改变,在癌细胞增殖、分化和凋亡中起着重要作用[16]。
早在1970年Turner等研究表明组蛋白参与了各种恶性肿瘤的发病机制[7]。有研究表明组蛋白H2变体γH2AX在宫颈癌和卵巢癌细胞系中过表达。H2A.Z在转移性黑色素瘤、膀胱癌、前列腺癌和乳腺癌中累积。H2A.Z.1在肝细胞中过表达,且被认为是预后不良的1个标志。此外,组蛋白H3变体CENP-A在乳腺癌和肺癌组织中过表达[18]。2012年Rheinbay等研究表明组蛋白突变会导致儿童胶质母细胞瘤[19]。2014年Dryhurs等研究表明前列腺癌与组蛋白H2A有关[20]。对于组蛋白H3,2013年Twaya等研究发现不仅HIST1H3D在原发性胃癌组织中表达上调,在进展期胃癌患者骨髓中组蛋白mRNA表达上调[9]。2017年Rui等采用免疫组织化学和RT-PCR检测发现肺癌组织中HIST1H3D的表达较癌旁非癌组织有所增加,且通过流式细胞术对细胞周期进行分析,阐明HIST1H3D对细胞生长调控作用的基础机制。其发现将调HIST1H3D可诱导G0/G1细胞周期阻滞,这表明它是通过调节细胞周期的进程来促进人类肺癌细胞增殖和集落形成[6]。
本研究通过免疫组化检测HIST1H3D基因在不同宫颈上皮内病变组织和宫颈癌组织中的表达情况。最终发现HIST1H3D基因表达的组蛋白H3.1定位在细胞核,主要呈棕褐色,其阳性表达率在正常宫颈组织、LISL、HISL及宫颈癌组织中逐渐升高,差异有统计学意义(P<0.05),提示组蛋白H3.1可能参与了宫颈癌及其癌前病变发生发展的全过程,在宫颈病变的早期已有组蛋白H3.1的过表达。HIST1H3D基因的表达与宫颈癌的组织病理学分化程度有关,病理分级越高表达越高。且随着临床分期越晚,其阳性表达率越高,差异有统计学意义。此外,本实验结果显示淋巴结转移阳性组的组蛋白H3.1的表达率高于淋巴结转移阴性组,说明该基因在宫颈癌中的表达与淋巴结转移呈正相关,此结果与Rui等研究肺癌中组蛋白H3.1的表达与临床分期、淋巴结转移情况相关的研究结果一致[6]。本研究发现组蛋白H3.1的表达与年龄、病理类型、肿瘤大小无关。
综上所述,宫颈癌组织中 HIST1H3D基因呈现高表达,且其表达水平与肿瘤临床分期、病理分化程度、淋巴结转移密切相关,可作为判断宫颈癌的发生发展及淋巴结转移的参考指标,未来需要进一步地深入研究,期望HIST1H3D基因可以成为宫颈癌基因治疗的有效靶点之一。

