浅析耐次氯酸盐漂白色牢度试验方法中试液的配制
纺织品的耐次氯酸盐漂白色牢度是指在商业漂白中,织物在常规浓度的次氯酸盐溶液中浸泡、水洗后,再在过氧化氢或者亚硫酸氢钠溶液中搅动、清洗干燥后颜色的保持能力。目前84消毒液以及带有漂白功能的洗涤剂应用越来越广泛,其中一类为含有一定浓度的次氯酸钠,利用次氯酸钠中的有效氯达到漂白、消毒等作用,因此在使用带有漂白功能的洗涤剂对衣物进行清洁时,可能会使织物掉色。纺织品生产过程中的漂白、水洗,消费过程中含氯漂成分的洗涤剂和消毒剂的广泛使用,都要求织物要有很高的耐次氯酸盐漂白色牢度,因此纺织品的耐次氯酸盐漂白色牢度也成为判断织物内在质量的一项重要指标。
笔者按标准GB/T 7069—1997《纺织品 色牢度试验 耐次氯酸盐漂白色牢度》进行了数次试验,发现按照标准给出的方法很难配制出符合标准要求的次氯酸钠试液,且标准对试验中用到的其他试液描述过于简单,使试验人员无法准确把握其用量。本文就标准中存在的这些问题做进一步补充说明,并给出相应的解决方法。
1 标准GB/T 7069—1997中存在的问题
标准GB/T 7069—1997中所用到的试液及其要求如表1所示。
根据标准GB/T 7069—1997规定,含有效氯2g/L的次氯酸钠试液配制方法为:取次氯酸钠浓溶液20mL,用三级水稀释至1L,得到次氯酸钠稀溶液备用;取25mL次氯酸钠稀溶液置于250mL的锥形瓶中,依次加入过量碘化钾和过量盐酸溶液进行充分反应,然后用0.1mol/L的硫代硫酸钠溶液进行滴定,淀粉做指示剂。假设滴定耗用的硫代硫酸钠体积为V,则试验中应抽取的次氯酸钠稀溶液的量为14100/V(mL)。抽取14100/V(mL)的次氯酸钠稀溶液,将其稀释至900mL后用10g/L的碳酸钠溶液调节pH至11.0±0.2,最后再定容至1L,即可得到有效氯浓度为2g/L的试液。
按照上述标准规定的配制方法进行试验,我们发现了以下几点问题:

表1 试液的要求
(1)一般情况下,实验室购买到的次氯酸钠浓溶液很难达到标准所要求的有效氯浓度(140g/L~160g/L),而且次氯酸钠溶液的稳定性较差,在贮运过程中会渐渐失去有效氯。所以,按照标准规定的方法进行次氯酸钠试液配制时,我们进行了两次滴定,所消耗的硫代硫酸钠溶液的体积都不足14.1mL,这种情况下我们按照14100/V(mL)的量抽取的次氯酸钠稀溶液就都大于1000mL,无法再进行后续的稀释定容。因此我们需要增加抽取次氯酸钠浓溶液的量,进行多次滴定,这样在一定程度上既增加了实验室成本,又延长了试验时间。
(2)标准中未对碘化钾(KI)、盐酸(HCl)和淀粉指示液的用量、浓度及配制方法做出具体规定。
(3)对于滴定用的0.1mol/L的硫代硫酸钠溶液,虽然实验室可以买到,但是难免会发生买到的硫代硫酸钠溶液用完或者其浓度不符,此时就需要实验室自行配制,标准中未涉及所用硫代硫酸钠溶液的配制方法。
笔者就试验过程中发现的问题,参照标准GB 19106—2013《次氯酸钠》[1]、GB/T 601—2016《化学试剂 标准滴定溶液的制备》[2]、GB/T 603—2002《化学试剂 试验方法中所用制剂及制品的制备》[3]及相关书籍文献,对试验所用的碘化钾,盐酸等试液的用量及配制进行了详细说明,并通过标定次氯酸钠浓溶液中有效氯浓度的方式配制次氯酸钠试液。
2 试液的配制
2.1 仪器与设备
容量瓶(1000mL);单标移液管(20mL、25mL);酸式滴定管(50mL);碱式滴定管(50mL);量筒(100mL、50mL);碘量瓶(250mL、500mL);搪瓷缸或棕色玻璃器皿(1000mL);烧杯;4号玻璃滤埚;精密pH计;分析天平;电热恒温干燥箱。
2.2 碘化钾溶液的用量及配制
(1)用量:在酸性条件下,次氯酸钠溶液可以将碘离子氧化成碘单质,碘单质不易溶于水,因此需要有碘化钾来增加其溶解度,故在试验中碘化钾应该过量。但是碘化钾的浓度太大会使生成的单质碘全部溶解而无法被淀粉吸附,进而使碘与淀粉产生的蓝色不明显。参照标准GB 19106—2013,应使用10%的碘化钾溶液,用量为10mL[1]。
(2)配制:称取100g碘化钾,溶解于1000g三级水中,可得10%的碘化钾溶液。
2.3 盐酸溶液的用量及配制
(1)用量:碘化钾与次氯酸钠反应生成碘单质需要在酸性条件下进行,且次氯酸钠溶液呈碱性。因此试验中必须加入足量的酸,不仅能中和次氯酸钠溶液中的碱,而且要为反应提供酸性环境。但酸也不能加入太多,在强酸环境里,滴定用的硫代硫酸钠会分解析出单质硫,使溶液变浑浊[4],不利于滴定终点的判定。不同文献对酸液的使用要求也不同,参照标准GB 19106—2013中硫酸的用量,盐酸浓度为1mol/L,用量为20mL。
(2)配制:盐酸的配制根据公式(1),即用已知质量分数的盐酸配制出所需浓度的盐酸。

式中: ρ——已知盐酸的密度,kg/L; ω——已知盐酸的质量分数,%;V1——已知盐酸的体积,mL;c——盐酸物质的浓度,mol/L;V2——试验所用已知盐酸的体积,mL;M——盐酸的摩尔质量,36.46g/mol。
一般情况下,实验室购买到的为36%的盐酸,查阅相关资料可知36%的盐酸密度为1.179kg/L。所以配制1mol/L的盐酸500mL需要取36%的盐酸43mL,然后稀释至500mL。
2.4 淀粉指示液的浓度及配制
(1)浓度:参照标准GB 19106—2013,淀粉指示液的浓度为10g/L。
(2)配制:称取1g淀粉,加5mL水使其成糊状,在搅拌下将糊状物加到90mL沸水中,煮沸1min~2min,冷却,用煮沸且冷却的三级水稀释至100mL,即可得到10g/L的淀粉指示液。使用周期为两周。
2.5 硫代硫酸钠溶液(0.1mol/L)的配制
参考标准GB/T 601—2016,0.1mol/L的硫代硫酸钠溶液配制方法如下:称取26g五水合硫代硫酸钠(Na2S2O3·5H2O)或16g无水硫代硫酸钠(Na2S2O3),溶于1000mL三级水中,加入0.2g碳酸钠(Na2CO3),缓缓煮沸15分钟后冷却至室温。存放于棕色瓶中两周后用4号玻璃滤埚过滤备用。称取基准重铬酸钾[于(120±2)℃下干燥至恒量]0.18g于500mL碘量瓶中,加入25mL三级水使其溶解,依次加2g碘化钾(KI)和20mL硫酸(20% H2SO4),摇匀后在暗处放置10min,然后加约150mL三级水稀释。用配制好的硫代硫酸钠溶液进行滴定,当溶液由棕红色变为浅黄绿色时暂停滴入硫代硫酸钠,此时加入10g/L淀粉指示液2mL,溶液变成蓝色,继续加入硫代硫酸钠滴定,当溶液由蓝色变为亮绿色时为滴定终点,读取并记录消耗硫代硫酸钠的体积V1。同时做空白试验(除不加重铬酸钾外其余同上)。
CNa2S2O3硫代硫酸钠标准滴定溶液的浓度按公式(2)计算:

式中:m——基准重铬酸钾质量,g; V1——标定中消耗硫代硫酸钠溶液的体积,mL; V2——空白试验消耗硫代硫酸钠溶液的体积,mL;M——重铬酸钾的摩尔质量,g/mol[M(1/6K2Cr2O7)=49.031]。
2.6 标定次氯酸钠浓溶液中有效氯浓度,配制有效氯为2g/L的次氯酸钠试液
在酸介质中,次氯酸钠与碘化钾反应析出碘,以淀粉为指示剂,用0.1mol/L的硫代硫酸钠溶液进行滴定,直至溶液蓝色消失时为终点,反应式如下:

次氯酸钠溶液中加酸后释放出氯气,以若干克质量的氯气在水中所具有的氧化能力来表示次氯酸钠有效氯浓度,反应式如下:

由反应式(1)~(4)可知:2Na2S2O3→I2→Na-ClO→Cl2,因此1mol次氯酸钠的氧化能力等于1mol氯气的氧化能力。
取次氯酸钠浓溶液10mL,稀释至500mL,取稀释后的次氯酸钠溶液25mL,加入10%的碘化钾溶液10mL,1mol/L的盐酸20mL,10g/L的淀粉溶液做指示液,用0.1mol/L的硫代硫酸钠溶液进行滴定,假设消耗硫代硫酸钠溶液的体积为V0,根据上述反应原理,则次氯酸钠浓溶液中有效氯浓度按公式(3)计算:
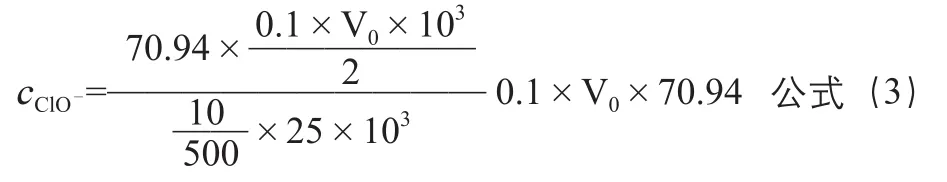
为了得到有效氯为2g/L的次氯酸钠试液,需要抽取次氯酸钠浓溶液的体积(mL)按公式(4)计算:

抽取计算所得的次氯酸钠浓溶液,将其用三级水稀释至900mL后,在(20±2)℃的环境中用10g/L的碳酸钠溶液调节其pH到11.0±0.2,最后将其定容至1L,即可得到有效氯浓度为2g/L的试液。
2.7 按照GB/T 7069—1997配制次氯酸钠试液的过程分析验证2.6
由反应式(1)~(4)可得公式(5),计算次氯酸钠稀溶液的摩尔浓度:

式中:cNaClO——次氯酸钠稀溶液的摩尔浓度,mol/L;cNa2S2O3——滴定用硫代硫酸钠溶液的摩尔浓度,0.1mol/L;VNa2S2O3——硫代硫酸钠溶液的滴定用量,mL。

假设25mL次氯酸钠稀溶液中含x(mg)有效氯,根据上述反应式(1)~(4)可得:
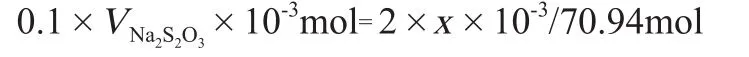
则,x(mg)=3.547VNa2S2O3,那么2g/L有效氯需要次氯酸钠稀溶液的量为:

抽取的次氯酸钠稀溶液,再稀释至1L,此时溶液有效氯浓度是:

2.8 滴定终点的判断
次氯酸钠溶液呈黄色,在次氯酸钠溶液中加入过量碘化钾和酸性溶液后暗处静置约5分钟待其充分反应,此时溶液呈棕黄色,滴入硫代硫酸钠溶液,轻轻振荡锥形瓶且滴定速度适当加快,溶液颜色慢慢变浅,直至变成浅黄色时(即大部分的碘滴完),滴入淀粉指示剂,溶液变蓝色,继续滴入淀粉指示剂使溶液蓝色开始变浅,此时即意味着接近滴定终点,应该缓慢滴入硫代硫酸钠溶液且积极振荡锥形瓶使碘从淀粉中脱附,至蓝色消失且半分钟内不再变蓝为终点。
滴定好的溶液稍放置后又会出现蓝色,这是由于溶液中的I-被空气氧化成了I2,不影响试验结果,不予做任何处理[4]。
淀粉对碘单质的吸附性很强,所以滴定前不能先加入淀粉,必须要待溶液中存在少量碘时(溶液从棕黄色变成浅黄色时),否则淀粉会吸附大量碘,碘从淀粉中脱附需要很长时间,因此溶液易被滴定过量[4]。
3 注意事项
(1)次氯酸钠溶液具有很强的腐蚀性,操作人员必须经过专门培训,严格遵守操作规程,佩戴好防护用具,注意安全。
(2)次氯酸钠溶液稳定性差,见光易分解,长时间放置后有效氯浓度会降低,所以次氯酸钠原液必须避光、避热、密封保存;试验用的次氯酸钠必须现配现用且每次配制时做定量分析。
(3)盐酸配制时要将盐酸缓缓倒入水中,严禁将水倒入盐酸中,防止发生爆炸,且试验人员必须佩戴好橡胶手套,戴好防护面具及防护口罩,防止盐酸溅到面部或眼睛内。
——硫代硫酸钠

