杜鹃兰无根苗生根与组培苗移栽研究
王跃华 陈芳 陈燕 马涛 石鑫 张益菠


摘要 以杜鹃兰无根苗为材料,通过正交试验考察基本培养基类型、植物生长调节剂和活性炭3个因素对杜鹃兰无根苗生根的影响,最终获得杜鹃兰不定根诱导的最适条件,并通过将组培苗移栽至不同的基质中对杜鹃兰组培苗驯化进行研究。结果表明,杜鹃兰无根苗不定根诱导的最优培养基为1/2MS+ IBA 0.3 mg/L+活性炭0.5 g/L;將获得的杜鹃兰组培苗移栽,草炭泥∶蛭石(1∶3)基质最适合用于杜鹃兰组培苗驯化,成活率最高达95.50%;用草炭泥∶锯末(1∶3)作为驯化基质,因价廉易得,可用于规模化组培苗驯化。
关键词 杜鹃兰;无根苗;生根;组培苗;移栽
中图分类号 S567文献标识码 A文章编号 0517-6611(2020)22-0172-02
doi:10.3969/j.issn.0517-6611.2020.22.045
Study on Rooting and Transplanting of Rootless Seedling of Cremastra appendiculata
WANG Yue-hua,CHEN Fang,CHEN Yan et al
(School of Biological Engineering,Chengdu University, Chengdu,Sichuan 610106)
Abstract Using rootless seedlings of Cremastra appendiculata as materials, the effects of basic medium type, plant growth regulator and activated carbon on the rooting of rootless seedlings of Cremastra appendiculata were investigated by using orthogonal test. The optimum conditions for adventitious rooting induction of Cremastra appendiculata were obtained. The transplanting of Cremastra appendiculata plantlets was studied by using different substrates. The results showed that the optimal medium for adventitious roots induction of Cremastra appendiculata was 1/2MS+IBA 0.3 mg/L + AC 0.5 g/L. The seedlings obtained from tissue culture were transplanted into substrate including peat mud∶vermiculite (1∶3), with the highest survival rate of 95.50%. It can be used for large-scale tissue culture seedlings domestication because of the low cost and easy availability of peat mud and vermiculite.
Key words Cremastra appendiculata;Rootless seedling;Rooting;Tissue culture seedling;Transplant
基金项目 四川省科技厅重点研发项目(2019YFN0090);四川省科技创新苗子工程项目(2018033)。
作者简介 王跃华(1963—),女,辽宁丹东人,教授,硕士,从事药用植物生物技术研究。
收稿日期 2020-04-14
杜鹃兰(Cremastra appendiculata(D.Don)Makino)为兰科杜鹃兰属多年生珍稀药用植物,为药材山慈菇、毛慈姑的原料[1]。现已经从杜鹃兰植物中分离出80余种化合物,包括生物碱、苄类、菲类、苷元、萜类和甾体类等成分,还含有少量的黄烷酮类、木质素类和酚类等化学成分[2-6]。主要分布在东亚地区,我国贵州、四川、云南、西藏、广东、湖北、湖南、河南、江西、浙江、台湾、安徽、江苏、山西、陕西和甘肃等地均有分布,集中在贵州、四川等地[7-9]。由于兰科植物存在繁殖障碍,繁殖系数极低,资源再生速度极慢,加之对野生资源的过度采挖,造成资源储存量骤减。人工种植方面,由于种苗极其短缺,且栽培技术鲜少有人进行系统的研究[10]。当前,仅有少数学者开展了对杜鹃兰植物的快速繁育研究[11-14]。该试验以杜鹃兰无根苗为材料,通过正交试验筛选出杜鹃兰不定根生长的最适培养条件,并进一步完成了对杜鹃兰组培苗的驯化试验研究。
1 材料与方法
1.1 材料
试验材料选取成都大学生物技术实验室培养的高3~4 cm杜鹃兰无根苗。
1.2 方法
1.2.1 不同因素对杜鹃兰无根苗诱导生根的影响。
采用L9(34)试验设计,以基本培养基类型(MS、1/2MS、1/4MS)、IBA浓度(0、0.3、0.5 mg/L)、活性炭浓度(0、0.5、1.0 g/L)为3个因素,每个因素各设3个水平,研究基本培养基类型、IBA浓度、活性炭浓度对杜鹃兰无根苗诱导生根的影响。每瓶接种5株杜鹃兰无根苗,不定根诱导因素水平见表1。
1.2.2 组培苗移栽基质筛选。
杜鹃兰无根苗完成生根培养后,放置于室外晾晒7 d,开盖取出组培苗,洗去杜鹃兰组培苗基部的基质,在添加了多菌灵和生根粉(1 000倍)溶液中浸泡组培苗根部30 min后,取出晾干组培苗根部表面的多余水分,在晴天移栽至已用70%遮光率的遮阳网遮阴的移栽基质中,驯化30 d后,统计成活率,以根开始生长为成活标志。
1.2.3 数据处理。
根诱导率=诱导出根的无根苗数/接种无根苗数×100%;成活率=成活的组培苗数/移栽组培苗数×100%。
2 结果与分析
2.1 杜鹃兰无根苗生根
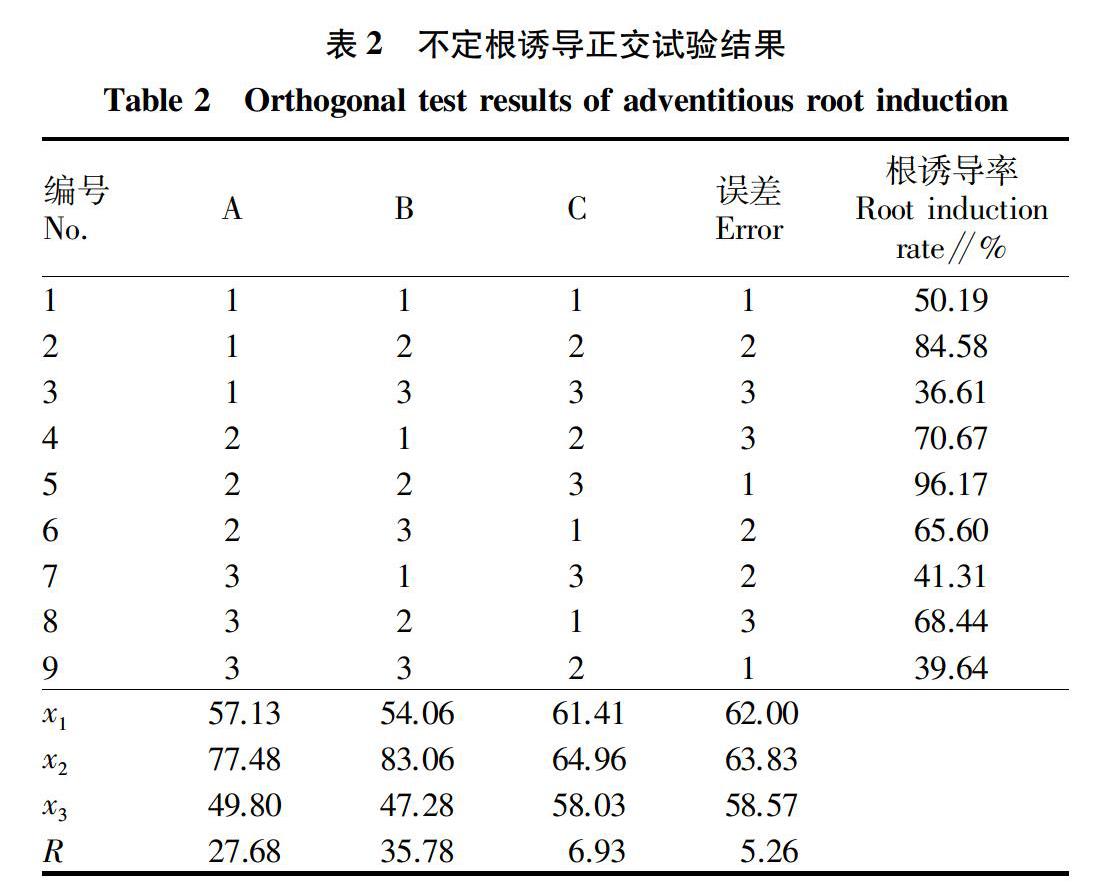
根据正交试验设计,选取杜鹃兰高3~4 cm的无根苗,保留完整假鳞茎切下,转接入不同的培养基中进行不定根诱导研究,置于培养室中培养30 d,记录与统计杜鹃兰无根苗生根情况。结果见表2。
由表2可知,以杜鹃兰无根苗为材料,接入培养基中进行不定根诱导研究,5号组合A2B2C3不定根诱导率最高,培养30 d后不定根诱导率高达96.17%,在3号组合(A1B3C3)中不定根诱导率最低,为36.61%。通过极差R分析可知,3个因素对杜鹃兰无根苗诱导生根的影响程度依次为B>A>C,即IBA濃度影响最大,之后是基本培养基,影响最小的是活性炭浓度;杜鹃兰无根苗诱导不定根的最佳组合为A2B2C2,即1/2MS+IBA 0.3 mg/L+活性炭0.5 g/L,经试验验证,杜鹃兰无根苗在1/2MS+IBA 0.3 mg/L +活性炭0.5 g/L的培养基中培养30 d后,不定根诱导率高达97.08%,得到的组培苗根壮且长,根毛多。潘虹虹等[15]在春石斛生根研究中发现,在培养基1/2MS+IBA 0.5 mg/L +活性炭0.5 g/L中,生根率达95%,研究结果与该研究相似。
通过观察可知,将杜鹃兰无根苗接入1/2MS+IBA 0.3 mg/L +活性炭0.5 g/L的培养基中培养,培养7 d后,杜鹃兰无根苗开始启动,培养12 d后,假鳞茎基部开始长出白色新根,之后,新根继续伸长,呈辐射状,未伸入培养基中的根表面密被大量白色绒毛。
方差分析结果表明,3个因素中因素A和因素B达到显著水平,因素A检验值F=28.89、F0.05=19.00、F0.01=99.00,检验值F0.05 2.2 移栽基质筛选 当杜鹃兰组培苗生长健壮,有2~3条 2 cm 以上的根时,将培养瓶从组培室取出,晾晒7 d,开盖晾晒2 d后取出,清洗杜鹃兰组培苗后,在添加了多菌灵和生根粉(1 000倍)的溶液中浸泡组培苗根部30 min后,稍微晾干表面水分,再将其移栽至不同营养基质中;适当遮光,每周用稀释1 000倍的1/2MS大量元素溶液喷洒杜鹃兰组培苗一次,在移栽30 d后统计杜鹃兰组培苗成活率。结果见表3。 由表3可知,杜鹃兰组培苗移栽至草炭泥∶蛭石(1∶3)的基质中,组培苗长势好,叶片颜色为深绿色,新根生长快,驯化成活率最高为95.50%。研究发现,纯草炭泥中杜鹃兰组培苗驯化成活率低,草炭泥虽然质地轻盈,较为蓬松,透气性好,但透水性较差,因而不利于植株的生长,植株的根也可能因为水分过多而腐烂。将蛭石加入到草炭泥中,一方面可以改善草炭泥的透水性,另一方面良好的水肥吸收能力和自身含有的丰富营养元素可以长期稳定地为植物提供水分与营养物质,从而促进植物的生长,因而在草炭泥中加入适量蛭石后,能使杜鹃兰移栽成活率大幅度提高。在草炭泥中加入锯末,同样可增加基质的透水性,虽然成活率较添加蛭石时低,但该基质容易得到且成本低廉,因而可用于规模化组培苗驯化。 将组培苗经消毒处理后移栽至由草炭泥和蛭石组成的基质中,每7 d喷洒一次1/2MS大量元素1 000倍溶液一次,移栽7 d后,杜鹃兰叶片开始增厚且颜色加深,由浅绿转为深绿;20 d后,杜鹃兰根尖伸长,开始长出白色根尖,四周密被白色根毛;30 d后部分杜鹃兰假鳞茎基部开始长出白色新根,移栽60 d后,假鳞茎环纹处开始长出新的假鳞茎,移栽90 d后,新长出的假鳞茎如豌豆大小。 3 讨论 生根与移栽是杜鹃兰种苗生产的最后一步,生根情况与种苗移栽后的成活率息息相关。该研究通过正交试验,探究了基本培养基类型、IBA浓度和活性炭浓度对杜鹃兰无根苗生根诱导的影响,并探讨不同移栽基质对杜鹃兰组培苗移栽成活率的影响,获得杜鹃兰无根苗生根与移栽的最适条件。 研究发现,激素IBA对杜鹃兰生根有促进作用,但激素具有双重作用,高浓度的IBA对杜鹃兰无根苗的不定根诱导具有一定的抑制作用。在培养基中添加了少量活性炭,培养基由白色透明变为黑色不透明,透光率急剧下降,提供的类似土壤中的暗环境可以促进植株不定根的生长,并且可以吸收植物生长调节物质与其他有利于生根的物质,还可以防止组培苗的褐化,因而适量添加活性炭有助于植物的生根[16]。 种苗的移栽需要考虑植物生物学习性、基质和移栽环境等因素,笔者在种苗移栽过程中发现,杜鹃兰种苗对基质要求较高,疏松、透水、透气性好的基质利于杜鹃兰种苗的生长。杜鹃兰种苗对水分特别敏感,水分过多不利于移栽过程中新根的生长,甚至引起已有根的腐烂,因而在杜鹃兰移栽过程中要对水分进行严格的控制。另外,种苗抗逆性强,对低温等恶劣条件有较好的耐受性。
参考文献
[1] 中国药典委员会.中华人民共和国药典:2015年版 一部[S].北京:中国医药科技出版社,2015:32.
[2]SHIM J S,KIM J H,LEE J,et al.Anti-angiogenic activity of a homoisoflavanone from Cremastra appendiculata[J].Planta medica,2004,70(2):171-173.
[3] XUE Z,LI S,WANG S J,et al.Mono-,Bi-,and triphenanthrenes from the tubers of Cremastra appendiculata[J].Journal of natural products,2006,69(6):907-913.
[4] LIU L,LI J,ZENG K W,et al.Five new biphenanthrenes from Cremastra appendiculata[J].Molecules,2016,21(8):1-10.
[5] 李小平,原文珂,李建烨,等.杜鹃兰的化学成分研究[J].中草药,2016,47(3):388-391.
[6] 韦红边,吕享,高晓峰,等.兰科药用植物杜鹃兰的研究进展[J].贵州农业科学,2017,45(7):88-92.
[7] 张明生,戚金亮,刘志,等.药用兰科植物杜鹃兰的组织培养与快速繁殖[J].种子,2005,24(8):82.
[8] 陈谦海.贵州植物志:第10卷(种子植物)[M].贵阳:贵州科技出版社,2004:428.
[9] 沈连生.彩色图解中药学[M].北京:华夏出版社,2000:42.
[10] 郑宏钧,詹亚华.现代中药材鉴别手册[M].北京:中国医药科技出版社,2001:68.
[11] 吴彦秋,吕享,李小兰,等.杜鹃兰原球茎增殖培养条件[J].北方园艺,2016(19):124-128.
[12] 彭斯文,朱校奇,黄艳宁,等.杜鹃兰组培快繁基本条件研究[J].中国野生植物资源,2016,35(6):21-23,26.
[13] 毛堂芬,刘涛,刘作易,等.杜鹃兰离体快繁技术研究[J].中药材,2007,30(9):1057-1059.
[14] 廖婷婷,邹嘉欣,王万军.山慈菇快速繁殖体系的建立[J].北方園艺,2012(9):121-125.
[15] 潘虹虹,孙丹,廉美兰,等.几种外部因子对春石斛组培生根的影响[J].安徽农业科学,2008,36(29):12591-12592,12594.
[16] 孙占育,孙志强,曹斌.活性炭在促进组培苗植物生根中的作用[J].湖南农业科学,2010(7):3-5.

