肝移植术中预防性脾动脉结扎对脾动脉窃血高危患者的疗效分析
田大治,贺健,李江,张骊,张炜琪,蒋文涛(天津市第一中心医院肝移植科,天津市器官移植临床医学研究中心,中国医学科学院移植医学重点实验室,天津市器官移植重点实验室,天津 300192)
肝移植术后发生脾动脉窃血(splenic artery steal syndrome,SASS)的病例并不少见,其发生率约为2.6 %~10.1 %[1]。脾动脉窃血的主要特点是粗大的脾动脉与肝动脉(无外科相关并发症)相互竞争来自腹腔动脉的血液,导致肝脏低灌注状态,轻者可无明显临床表现,重者可表现为转氨酶升高、缺血性胆道病变、肝动脉栓塞,严重者可致移植物失功能[2]。研究表明肝移植术前脾动脉直径>5 mm、脾动脉直径/肝动脉直径>1.5 、脾体积>829 ml 为肝移植术后发生脾动脉窃血的高危因素[1]。为降低术后脾动脉窃血发生率,我们在术前评估中对高危患者进行识别,并于术中选择性结扎脾动脉,现将结果报告如下。
1 资料与方法
1.1 研究对象:选择2016 年9月— 2019年6月在天津市第一中心医院接受原位肝移植的受者,将符合纳入排除标准的列为研究对象。纳入标准:① 首次原位肝移植者;② 术前脾动脉直径>5 mm和/或脾动脉直径/肝固有动脉直径(splenic artery diameter/proper hepatic artery diameter,S/P)>1.5 和或脾体积>829 ml;③年龄≥18周岁。排除标准:① 术前行脾动脉栓塞、脾切除者;② 合并影响肝脏灌注的全身血液动力学疾病,如心力衰竭、休克;③ 合并肝动脉外科手术相关并发症;④ 存在血管先天畸形或变异,如腹腔干开口狭窄、肝动脉直接起自腹主动脉;⑤疑难死亡病例;⑥ 围术期相关临床资料不全者。共68例受者纳入本次研究。该研究得到天津市第一中心医院临床科研项目伦理委员会批准(2019N170KY)。
1.2 方法:所有入组受者术前均行腹部四期增强CT,经血管重建测量脾动脉、肝固有动脉直径,计算S/P,经影像处理技术测量脾体积。手术方式均采用经典非转流原位肝移植术式,术中肝动脉重建:受体侧采用肝总动脉与胃十二指肠动脉袢,供体侧采用腹腔动脉与脾动脉袢,进行对端吻合,缝线根据术中血管情况酌情选用7-0/ 8-0 prolene缝线。术中脾动脉结扎:关腹前,打开小网膜囊,在胰体上缘动脉搏动明显处显露脾动脉中段1~2 cm,采用动脉夹试阻断,并于阻断前后行术中超声检查,满足以下条件时采用双股0 号丝线结扎脾动脉:①试阻断后门静脉流速≥30 cm/s;② 试阻断后肝动脉血流较试阻断前改善。此次研究中,22 例受者满足上述条件,术中行脾动脉结扎,其余46例未行脾动脉结扎,结扎完成后精确止血。围术期免疫抑制方案:免疫诱导——巴利昔单抗+甲泼尼龙琥珀酸钠;免疫维持——他克莫司+吗替麦考酚钠+甲泼尼龙。术后定期监测血常规、肝肾功能、他克莫司浓度、移植肝血流等。收集受者的性别、年龄、原发病、Child-Pugh分级、Meld评分、脾体积、脾动脉、肝固有动脉直径、S/P、肝功能、移植肝血流、术后并发症情况等相关资料。
1.3 SASS诊断及治疗:所有受者术后定期经多普勒超声监测移植肝血流,若超声提示移植肝动脉血流偏细、流速下降或消失时,则急诊行血管造影术,符合下述所有条件[3-4]时可诊断为SASS:①未见移植肝动脉外科手术并发症,如吻合口狭窄、动脉呈锐角打折、动脉栓塞;② 肝动脉显影明显迟于脾动脉;③ 脾动脉造影剂排空时间明显快于肝动脉;④脾动脉直径≥5 mm和/或S/P ≥1.5 。
经血管造影确诊SASS后,术中使用血管封堵器对脾动脉主干进行栓塞,介入术后1周内,低分子肝素抗凝(4250 U i.h.Qd ),1周后更改为阿司匹林(100 mg p.o.Qd),术后早期使用抗菌药物预防感染。
1.4 统计学分析:应用SPSS 24.0 统计软件进行分析。计量资料之间均数比较采用t检验,计数资料比较采用χ2检验或Fisher 确切概率法。P <0.0 5为差异有统计学意义。
2 结果
2.1 一般资料:68 例受者中,男性56 例(82.3 5%),女性12 例 (17.6 5%),平均年龄为 (51.2 6 ±1.4 6) 岁;Child-Pugh 评分为5 ~13 分,平均为 (7.5 3±0.3 9) 分;MELD评分为7~26分,平均为(14.0 9±1.0 3)分,原发病中,乙型肝炎后肝硬化50 例(73.5 3%),酒精性肝炎肝硬化4 例(5.8 8%),自身免疫性肝炎肝硬化8例(11.7 6%),药物性肝损害4 例(5.8 8%),丙型肝炎后肝硬化2 例(2.9 5%),术前合并肿瘤受者29 例 (42.6 5%)。脾动脉结扎组与非结扎组相比,性别、年龄、Child-Pugh评分、MELD评分、原发病情况、术前肿瘤情况均无统计学差异。
2.2 脾动脉结扎的疗效:脾动脉结扎组与非结扎组术前相关临床指标比较(表1、图1),脾动脉直径、S/P、脾体积均无统计学差异。脾动脉结扎后,结扎组的脾动脉直径、S/P、脾体积明显低于非结扎组,差异有统计学意义(P <0.0 5)。二者肝移植术中肝动脉开放后流速无统计学差异,而术后结扎组的肝动脉流速(47.5 3±2.1 7)cm/s明显高于非结扎组(31.1 0±1.1 4)cm/s,差异有统计学意义(P <0.0 01)。两组之间术前术后的门静脉流速均无统计学差异。脾动脉结扎组与非结扎组术前丙氨酸转移酶(alanine aminotransferase,ALT)、总胆红素(total bilirubin,TBil)水平均无统计学差异,而肝移植术后1、2、3周时,结扎组的ALT和TBil 水平明显低于非结扎组,差异有统计学意义(P <0.0 5,图2和图3)。两组间的AST 水平在围术期相关时点(术前、术后1、2、3、4 周)均无明显差异。
2.3 术后并发症情况:脾动脉结扎组22 例受者中,在随访期间无SASS发生,非结扎组46 例受者中,10例(21.7 4%)于术后3个月内经血管造影确诊为SASS,两组间SASS发生率具有统计学差异(P <0.0 5,表2)。随访期间,非结扎组中14例受者(30.4 3%)出现肝移植术后持续性脾功能亢进,表现为顽固性低血小板和/或低白细胞血症,而结扎组中持续性脾亢发生率4.5 5%(1/22)明显低于前者,两者之间具有统计学差异(P <0.0 5)。两组受者术后的局限性脾梗死、缺血性胆道病变、脾动脉血栓形成发生率相比无明显统计学差异。
2.4 SASS的处理:本研究发生SASS的10 例受者,其中8例于术后3周内发现、其余2 例分别于术后27 d和31 d发现,均为术后超声提示肝动脉血流减弱,而后经血管造影确诊。确诊者均于介入术中使用血管封堵器对脾动脉主干进行栓塞,术后予以抗凝及预防感染治疗。在后续随访期间,各受者移植肝血流较栓塞前改善,且未出现其他合并症。
3 讨论
随着诊疗水平的不断提升,SASS作为肝移植术后的一种少见并发症,现已逐步被移植外科医生所认知,然而,关于其病理生理学机制尚存在一些争议。目前比较公认的是门脉系统高动力循环状态理论[5-6],该理论认为,终末期肝病患者在肝病病因的持续作用下导致门静脉压力升高,脾脏血管因此代偿性增粗变宽,肝移植术后增粗的脾脏血管并不能缩回至正常范围,因此,术后门静脉血运依旧相对丰富,由于肝动脉缓冲效应及脾动脉、肝总动脉共同开口于腹腔干的缘故,最终增粗的脾动脉从腹腔干“窃取”了相对更多的血液,使得肝动脉呈低灌注状态。
表1 脾动脉结扎前后相关临床指标的变化(±s)
术后门静脉流速(cm/s)结扎组22 6.6 2±0.3 4 3.8 9±0.2 3 2.2 0±0.1 9 1.0 9±0.0 8 1267±50.5 1 757±30.1 0 26.2 5±1.2 9 47.5 3±2.1 7 14.3 2±1.7 7 37.4 2±3.1 6非结扎组46 6.6 5±0.3 1 5.8 8±0.2 4 2.0 5±0.2 0 1.5 9±0.0 6 1197±43.7 6 874±31.9 4 28.4 0±0.8 3 31.1 0±1.1 4 13.1 3±1.1 5 42.2 3±3.2 1 t 值0.0 71 5.1 13 0.4 53 4.5 99 0.9 65 2.3 0 1.4 32 7.3 84 0.5 78 0.9 35 P 值0.9 44<0.0 01 0.6 53<0.0 01 0.3 42 0.0 28 0.1 62<0.0 01 0.5 67 0.3 57组别 例数(例)术前脾动脉直径(mm)术后脾动脉直径(mm)术前S/P 术后S/P术前脾体积(ml)术后脾体积(ml)术中肝动脉开放后流速(cm/s)术后肝动脉流速(cm/s)术前门静脉流速(cm/s)
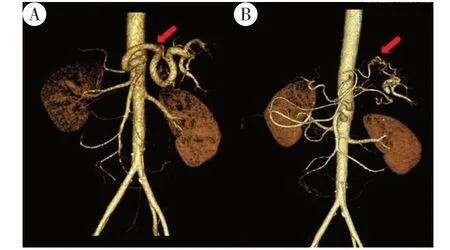
图1 左侧和右侧分别为术前与术后的血管成像

图2 脾动脉结扎组与非结扎组术后ALT 变化
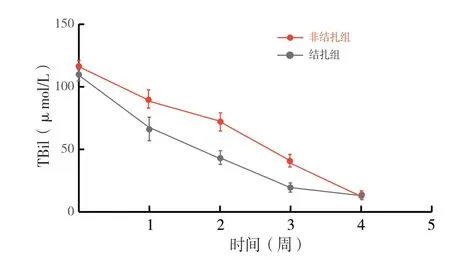
图3 脾动脉结扎组与非结扎组术后TBil 变化
目前关于脾动脉窃血的临床研究主要集中于术后的诊治,但是由于SASS可致肝功能异常、缺血性胆道病变、肝动脉闭塞、移植物功能衰竭等并发症,且肝移植术后的其他一些并发症如移植排斥反应、病毒感染、移植肝药物性肝损害、原发病复发等均可造成一些与SASS相似的临床表现,给SASS的诊断带来困难。此外,肝移植术后SASS首选治疗方法——脾动脉栓塞,术后有一定几率发生缺血性脾坏死、腹腔感染、败血症等[7]。鉴于上述种种原因,目前推荐在肝移植术前对脾动脉窃血高危患者进行预测,以便提前做出术中处理预案,降低术后SASS发生率[8]。如何在术前评估中识别SASS高危患者是移植医生关注的一个重点,其中最为便捷的方法是先行腹部增强CT,然后通过影像后处理技术得出脾动脉、肝固有动脉直径、脾体积,若术前评估提示脾动脉直径>5 mm和/或S/P >1.5 和/或脾体积>829 ml,可认为该受者是术后发生SASS的高危患者[1、9]。目前临床上,关于SASS的预防均是移植术中通过不同手段(如单纯缝线结扎、血管环阻)完全阻断或降低脾脏血流,上述方法的本质都是通过调节门脉系统与肝动脉系统血流之间的关系,从而抑制前述SASS发病机制,发挥预防作用[10]。
SASS的结局与肝脏低灌注的持续时间呈明显的负相关[3],因此早期诊断SASS尤为重要。对于SASS的诊断,我们不能忽视其排他性诊断这一特点,即诊断前需除外肝动脉外科相关并发症。目前关于SASS的诊断,强调移植术后早期密切通过多普勒超声监测移植肝血流,对于无外科相关并发症的移植肝动脉血流异常者,尽早行血管造影确诊[4]。时间分辨增强4 D磁共振血管造影因其具有诊断效能高、无创等优势,近年来已被用于SASS的诊断[11]。

表2 脾动脉结扎组与非结扎组术后并发症情况比较(例)
此次研究中,我们在术前评估中对SASS高危受者进行预测,对于该部分受者我们根据术中超声结果选择性行脾动脉结扎术。术后结果显示,对于高危患者而言,肝移植术中结扎脾动脉可在保证门脉血运安全的情况下,明显改善肝动脉血流。同时,脾动脉结扎有助于移植肝功能的恢复。此外,脾动脉结扎可明显降低SASS和肝移植术后持续性脾功能亢进的发生率,且不增加其他相关并发症的发生率。值得一提的是,除脾动脉窃血以外,胃十二指肠动脉窃血也是引起肝动脉低灌注一个不可忽视的原因,因此,我们在肝移植术中常规结扎胃十二指肠动脉预防动脉窃血发生[12]。另外,对于肝动脉条件一般的受者来说,酌情选用受者脾动脉进行血管重建,不仅可以改善移植肝血运,而且可降低术后SASS的发生率[13-14]。
总之,脾动脉窃血是肝移植术后的一种严重并发症,给移植受者的预后造成了极大不良影响。因此,我们在肝移植术前评估中,应仔细评估每一位受者术后发生SASS的风险,对于高危受者而言,肝移植术中预防性脾动脉结扎可作为一种安全有效经济的方法。

