基于1 046例肺癌靶向基因检测的ARMS-PCR和NGS技术优势分析
朱丽蒙,马楠,任晓妮,张暋
(郑州金域临床检验中心有限公司 实验诊断部,河南 郑州 450000)
突变扩增阻滞系统-链式聚合酶反应(amplification refractory mutation system-PCR,ARMS-PCR)技术和下一代测序(next generation sequencing,NGS)技术是目前临床上常用的两种靶向基因突变检测方法。ARMS-PCR具有高灵敏度和高特异性,突变检出率远超传统的PCR,已成为肿瘤个体化分子检测最普遍、最重要的技术之一[1]。另一方面,NGS以边合成边测序为原理,具有通量高、检测类型多样的优势,越来越多地应用于临床肺癌靶向基因检测[2]。NCCN建议,临床非小细胞肺癌靶向治疗前采用ARMS-PCR或NGS技术进行基因突变检测,包括EGFR、KRAS、BRAF、MET、RET基因突变和ALK、ROS1和NTRK基因重排等。不同场景下,如何选择合适的检测技术是临床常面临的问题[3]。本研究基于1 046例肺癌靶向基因检测样本的结果统计,对比阐述ARMS-PCR和NGS技术的优势,帮助临床医生在肺癌靶向治疗中有效选择相应的检测方法,避免时间和资源的浪费。
1 材料和方法
1.1 材料选取2018年1月至2020年3月从河南省内各地区的医疗机构送至郑州金域临床检验中心有限公司检测肺癌靶向基因的病例。排除资料不清或诊断不明的,筛选出1 046例样本,临床诊断结果均为疑似或确诊肺癌,年龄30~90岁,年龄中位数67岁,男554例,女492例。样本类型包括活检组织的石蜡包埋组织(formalin fixed paraffin-embedded,FFPE)、新鲜血浆。将FFPE样本772例按检测方法分为两组:NGS方法329例,ARMS-PCR方法443例;将游离血浆样本274例按检测方法分为两组:NGS方法83例,ARMS-PCR方法191例。
1.2 实验方法ARMS-PCR技术平台采用ABI 7500 荧光定量扩增仪,组织样本核酸提取试剂盒为QIAamp DNA FFPE Tissue Kit (货号:56404),游离血浆核酸提取试剂盒为QIAamp ccfDNA/RNA Kit(货号:55184),PCR检测试剂盒涵盖G719S、G719C、G719A、S768I、T790M、L858R、L861Q等7个突变位点和29个19号外显子缺失突变。数据质控指标为:组织样本内参Ct值为14~19,游离血浆内参Ct值<28。
NGS技术以边合成边测序为原理,通过对PCR分子簇上碱基连接的荧光信号进行捕获,并转换为碱基信息。靶向区域测序是指针对目的基因的特定区域进行NGS测序,通过探针杂交捕获或PCR扩增,将基因的靶向区域构建成特定大小范围的DNA或cDNA片段文库,再对其进行测序分析[4]。NGS技术平台采用Illumina NextSeq 550仪器,KAPA构库试剂,IDT定制靶向基因探针,Illumina上机试剂(货号:FC-404-2004);定制探针覆盖22个靶向基因的全外显子,可检测的突变类型有点突变和小片段插入/缺失、剪切子变异、拷贝数变异和4个基因的重排,22个基因包括AKT1、ALK、BRAF、CTNNB1、DDR2、EGFR、ERBB4、FBXW7、FGFR1、FGFR2、FGFR3、HER2、KRAS、MAP2K1、MET、NOTCH1、NRAS、PIK3CA、PTEN、SMAD4、STK11、TP53;基因重排包括ALK重排、RET重排、ROS1重排、NTRK1重排。数据经生信分析成突变注释表,质控指标:Q30>0.85,捕获特异性>65%,靶向区域覆盖度>99%,去重后深度大于500X的靶向区域>90%。基因突变报告参考ACMG解读标准[2]以及ACMG的意外发现变异的指南[3],Ⅰ类变异为有致病意义、Ⅱ类变异为潜在致病意义、Ⅲ类变异为致病意义未明,均应报告为检出突变[5-6]。
1.3 统计学分析采用SPSS 21.0统计软件进行分析。计数资料以频数和率(%)表示,采用χ2检验、连续校正χ2检验比较NGS技术和ARMS-PCR技术检测EGFR基因主要突变位点的检出率和总检出率,分析NGS方法和ARMS-PCR方法检测非小细胞肺癌靶向基因的变异类型的特点。P<0.05为差异有统计学意义。
2 结果
2.1 FFPE样本EGFR基因已知位点突变检出率NGS技术与ARMS-PCR技术对FFPE样本EGFR基因已知位点突变总检出率比较,差异无统计学意义(P>0.05)。ARMS-PCR技术对FFPE样本外显子18(G719X)、外显子20(T790M)、外显子19(缺失突变)、外显子21(L861Q)、外显子20(S768I)突变的检出率分别与NGS技术比较,差异无统计学意义(P>0.05)。ARMS-PCR技术对外显子21(L858R)突变的检出率高于NGS技术(P<0.05)。见表1。
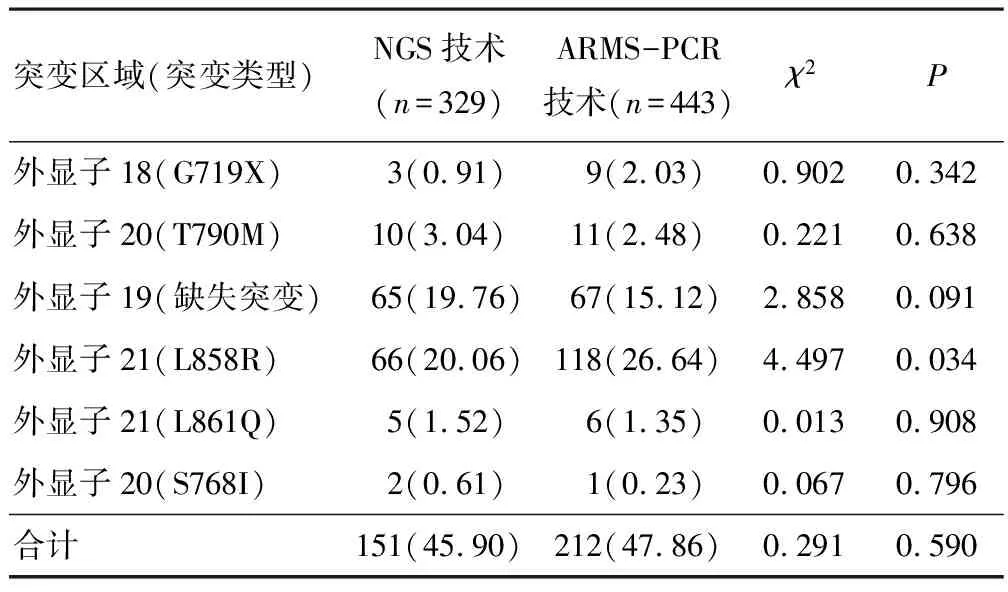
表1 NGS技术和ARMS-PCR技术对FFPE样本EGFR基因已知位点检出率比较[n(%)]
2.2 血浆样本EGFR基因主要位点突变检出率NGS技术与ARMS-PCR技术对血浆样本EGFR基因主要位点突变总检出率比较,差异无统计学意义(P>0.05)。ARMS-PCR技术对血浆样本外显子20(T790M)、外显子19(缺失突变)、外显子21(L858R)突变的检出率分别与NGS技术比较,差异无统计学意义(P>0.05)。见表2。
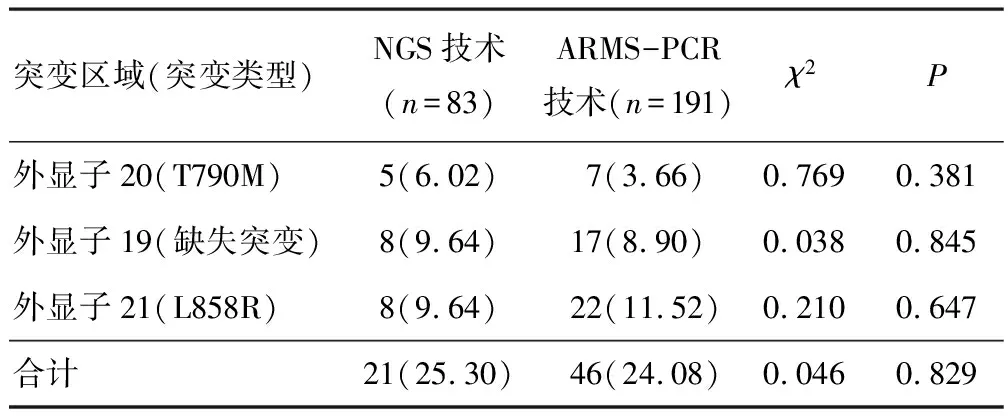
表2 NGS技术和ARMS-PCR技术对血浆样本EGFR基因主要位点检出率比较[n(%)]
2.3 NGS技术检测肺癌EGFR基因未知/罕见突变NGS方法检出EGFR基因扩增16例,检出率4.89%(16/329),另外检出1例与L858R突变同时发生的C797S/T790M顺式变异,提示患者对三代EGFR-TKI耐药。见表3。

表3 NGS技术对FFPE样本EGFR基因未知/罕见突变的检出情况(n)
2.4 NGS技术检测肺腺癌和肺鳞癌多基因突变谱NGS检测肺癌靶向基因套餐的FFPE样本中,214例确诊为肺腺癌,34例确诊为肺鳞癌。与肺腺癌比较,NGS技术对FFPE样本肺鳞癌TP53和PIK3CA基因突变检出率较高,对EGFR基因突变检出率较低(P<0.05)。NGS技术对FFPE样本肺鳞癌PTEN、KRAS、CTNNB1、MET、SMAD4、BRAF基因突变检出率分别与肺腺癌中比较,差异无统计学意义(P>0.05)。ERBB2、ALK融合、RET融合、ROS1融合4个基因肺鳞癌例数为0,暂不做数据统计。见表4。

表4 NGS技术对FFPE样本肺腺癌和肺鳞癌多基因突变检出率比较[n(%)]
3 讨论
ARMS-PCR与NGS技术都是由普通PCR发展和衍生出来用于检测基因信息的技术,ARMS-PCR技术的优势在于高特异性和灵敏度,理想状态下,灵敏度可达0.5%[1]。因此,可以解释ARMS-PCR方法检测FFPE样本的L858R突变有更高的检出率。从原理上来说,NGS技术在生物信息分析的过程中可能有一定的错误率[7],但是,通过提高二代测序的测序深度可降低错误率,提高灵敏度,从而可达到与ARMS-PCR一致的整体检出率。检测血浆、胸腔积液、脑脊液等体液中的游离循环DNA(free circulating DNA,cfDNA),被称作液体活检。释放在体液中的肿瘤细胞被称为循环肿瘤细胞(circulating tumor DNA,ctDNA),血浆内质量浓度只有5~10 μg·L-1,要求检测技术有较高的灵敏度和特异性。NGS技术检测血浆样本核酸时,会在上机前设计较高的数据量(一般为蜡块样本的10倍以上数据量),以便达到足够高的测序深度,从而提高检测的灵敏度。由此可知,在石蜡包埋样本和血浆样本中,ARMS-PCR的检出率与引物设计和扩增条件有关,而NGS技术的检出率会受测序深度影响,在两者条件优化的情况下,可能使总检出率达到一致。本研究结果显示,NGS技术与ARMS-PCR技术对EGFR基因总检出率无明显差异。受检测条件的影响,某些位点的检出率可能有所变化,如本研究中ARMS-PCR技术对EGFR基因L858R突变的检出率高于NGS技术。
本研究结果中,ARMS-PCR检测到EGFR基因点突变和基因小片段缺失;NGS方法检测到更多EGFR基因的突变类型,包括基因小片段插入、拷贝数变异、基因融合等。根据NGS测序结果,可判断出双突变是顺式(位于同一等位基因上),还是反式(位于不同等位基因上)。对于C797S/T790M双突变,顺式和反式有截然相反的临床意义,即顺式对EGFR-TKI靶向治疗耐药,而反式对EGFR-TKI靶向治疗敏感[8]。从原理上来说,ARMS-PCR技术也可以用于定量检测RNA水平的拷贝数变异,预测蛋白表达水平是否增高,或用于检测RNA水平的基因重排。然而,由于肺癌蜡块组织样本提取RNA碎片化较严重,检测有一定难度,目前尚无成熟试剂盒应用于临床。NCCN指南更推荐荧光原位杂交技术(FISH)用于ALK和ROS1基因重排的检测[3]。采用NGS技术检测基因重排,可通过基因比对,推测基因断裂和重排位点,预估重排的突变频率,用于临床时,常与FISH结果相互验证。NGS技术也可以检测到DNA片段的拷贝数,其用生物信息分析的方法,计算出拷贝数增多或减少,预测蛋白是否过表达,临床上常用FISH技术或免疫组化进行验证[9]。在肺癌靶向治疗检测中,NGS比ARMS-PCR技术的通量高,检测范围广,当临床活检样本较少时,可以一次性获得更多基因突变信息,为临床提供更全面的治疗依据。
临床可根据基因突变谱对癌种进行辅助诊断和分型。EGFR基因突变、ALK融合和ROS1融合可指导临床选用相应的靶向药。在本研究中,NGS技术检测肺腺癌和肺鳞癌表现出不同的基因突变谱。肺鳞癌对EGFR-TKI靶向治疗的效果不佳[10],故临床上肺癌靶向基因检测多用于肺腺癌患者的用药指导。本研究结果显示,肺腺癌中EGFR基因突变检出率高于肺鳞癌。NGS肺癌检测套餐还可同时检测KRAS、PTEN、PIK3CA、ERBB2等基因突变,在治疗前、治疗中、治疗后监测是否有原发或继发的耐药突变,指导临床优化用药方案。本研究中,TP53基因是突变检出率最高的基因。TP53是典型的抑癌基因,TP53基因失活突变是肺癌预后不良的标志[11]。NGS因高通量的特点常被作为大规模人群基因组检测项目的技术手段,以帮助研究人员了解种群之间的突变谱差异,检出未知突变,便于发现新发突变与不同疾病和治疗之间的关系,用于疾病的诊断和新靶向药物的开发。但是,ARMS-PCR技术无法检测基因突变谱。
NGS检测时间和经济成本比较高。一般的肺癌靶向基因NGS检测流程包括核酸提取、构建DNA文库、靶向捕获、上机检测、生物信息学分析、突变意义分析和报告等步骤,需耗时3~5 d。再加上价格高昂的仪器和上机试剂,对于基层医院来说,设备及项目的推广存在困难。而ARMS-PCR虽然只常用于检测已知位点,但其实验流程只需要核酸提取、试剂配制、上机检测、结果报告,全程可在几个小时内完成。仪器和试剂价格也易于接受,利于临床项目的开展。
综上,若临床所需检测的突变都在已知范围内,可选择ARMS-PCR技术对其进行位点检测。ARMS-PCR技术特异性高,灵敏度高,适用于已知突变靶向用药效果检测和痕量残留突变的检测,由于其设备及试剂成本低,实验流程时间短,操作方便,易于在基层医院推广;NGS靶向测序技术操作复杂,时间长,成本较高,但是其检测通量高,范围广,适合于用药方案制定初期的靶向基因筛查,制定用药方案;病程变化时,可使用NGS技术筛查是否有新发的耐药基因突变,优化用药方案,以及评估预后等。同时,NGS作为一种临床研究的手段,可以用于绘制种群突变谱,发现新发突变,总结突变与疾病发生、进展、转移之间的关系,为开发新的快速诊断方法、新的靶向药物提供依据。对于ARMS-PCR和NGS两种检测技术,临床可根据检测目的和病程,采用适合的检测项目或套餐。

