一株兼具降解纤维素和抗草莓重茬病害能力细菌的筛选和应用
肖蓉 邓舒


摘 要:从腐熟牛粪中筛选兼具降解纤维素功能和抗草莓重茬病害功能的细菌,为草莓夏季高温闷棚时提供菌种资源。结果:筛选出1株有纤维素降解功能的细菌JN2,水解圈直径达14 mm;JN2对草莓灰霉菌、镰刀菌和拟盘多毛孢菌表现出强烈拮抗作用;离体叶片实验中,JN2对草莓灰霉病的防效达97%,盆栽试验也验证了JN2对草莓灰霉病有较高的防效;经形态特征、生理生化特征和16SrDNA测序,JN2被鉴定为解淀粉芽孢杆菌。
关键词:纤维素降解;重茬病害;草莓;生物防治
文章编号:2096-8108(2020)06-0007-04 中图分类号:S601 文献标识码:A
Isolation and Application of Bacterium with
Resisting Strawberry Replant Diseases and Cellulose Degrading
XIAO Rong, DENG Shu
(Pomology Institute, Shanxi Agricultural University, Taiyuan 030031, China)
Abstract:In order to provide bacterial resources for strawberry greenhouse by high temperature controlling, bacterium from cow dung with the function of both cellulose degrading and resisting replant diseases was isolated. The results showed that a strain named JN2 had cellulose degradation function with a hydrolysis ring diameter up to 14 mm. JN2 showed strong antagonistic effects against strawberry
Botrytis Cinerea, Fusarium sp. and Pestalotiopsis sp.. In vitro leaf experiments, JN2 was effective against strawberry Botrytis Cinerea to 97%. Pot experiments had also been shown to be effective. By morphological, physiological and biochemical characteristics and 16SrDNA sequencing, JN2 was identified as Bacillus Amyloliquefaciens.
Keywords:cellulose degrading; replant diseases; strawberry; biological control
在生产上,为了保证优质高产,设施栽培草莓每年都换新苗,重茬问题在所难免,重茬病害严重
成为草莓设施栽培中的一大难题。近几年,随着高温闷棚技术的普及,多数果农均会在7-9月对草莓大棚进行高温闷棚杀菌,以减轻土壤中病原菌基数[1]。研究指出,闷棚时将秸秆、蘑菇菌渣、牛粪等有机物一起施入土壤,既可以提高地温,又可以增加土壤肥力,杀菌、杀虫与施肥同步进行,一举多得[2-5]。但是由于各地每年的气温条件都不一样,如果在闷棚期间遇到连日阴天,则施加的秸秆、蘑菇菌渣等有机物不能充分腐熟,就会影响新栽的草莓苗生长。因此,为了保证有机物的充分腐熟以及病原菌的消杀,人们在高温闷棚时需分别添加具有纤维素降解功能和病害拮抗功能的生物菌剂[6]。本试验研究旨在筛选一种兼具纤维素降解功能和草莓病害拮抗功能的细菌,以使生产中进行高温闷棚时更便捷高效。
1 材料与方法
1.1 细菌的筛选
初筛:以能够产生纤维素降解酶为初筛指标。以腐熟牛粪为原材料,将10 g牛粪放入90 ml无菌水中,充分震荡混匀,然后梯度稀释到10-8浓度。取10-6、10-7、10-8浓度的稀释液0.2 ml涂布在羧甲基纤维素钠固体培养基上,37 ℃黑暗条件倒置培养。羧甲基纤维素钠培养基配方为:羧甲基纤维素钠15 g/L,酵母粉1 g/L,磷酸二氢钾1 g/L,硝酸铵1 g/L,硫酸镁0.5 g/L。待单菌落长出后,挑取单菌落接种于新的羧甲基纤维素钠固体平板,37 ℃,恒温培养72 h,刚果红染色,筛选出透明圈较大的菌落,编号,转移到新的平板上,多次划线培养纯化后接于羧甲基纤维素钠固体斜面上,4 ℃保存用于后续试验。
复筛:采用平板对峙培养方法,以本实验室保存的常见草莓病原菌灰霉菌、镰刀菌和拟盘多毛孢菌为靶标菌进行复筛。取病原菌菌丝接种于PDA固体培养基平板中央,按等边三角形3个顶点的方向将初筛细菌接种于病害菌周围,于28 ℃条件下黑暗倒置培养。以只接种病害菌,不接种细菌的平板作为对照。10 d以后观察病害菌生长状况。
1.2 细菌鉴定
参考《常见细菌系统鉴定手册》[7]方法进行生理生化鉴定。
分子鉴定:挑取细菌单菌落接于LB液体培养基中,37 ℃摇床培养过夜。取200 μl菌液,12 000 rpm离心5 min,弃上清,于沉淀中加入40 μl灭菌超纯水,充分混匀后,置于100 ℃水浴5 min裂解,裂解液作為模板进行PCR反应。PCR引物为通用引物27F和1492R,由生工生物工程(上海)股份有限公司合成。引物序列为:27F:AGAGTTTGATCCTGGCTCAG和1492R:TACGGCTACCTTGTTACGACTT。PCR体系为:10× PCR Buffer 5 μL, dNTPs 1.5μL,上下游引物各0.5 μL,模板2 μL,rTaq酶1 μL,加水补齐至50 μL。PCR程序为94 ℃ 3 min;94℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 5 min。PCR产物经1.2%琼脂糖凝胶电泳检测后送往北京华大生物工程技术有限公司测序。测序结果经NCBI网页blast比对获知菌株的分子鉴定结果。
1.3 菌株对草莓灰霉病的防治
1.3.1 草莓活体组织测试
采用叶片法测定细菌发酵原液对草莓灰霉病的防效。将生长健康、大小一致的草莓叶片从叶柄处剪断,用自来水将叶片表面冲洗干净,再用70%乙醇进行表面消毒,用灭菌水冲洗干净后,在JN2发酵液中浸渍3 min,晾干,叶面朝上放于铺有无菌滤纸保湿的培养皿内,叶柄用浸湿的灭菌棉球包裹。采取牙签划伤接种的方式将灰霉菌菌丝接种到叶片上。以无菌水代替发酵液做对照。每组叶片共有30片。实验15 d以后进行病害调查。根据每片叶子的变褐情况以目测法对病情进行记载。
草莓叶部病害病级按5级划分:
0级:无病;
1级:发病面积占叶表面积1/4以下;
2级:发病面积占叶表面积1/4-1/2;
3级:发病面积占叶表面积1/2-1/3;
4级:发病面积占叶表面积3/4以上。
病情指数(%)=∑每一级的级值×该级的叶片数总叶片数×最大级值×100
1.3.2 草莓盆栽测试
采用盆栽灌根法进行,取处于苗期的生长健壮、无病草莓苗为试材。将细菌接种于羧甲基纤维素钠培养基中,
37 ℃培养3 d后作为供试发酵原液。将草莓灰霉病菌接种于PDA液体培养基中,28 ℃摇床培养5 d后备用。实验组和对照组各设置3次重复,每盆种植一株健康、且长势一致的草莓苗。实验组中,在草莓苗根部开沟,将培养好的细菌发酵液倒入沟内,待菌液被土壤全部吸收24 h后,倒入灰霉菌菌悬液,再覆盖沟槽。对照组中,以无菌水替代细菌发酵液,其余步骤相同。用保鲜膜覆盖土壤以利于保湿。其余浇水等按常规管理方式管理。
2 结果与分析
2.1 菌株筛选
从腐熟牛粪中分离出18株有纤维素降解功能的细菌,经复筛获得1株透明圈较大的菌株,培养2 d时菌落直径(d)为2 mm,水解圈直径(D)为14 mm,D/d值达7,编号为JN2,如图1所示。
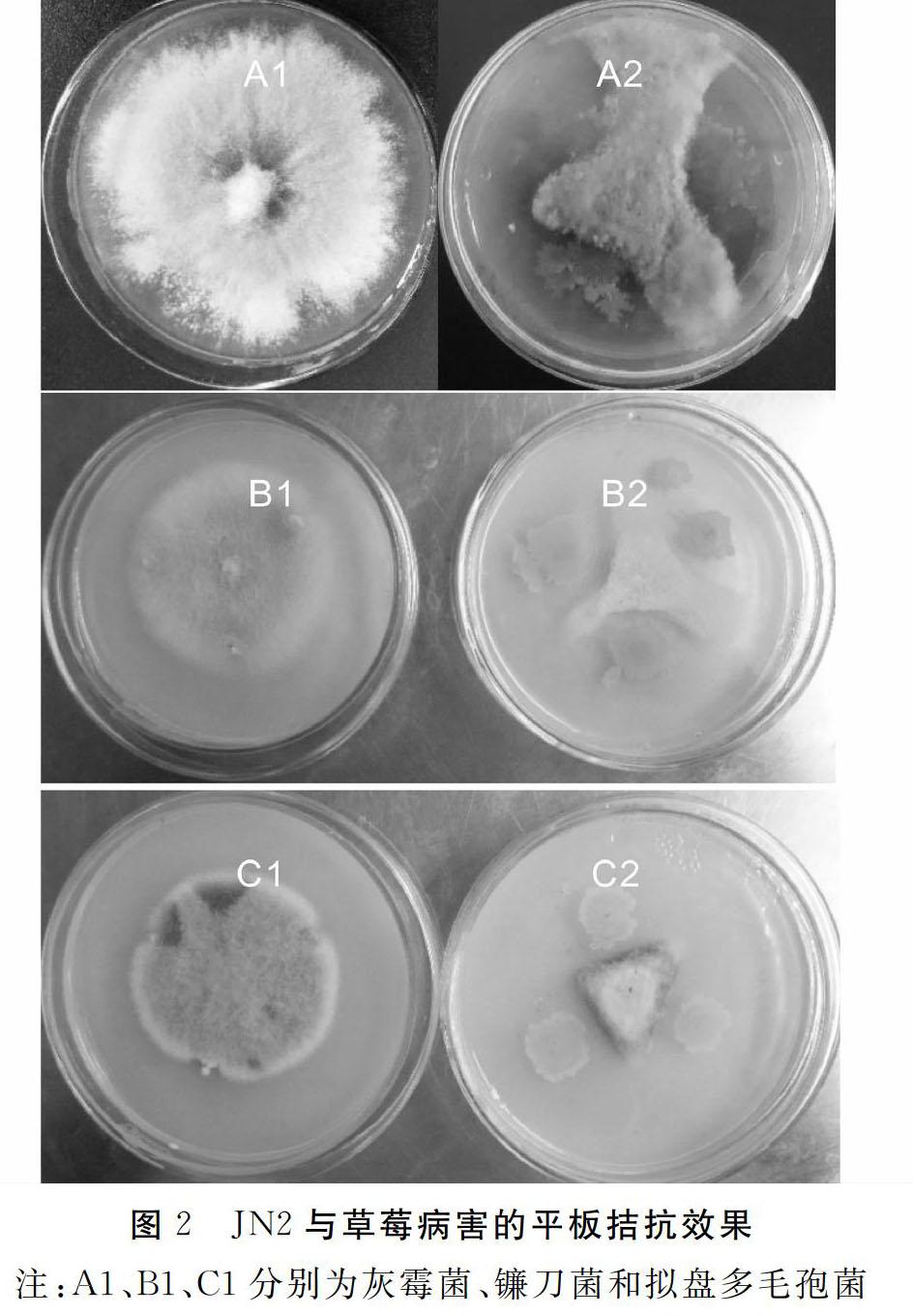
2.2 菌株对病原菌的平板拮抗效果
从图2中可以明显看出,与对照相比,当在培养基上同时接种JN2时,草莓灰霉菌、镰刀菌和拟盘多毛孢菌生长明显受到抑制,说明JN2对这3种常见草莓病原菌有强烈的拮抗作用。
2.3 菌株鉴定
2.3.1 菌株形态及生理特征
JN2在羧甲基纤维素钠固体平板上的培养特征为:菌落边缘不整齐,呈放射状,直径2~3 cm,浅黄色,不透明,表面湿润(图3),采用简单染色和革兰氏染色观察JN2细胞形态,发现该菌革兰氏染色呈阳性,杆状,单个、成对或成串出现,有芽孢,芽孢囊不膨大,芽孢椭圆形,中生(图4)。JN2的部分生理生化特征见表1。
2.3.2 菌株的分子鉴定
菌株JN2的序列长度为1406bp,使用NCBI的BLASTN工具对JN2菌株的16SrDNA 序列进行同源性比对,结果显示,JN2与解淀粉芽孢杆菌(Bacillus amyloliquefaciens)的16SrDNA相似度达100%。
根据对菌株的形态学、培养特征、生理生化和分子鉴定的研究结果,菌株JN2鉴定为解淀粉芽孢杆菌。解淀粉芽孢杆菌JN2在中国微生物菌种保藏管理委员会普通微生物中心保藏,保藏登记号为CGMCC No:10677。
2.4 JN2对草莓灰霉病的防治
选择灰霉菌作为靶标菌进一步验证JN2的实际应用效果。离体草莓叶片接种实验结果见图5,可见:只接种灰霉菌的对照组,几乎全部染病,叶片出现茶褐色病斑,病斑逐渐扩大,15 d后,有的整片叶子均变为茶褐色,且表面覆盖一层灰褐色菌丝,病情指数达87.5%。实验组叶片先经JN2处理后再接种HM,15 d后,仅有少量叶片出现茶褐色病斑,病情指數仅为2.5%。说明JN2对草莓灰霉病具有较高的防效。
为了检验JN2在实际土壤环境下对HM病的防效,我们设置了盆栽试验。将处理后的草莓苗在25 ℃条件下培养。30 d以后,发现不加JN2发酵液的对照组叶片有褐色斑点,叶缘发黄褐化,甚至整片叶子干枯。而用JN2发酵液处理过的试验组叶片不见斑点和黄化,表现正常(图6)。说明在盆栽条件下,JN2发酵液也表现出对灰霉病的防治作用。
3 讨论与结论
镰刀菌属真菌(Fusarium sp.)在世界范围内分布广泛,它可危害多种植物,破坏植物的维管束系统,引起植物萎蔫死亡和器官腐烂,是生产上防治最艰难的土传病害之一。在草莓上可引起枯萎病[8],使草莓根部维管束变褐,叶片卷缩、萎蔫直至全株死亡。拟盘多毛孢属(Pestalotiopsis sp.)是著名的植物病原体品种,在草莓上能引起叶斑病[9],主要危害叶片,起初产生红褐色病斑,后中央变为浅褐色,产生轮纹,边缘出现明显的暗褐色坏死带,严重时叶片枯死。灰霉病在草莓生长期、花期、果期均有可能发生,病原菌为灰葡萄孢霉(Botrytis Cinerea),其菌丝、菌核及分生孢子可以在土壤或病残体上越冬或越夏,是草莓最严重的土传病害之一[10]。本研究中分离出的JN2菌株对上述3种病原菌均表现出强烈拮抗作用,因此,可以在下一步考虑将JN2作为草莓专用生防菌剂。因其还兼具纤维素降解功能,故在高温闷棚时,只施加JN2一种菌剂,就可以同时满足腐熟有机物及消杀病原菌功能。但还需在下一步试验中优化JN2的产酶条件,以提高纤维素降解功能。
总之,本试验从腐熟牛粪中分离出1株有纤维素降解功能的细菌JN2,水解圈直径达14 mm;在平板上JN2对草莓灰霉菌、镰刀菌和拟盘多毛孢菌表现出强烈拮抗作用;离体叶片实验中,草莓灰霉病病情指数达87.5%,
试验组叶片病情指数仅为2.5%,JN2对草莓灰霉病的防效达97%,盆栽试验也验证了JN2对草莓灰霉病有较高的防效;经形态特征、生理生化特征和16SrDNA测序,JN2被鉴定为解淀粉芽孢杆菌。
参考文献[1]邓亚利.设施草莓病虫害绿色防控技术[J].西北园艺(综合),2020(3):43.
[2]董海龙,路 平,张作刚,等.秸秆+石灰氮+X-20菌肥+高温闷棚处理对根结线虫种群数量变化的影响[J].中国农业大学学报,2016,21(4):52-58.
[3]杨海燕,王周平,妙晓莉.高温闷棚改良技术在蔬菜日光温室中的应用[J].中国瓜菜,2019,32(12):100-101.
[4]陈 瑶.设施蔬菜高温闷棚与秸秆还田技术[J].四川农业科技,2019(6):18-19.
[5]何志刚,娄春荣,董 环,等.秸秆还田与高温闷棚对设施连作土壤微生境及番茄生长发育的影响[J].河南农业科学,2018,47(10):87-91.
[6]周桂丽.棚室草莓解决重茬障碍的有效途径[J].中国果菜,2013(6):48-49.
[7]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[8]雷恒树,华战迎,范灵姣,等.北京地区草莓枯萎病病原的鉴定与防治[J].中国农业大学学报,2019,24(6):66-72.
[9]赵景楠,马 喆,刘正坪,等.草莓拟盘多毛孢叶斑病的病原菌[J].菌物学报,2016,35(1):114-120.
[10]杨恩到,汪德志,陈丛良,等.大棚草霉灰霉病发生规律及绿色防控技术[J].湖北植保,2020(3):59-60+64.

