TLR4促进苯肾上腺素诱导的心肌细胞肥大
韦 玲 闻 明
(天津市泰达医院,天津 300457)
心肌肥厚是心脏在生理性或者病理性刺激下发生的适应性改变,可分为生理性心肌肥厚和病理性心肌肥厚[1]。生理性心肌肥厚是在妊娠、运动等生理性刺激下心肌细胞发生的代偿性改变,心肌细胞沿着横轴方向增大,可引起心脏收缩功能增强,但不会进展为心力衰竭[2,3];病理性心肌肥厚则是由心肌损伤、代谢紊乱、血管病变等病理性刺激诱发的心脏负荷超载的代偿性改变,表现为心肌细胞沿着纵轴方向增大、心肌细胞收缩功能下降、蛋白质合成增多、胚胎基因的重新激活以及心肌细胞的凋亡和心肌纤维化等不可逆改变,是心脏疾病向心力衰竭进展的必然过程[4-6]。目前,心肌肥厚的发病机理尚未完全阐明,临床上尚缺乏有效的治疗手段,因此,探索病理性心肌肥厚发生的分子机制,寻找新的药物作用靶点,改善病理性心肌肥厚的治疗方案,对于人群健康具有重要意义。
本研究通过分析GEO数据库中人及小鼠心肌肥厚组织的测序数据,借助R软件筛选出目的基因Toll样受体4(Toll-like receptor 4,TLR4),并通过后续细胞实验探究其对PE诱导的原代心肌细胞肥大的影响及可能的作用机制,以期为探索新的抗心肌肥厚药物治疗靶点和策略提供依据。
1 材料与方法
1.1材料 胰蛋白酶和胶原酶Ⅱ购自美国Sigma公司;Lipofectamine RNAiMAX转染试剂购自美国Invitrogen公司;PE购自英国Abcam公司;TLR4特异性siRNA序列(siTLR4)及对照组序列(siNeg)购自上海生工生物有限公司;TLR4过表达腺病毒(AdTLR4)及相应对照组病毒(AdEGFP)购自上海汉恒生物科技有限公司;抗TLR4、IL-6、p-Stat3、t-Stat3和GAPDH一抗均购自美国CST公司。
1.2方法
1.2.1原代心肌细胞培养 选取出生后2~3 d的新生大鼠,断颈处死后取出心脏组织,置于培养皿中,加入PBS缓冲液,洗涤后剪去心房组织。用剪刀将心脏组织剪碎,加入5 ml含0.1%的胰蛋白酶和0.04%的胶原酶Ⅱ的消化液,置于恒温摇床中,37℃消化20 min后,收集消化液,在剩余组织中添加消化液,继续消化,重复4~5次,心脏组织消化完全后将收集的消化液混合,1 500 r/min 离心10 min,弃上清,用含有10%胎牛血清的DMEM完全培养基重悬细胞,2 000目过滤后采用差时贴壁法去除成纤维细胞,用DMEM完全培养基重悬,调整细胞密度为1 × 105个/ml,接种在6孔板中,2 ml/孔,置于37℃、5%CO2的细胞培养箱中培养。
1.2.2细胞转染与分组 原代心肌细胞用冷PBS洗涤后用含1%ITS的DMEM培养基培养。将3 μl siRNA或5 μl Lipofectamine RNAiMAX转染试剂分别与100 μl Opti-MEM培养基混合,室温静置5 min后,将siRNA与转染试剂混合后静置15 min,加入6孔板中。转染后8 h换液,48 h收集细胞检测敲低效率。腺病毒感染参照公司提供的相关步骤,即原代心肌细胞换液后,分别在每孔中加入对照组病毒和TLR4过表达病毒,感染24 h后换液,48 h收集细胞检测过表达效率。细胞共分为4组:siNeg组、siTLR4组、AdEGFP组、AdTLR4组。
1.2.3WGA染色 原代心肌细胞用冷PBS浸洗3次,每次5 min,室温下用4%多聚甲醛固定15 min,PBS浸洗3次后,加入WGA(Wheat germ agglutinin)工作液,室温下避光孵育30 min,PBS浸洗后,用0.2% Triton X-100通透10 min,使用DAPI进行细胞核染色,随后使用正置显微镜进行拍照,心肌细胞面积使用Image J软件进行分析。
1.2.4qRT-PCR 原代心肌细胞用冷PBS洗涤后,加入1 ml Trizol,冰上裂解20 min后,用细胞刮板收集细胞,Trizol法提取总RNA,取0.5 μg总RNA进行逆转录,最后进行实时荧光定量PCR检测目的基因的mRNA水平,TLR4引物序列为:F:5′-TGGCATTGTTCCTTTCCTGC-3′,R:5′-GTTTAAGCCATGCCA-TGCCT-3′。β-actin引物序列为:F:5′-GGCATCCTGACCCTGAAGTA-3′,R:5′-AGGCATACAGGGACA-ACACA-3′。qRT-PCR反应条件为:94℃ 2 min;94℃ 30 s,60℃ 20 s,70℃ 20 s,共计35个循环,基因表达水平采用2-ΔΔCt法计算。
1.2.5Western blot 原代心肌细胞用冷PBS洗涤2次后,RIPA上裂解30 min,用细胞刮板收集细胞,提取总蛋白。取20 μg总蛋白行10%或12%聚丙烯酰胺凝胶电泳分离,常规转膜封闭后将PVDF膜置入相应的一抗中4℃孵育过夜,TBST洗涤2次后,室温孵育辣根过氧化物酶标记的二抗(1∶10 000),使用ECL试剂盒进行曝光分析。目的蛋白表达水平 =目的蛋白灰度值/GAPDH灰度值。
1.2.6差异基因筛选 原始数据集GSE42955和GSE56348下载自GEO数据库,使用R软件及Limma功能包筛选差异表达基因,设置筛选条件为:|log2(Fold Change)|>0.5且P<0.05。使用及ggplot2等功能包进行数据可视化。

2 结果
2.1心肌肥厚生物信息学分析 选取GEO数据库中数据集GSE42955,共含有17个人心脏组织样本,其中正常心脏组织(Ctr)5个,扩张性心肌病心脏组织(DCM)12个。对该数据集分析发现,与正常心脏组织相比,DCM组织中有372个基因表达水平发生改变,其中160个基因上调,212个基因下调(图 1A);选取数据集GSE56348,共含有10个小鼠心脏组织,其中假手术组心脏组织(Sham)5个,主动脉缩窄手术组心脏组织(TAC)5个,对该数据集分析发现,与Sham组相比,TAC组中有575个基因表达水平发生改变,其中421个基因上调,154个基因下调(图 1B)。

图1 心肌肥厚组织生物信息学分析Fig.1 Bioinformatics analysis of cardiomyocyte hyper-trophy tissues
2.2TLR4在心肌肥厚组织中高表达 对数据集GSE42955和GSE56348联合分析发现, 共有32个基因表达水平在人和小鼠心肌肥厚组织中发生改变(图 2A)。与正常心脏组织(Ctr)相比,扩张性心肌病心脏组织(DCM)中TLR4表达水平显著增加(P=0.014)(图 2B);与假手术组小鼠心脏组织(Sham)相比,主动脉缩窄手术组小鼠心脏组织(TAC)中TLR4表达水平显著增加(P=0.007 9)(图 2C)。

图2 TLR4在心肌细胞肥厚组织中高表达Fig.2 TLR4 is over-expressed in cardiomyocyte hyper-trophy tissues
2.3PE处理原代心肌细胞诱导TLR4表达增加 用PE处理原代心肌细胞48 h后,心肌肥厚标志物Anp、Bnp、Myh7的mRNA水平显著上升,Myh6的mRNA水平显著降低(图 3A)。心肌细胞面积分析发现,PE处理组心肌细胞面积显著高于对照组心肌细胞(图3B)。qRT-PCR和Western blot结果表明,PE处理48 h后,心肌细胞中TLR4基因mRNA和蛋白水平均显著增加(图3A、C、D)。

图3 苯肾上腺素处理原代心肌细胞诱导TLR4表达上升Fig.3 Phenylephrine treatment induces increased expres-sion of TLR4 in primary cardiomyocytesNote:Compared with Control,*.P<0.05,**.P<0.01.
2.4敲低TLR4抑制PE诱导的心肌细胞肥大 通过siRNA转染原代心肌细胞,敲低TLR4表达水平,qRT-PCR和Western blot结果表明,与siNeg组相比,siTLR4组心肌细胞中TLR4的mRNA和蛋白水平显著降低(图 4A~C)。在PE处理下,敲低TLR4能逆转PE导致的Anp和Bnp的mRNA水平升高(图 4D、E)。心肌细胞面积分析发现,敲低TLR4能抑制PE诱导的心肌细胞面积增加(图 4F)。

图4 敲低TLR4抑制PE诱导的心肌细胞肥大Fig.4 Knock-down TLR4 inhibits PE-induced cardiomyo-cyte hypertrophyNote:Compared with siNeg,*.P<0.05,**.P<0.01;compared with control,##.P<0.01.
2.5过表达TLR4促进PE诱导的心肌细胞肥大 通过腺病毒感染的方式过表达心肌细胞中TLR4表达水平,qRT-PCR和Western blot结果表明, 与AdEGFP组相比,AdTLR4组心肌细胞中TLR4的mRNA和蛋白水平显著增加(图 5A~C)。在PE处理下,过表达TLR4能促进PE导致的Anp和Bnp的mRNA水平升高(图 5D、E)。心肌细胞面积分析发现,过表达TLR4能促进PE诱导的心肌细胞面积增加(图 5F)。

图5 过表达TLR4促进PE诱导的心肌细胞肥大Fig.5 Over-expression TLR4 promotes PE-induced cardiomyocyte hypertrophyNote:Compared with AdEGFP,*.P<0.05,**.P<0.01;compared with Control,#.P<0.05,##.P<0.01.
2.6TLR4对IL-6/Stat3信号通路的影响 Western blot结果表明,PE处理导致心肌细胞中IL-6和p-Stat3水平显著上升,t-Stat3水平变化无统计学意义(图6A、C)。在PE处理下,敲低TLR4能引起心肌细胞中IL-6和p-Stat3表达水平降低(图 6A、B),过表达TLR4能导致心肌细胞中IL-6和p-Stat3表达水平显著上升(图 6C、D)。
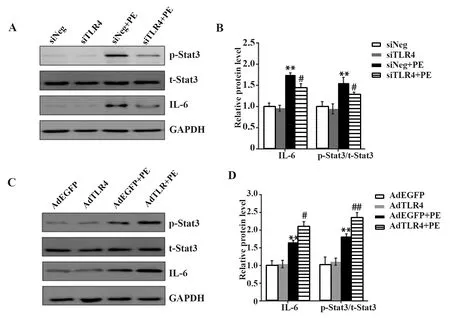
图6 TLR4对IL-6/Stat3信号通路的影响Fig.6 Effect of TLR4 on IL-6/Stat3 signal pathwayNote:Compared with siNeg or AdEGFP,*.P<0.05,**.P<0.01;compared with siNeg+PE or AdEGFP+PE,#.P<0.05,##.P<0.01.
3 讨论
TLR4属于TLRs蛋白家族,目前已发现,该家族共含有13种TLRs蛋白,均属于Ⅰ型跨膜糖蛋白受体,由富含亮氨酸重复序列的胞外段、跨膜区和胞内结构域组成,其中TLR4是哺乳动物中最早发现的TLRs[7,8]。研究表明,TLR4在包括单核/巨噬细胞、内皮细胞、肾小管上皮细胞等多种哺乳动物细胞中广泛表达,通过识别包括热休克蛋白、胎球蛋白A、纤连蛋白等在内的内源性配体和细菌脂多糖、核酸等外源性配体,激活下游信号通路而发挥重要功能,参与调控天然免疫和获得性免疫过程,与肿瘤、心血管疾病、免疫性疾病等多种疾病密切相关[9-11]。既往大量研究表明,TLR4与冠心病、高血压、心力衰竭、心肌梗死等心血管疾病密切相关,而TLR4与病理性心肌肥厚发生发展也有相关文献报道[12-14]。Li等[15]研究表明,长链非编码RNA MIAT(myocardial infarction-associated transcript)可通过海绵吸附miRNA-93进而上调TLR4的表达水平,从而促进病理性心肌肥厚的发生。Li等[16]发现,在压力负荷下,NLRP3基因敲除能促进小鼠发生病理性心肌肥厚,进一步机制研究发现,NLRP3敲除可引起TLR4高表达,TLR4抑制剂能缓解NLRP3基因敲除小鼠在压力负荷下出现的心肌肥厚和心功能下降,这些研究均提示TLR4在病理性心肌肥厚中的重要作用,而具体机制有待进一步阐明。
本研究通过分析GEO数据库中数据集GSE42955和GSE56348,发现与相应正常心脏组织相比,在人和小鼠肥厚心脏组织中有32个基因表达水平均发生改变,其中,TLR4基因在人和小鼠肥厚心脏组织中呈现高表达。随后,本研究使用PE处理新生大鼠原代心肌细胞48 h,然后检测Anp、Bnp、Myh6、Myh7等心肌肥厚的重要标志物,并通过WGA染色及心肌细胞面积分析发现,PE能明显诱导心肌细胞肥大,表明PE诱导的新生大鼠原代心肌细胞肥大模型成功建立。随后,本研究检测了PE处理48 h后,原代心肌细胞中TLR4基因蛋白和mRNA水平,发现在PE刺激后,TLR4基因蛋白和mRNA水平均显著增加。这些结果提示TLR4在心肌肥厚发生过程中具有重要作用,因此本研究选择TLR4作为目的基因。为进一步探究TLR4在心肌肥厚中的作用,本研究设计TLR4特异性siRNA和TLR4过表达腺病毒进行细胞水平和分子水平的验证。结果表明,在PE处理下,敲低TLR4能逆转PE导致的Anp和Bnp的mRNA水平升高。心肌细胞面积分析发现,敲低TLR4能抑制PE诱导的心肌细胞面积增加,说明敲低TLR4能抑制PE诱导的心肌细胞肥大。相反,上调TLR4能显著促进PE诱导的心肌细胞肥大,这些结果表明,TLR4在心肌肥厚中具有重要作用。
IL-6是一种在细胞内广泛存在的多效能细胞因子,通过与其受体结合,诱导激活下游JAKs家族成员,包括丝裂原激活蛋白激酶(mitogen-activation protein kinase,MAPK),磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PⅠ3K)和信号转导及转录激活因子3(signal transduction and activator of transcri-ption 3,Stat3),从而广泛参与调控炎症反应,与细胞增殖、分化、凋亡密切相关,参与恶性肿瘤、糖尿病、心血管疾病等的发生、发展[17,18]。既往研究表明,IL-6/Stat3信号通路与病理性心肌肥厚的发生、发展密切相关[19-21]。Chen等[19]发现,在血管紧张素Ⅱ诱导的病理性心肌肥厚过程中伴随着IL-6/Stat3信号通路依赖的炎症反应的激活;Chen等[20]研究表明,在血管紧张素Ⅱ处理下,IL-6基因敲除能缓解小鼠病理性心肌肥厚的发生,改善心功能;Zhao等[21]研究发现,敲除IL-6能减轻压力超负荷引起的左心室肥大和功能障碍,与Stat3磷酸化水平降低有关,这些研究均表明,IL-6/Stat3信号通路在心肌肥厚发生中具有重要作用。因此,为进一步探究TLR4作用机制,本研究检测了TLR4敲低或者过表达对IL-6/Stat3信号通路的影响。结果表明,PE处理导致心肌细胞中IL-6和p-Stat3水平显著增加,t-Stat3水平无显著改变,说明在肥厚刺激下,IL-6/Stat3信号通路处于激活状态,这与既往研究相符。在基础水平下,敲低或过表达TLR4对IL-6和p-Stat3水平无明显影响,而在肥厚刺激下,敲低TLR4能引起心肌细胞中IL-6和p-Stat3表达水平降低,过表达TLR4能导致心肌细胞中IL-6和p-Stat3表达水平显著增加,以上结果表明,TLR4可能是通过调控IL-6/Stat3信号通路从而影响病理性心肌肥厚的发生。不过,本研究尚未深入探究TLR4激活IL-6/Stat3信号通路的具体机制,也未能进行逆转实验验证抑制IL-6/Stat3信号通路活性能否减弱TLR4过表达对PE诱导的心肌细胞肥大的促进作用,有待进一步探索。
总之,本研究基于GEO数据库,利用生物信息学手段,筛选出与病理性心肌肥厚发生有关的基因TLR4,敲低TLR4可能是通过抑制IL-6/Stat3信号通路缓解PE诱导的心肌细胞肥大的发生,TLR4可能是潜在的治疗心肌肥厚药物的作用靶点。