FTY720调控DC表面趋化因子及其受体表达的机制研究
熊 苗,包春玲,周芳芳
(上海健康医学院附属第六人民医院东院 妇产科,上海200123)
胚胎作为母体半同种异体组织抗原未被母体排斥而能成功存活,与母体妊娠免疫耐受有关。近年来研究显示,妊娠免疫耐受紊乱在原因不明复发性流产(unexplained recurrent spontaneous abortion,URSA)中发挥至关重要作用[1]。FTY720是一种从冬虫夏草中提取的多球壳菌素经化学修饰后的合成物,具有独特药理活性,能作用于淋巴细胞发挥免疫抑制作用,并与其他免疫抑制药物具有协同作用,在自身免疫性疾病动物模型及器官移植中具有良好应用前景[2,3]。FTY720作为1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P)受体激动剂,通过拮抗S1P与受体结合,影响T细胞分化及功能,参与介导免疫耐受。鉴于FTY720的免疫抑制作用,本课题组前期采用FTY720干预自然流产孕鼠后能显著降低孕鼠胚胎丢失率,但其具体机制尚不明确[4]。树突状细胞(dendritic cell,DC)是功能最强的抗原提呈细胞,在诱导机体免疫耐受及维持免疫应答等过程中发挥关键作用。研究显示,FTY720对DC细胞的毒性和吞噬性无明显影响,但对其表面趋化因子及其受体分泌具有下调作用[5]。本研究以自然流产孕鼠为研究对象,通过构建S1P-siRNA及过表达S1P慢病毒载体转染DC细胞,探讨过继转移两种慢病毒载体前后FTY720对DC的影响,旨在为临床治疗URSA提供新的治疗靶点和实验依据。
1 材料与方法
1.1 实验动物
雌性CBA/J小鼠、雄性DBA/2小鼠和雄性Balb/c小鼠,均为SPF级,6-8周龄,原种购自日本国立遗传研究所,后由中国科学院上海实验动物中心遗传室保种留存,经检验遗传质量检测符合本品系国际标准。于本实验室无菌条件下适应性饲养2周。本研究经上海市第六人民医院伦理委员会审核批准,给予动物人道主义关怀,实验过程符合3R原则。
1.2 主要试剂和仪器
FTY 720(上海嘉远生物科技有限公司);S1P过表达和S1P-siRNA慢病毒载体(上海卫蓝海洋材料科技有限公司);趋化因子受体CCR7、CCL19多抗,FITC标记的兔抗小鼠CD80、CD40、CD86、MHCII单抗以及IgG同型对照(美国Biolegend公司);rmGM-CSF、mIL-4(美国Gibco公司);流式细胞仪及分CD1a磁珠抗体(美国BD公司)。
1.3 方法
1.3.1转染DC
DBA/2雄鼠骨髓来源DC分离、培养及鉴定,具体方法同前期研究工作[6-8];转染S1P过表达慢病毒载体、S1P-siRNA慢病毒载体的DC结果及鉴定见前期研究[4]。
1.3.2动物建模及分组
雌性CBA/J小鼠和雄性Balb/c小鼠按2∶1比例合笼,建立正常妊娠孕鼠模型(CBA/J×Balb/c);雌性CBA/J小鼠和雄性DBA/2小鼠按2∶1比例合笼,建立自然流产孕鼠模型(CBA/J×DBA/2),合笼后每日8:00和14:00检查阴道栓,以出现阴道栓为孕1 d。
孕鼠分组:①正常妊娠模型组(CBA/J×Balb/c),Balb/c雌鼠于合笼前2 d腹腔注射1 mL FTY720,1次/d,连续2 d;②自然流产模型组(CBA/J×DBA/2),不干预;③FTY720组(CBA/J×DBA/2),CBA/J雌鼠于合笼前2 d腹腔注射1 mL FTY720,1次/d,连续2 d;④FTY720+S1P-siRNA-DC组(CBA/J×DBA/2),CBA/J雌鼠于合笼前2 d腹腔注射1 ml FTY720,同时尾静脉注射1 ml S1P-siRNA-DC(含2.5×106个细胞),1次/d,连续2 d;⑤FTY720+过表达S1P-DC组(CBA/J×DBA/2),CBA/J雌鼠于合笼前2 d腹腔注射1 ml FTY720,同时尾静脉注射1 ml过表达S1P-DC(含2.5×106个细胞),1次/d,连续2 d;⑥FTY720+空载组(CBA/J×DBA/2),CBA/J雌鼠于合笼前2 d腹腔注射1 ml FTY720,同时尾静脉注射1 ml空载慢病毒载体-DC(含2.5×106个细胞),1次/d,连续2 d。
1.3.3计算孕鼠胚胎丢失率[9]
于孕12-14 d,对孕鼠胚胎丢失率进行统计。丢失胚胎可见体积缩小、胎盘出血甚至坏死。胚胎体积缩小以胚胎体积<同龄胎盘平均体积减去2个标准差为统计标准,胚胎丢失率=丢失胚胎数/丢失胚胎数与存活胚胎数之和×100%。
1.3.4检测DC数量及其表面CCR7/CCL19表达
于孕12-14 d采集孕鼠血样(眼内眦静脉采血),颈椎脱臼法处死孕鼠,留取蜕膜,流式细胞仪检测外周血和蜕膜组织中DC数量及其表面CCR7表达情况,具体方法参照前期研究[10,11];取胎盘蜕膜组织,制备石蜡切片,按照CCL19抗体免疫组化试剂盒说明书进行染色,检测趋化因子CCL19表达情况,染色强度分为4个等级:±,+,++,+++,等级越高代表阳性表达越多。
1.3.5流式细胞术检测DC凋亡及分化情况
获取各组孕鼠骨髓来源DC[10,11],重悬调整至1×106个/mL,分别加入100 μg/L、50 μg/L的重组GM-CSF和IL-4,于培养3 d、5 d时半量换液,加入细胞因子,于第5天收集部分细胞,离心后,使用流式细胞仪检测细胞CD80、CD86、MHC-Ⅱ、CD40表达,剩余细胞加入100 μg/L的LPS,48 h后检测细胞CD80、CD86、MHC-Ⅱ、CD40表达。
1.3.6Transwell小室实验检测DC趋化能力
趋化实验:将分离的DC液进行重悬,用不含BSA的DMEM培养基对细胞进行饥饿处理过夜,重悬细胞调整浓度为1×105~1×106个/mL。将600 μl梯度浓度CCL19溶液加入24孔板,24孔板中放入Transwell小室,小室上室加入200 μl DC悬液(过继转移S1P-siRNA-DC和过表达S1P-DC前后与不同浓度的FTY720共培养),5% CO2培养箱37℃培养20 h,取出小室,多聚甲醛固定(4%)20 min,结晶紫(0.1%)染色30 min,显微镜下观察并对细胞计数,随机选取5个视野,以平均值表示。
中和实验:在上述含CCL19的溶液中,加入1 μg/mL CCL19抗体,于37 ℃条件下孵育1 h,其余步骤同趋化实验。
1.4 统计学方法
2 结果
2.1 过继转移过表达S1P-DC和S1P-siRNA-DC前后FTY720对孕鼠胚胎丢失率的影响
FTY720干预后自然流产模型孕鼠胚胎丢失率明显降低(P<0.05);过继转移S1P-siRNA-DC后,FTY720对自然流产模型孕鼠胚胎丢失率无明显影响(P>0.05);过继转移S1P-DC后,FTY720能明显降低自然流产模型孕鼠胚胎丢失率(P<0.05),见表1。
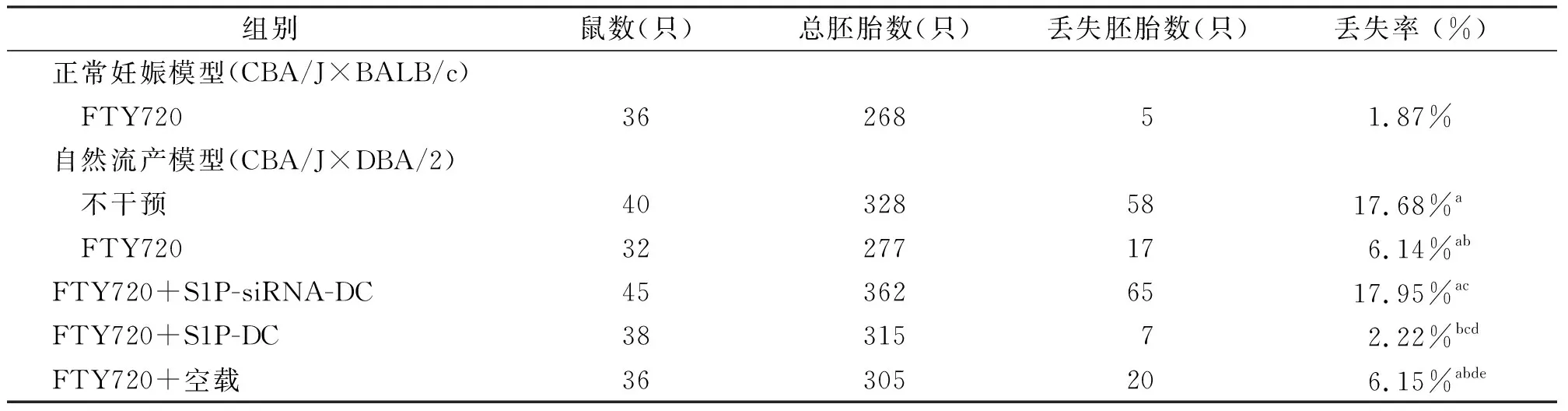
表1 各组孕鼠胚胎丢失率
2.2 过继转移过表达S1P-DC和S1P-siRNA-DC前后FTY720对孕鼠外周血DC数量及CCR7表达的影响
FTY720干预后自然流产孕鼠外周血DC数量及CCR7表达率较干预前明显降低(P<0.05);过继转移S1P-siRNA-DC后,孕鼠外周血DC数量及CCR7表达率无明显变化(P>0.05),过继转移过表达S1P-DC后,孕鼠外周血DC数量及CCR7表达率进一步降低(P<0.05),见表2。

表2 孕鼠外周血DC数量及表面CCR7的表达
2.3 过继转移过表达S1P-DC和S1P-siRNA-DC前后FTY720对孕鼠蜕膜组织中DC数量及其CCR7表达的影响
FTY720干预后自然流产孕鼠蜕膜组织中DC数量及CCR7表达率较干预前明显降低(P<0.05);过继转移S1P-siRNA-DC后,孕鼠蜕膜组织中DC数量及CCR7表达率无明显变化(P>0.05),而过继转移S1P-DC后,孕鼠蜕膜组织中DC数量及CCR7表达率进一步降低(P<0.05),见表3。

表3 孕鼠蜕膜组织DC数量及CCR7的表达
2.4 过继转移过表达S1P-DC和S1P-siRNA-DC前后FTY720对孕鼠蜕膜组织中CCL19表达的影响
FTY720干预后自然流产孕鼠蜕膜组织中CCL19表达较干预前明显降低(P<0.05);在FTY720干预基础上过继转移S1P-siRNA-DC后,孕鼠蜕膜组织中CCL19表达无明显变化(P>0.05),而过继转移过表达S1P-DC后,孕鼠蜕膜组织中CCL19表达进一步降低(P<0.05),见表4。

表4 孕鼠蜕膜组织中CCL19的表达
2.5 过继转移过表达S1P-DC和S1P-siRNA-DC前后FTY720对DC分化及凋亡的影响
未干预前DC凋亡率为(8.21±0.25)%,过继转移过表达S1P-DC和S1P-siRNA-DC后,DC凋亡率为(8.33±0.33)%、(8.29±0.31)%,提示过继转移两种慢病毒前后DC凋亡率无明显差异(P>0.05)。各组孕鼠DC表面CD80、CD86、MHCII、CD40表达百分率无明显差异(P>0.05)。
2.6 趋化实验和中和实验结果
Transwell小室DC数量随着FTY720浓度增加而减少(P<0.05)。过继转移S1P-siRNA-DC后,DC细胞数量明显增加(P<0.05);过继转移过表达S1P-DC后,DC数量明显减少(P<0.05)。而加入CCL19抗体后,过继转移S1P-siRNA-DC或过表达S1P-DC前后DC数量无明显变化(P>0.05)。
3 讨论
母胎免疫耐受失衡是URSA的主要发病机理,探讨诱导免疫耐受的方法可为URSA患者提供新的治疗途径。DC是母胎界面重要免疫活性细胞,其质和量的异常在URSA中发挥重要作用,URSA患者局部组织中免疫活性细胞自外周被募集而来,而非由前体细胞在蜕膜中我更新形成,其中趋化因子及其受体在招募过程中发挥重要作用[12]。
S1P与受体结合,可介导淋巴细胞再分布,FTY720作为S1P受体激动剂,可拮抗S1P与受体结合,与淋巴细胞迁移、凋亡以及归巢密切相关[13]。本研究以FTY720干预孕鼠,同时构建S1P过表达和S1P-siRNA慢病毒载体转染DC,观察过继转移前后,FTY720对自然流产模型孕鼠胚胎丢失率的影响,结果显示,FTY720能明显降低自然流产模型孕鼠胚胎丢失率,过继转移S1P-siRNA-DC后,FTY720对自然流产模型孕鼠胚胎丢失率无明显影响,过继转移S1P-DC后,FTY720能明显降低自然流产模型孕鼠胚胎丢失率,与前期研究结果一致[14],提示FTY720可能通过阻断S1P信号通路诱导免疫耐受。
为进一步研究FTY720如何通过S1P信号通路影响相关免疫细胞发挥调节作用,本研究通过检测孕鼠外周血和蜕膜局部组织中DC数量、DC表面CCR7和CCL19表达及DC凋亡分化情况,结果显示,FTY720能明显减少DC数量,减少DC表面CCR7和CCL19表达,过继转移S1P-siRNA-DC后,DC数量明显增多,而过继转移过表达S1P-DC后,DC数量明显减少,同时CCR7和CCL19表达降低,而两者对DC细胞凋亡和分化无影响,提示FTY720可能通过抑制DC表面趋化因子及其受体表达,致使趋化至母胎界面的DC数量减少,从而诱导免疫耐受,经进一步趋化实验验证,FTY720与DC共培养后DC数量减少,过继转移S1P-siRNA-DC后,DC数量明显增加,过继转移过表达S1P-DC后,DC数量明显减少,而加入CCL19抗体后,过继转移S1P-siRNA-DC和过表达S1P-DC前后DC数量无明显变化,提示FTY720诱导免疫耐受,发挥降低自然流产孕鼠胚胎丢失率作用,可能是通过阻断S1P信号通路干扰孕鼠体内DC表面趋化因子及其受体表达,减少母胎界面DC细胞数量发挥免疫抑制作用。

