银纳米簇水凝胶对油田管道中硫酸盐还原菌的抗菌性能研究
杨梅 邵泽宇 廖晓玲 徐文峰 张园园


摘 要 以AgNO3和L-半胱氨酸为原料,利用紫外光照还原法制备了具有抗菌效应的银纳米簇水凝胶新型抗菌材料,利用透射电子显微镜(TEM)、X射线光电子能谱仪(XPS)、扫描电子显微镜(SEM)和能谱仪(EDS)对材料结构和形貌进行表征; 利用厌氧工作站,通过最小抑菌浓度(MIC)、最小杀菌浓度(MBC)实验、生长曲线以及细菌染色实验,深入研究了银纳米簇水凝胶对硫酸盐还原菌(SRB)的抗菌性能。结果表明,与常规无机抗菌材料NaClO相比,此银纳米簇水凝胶对SRB具有优良的抗菌作用,对SRB的最小抑菌浓度为18.75 μg/mL, 最小杀菌浓度为37.5 μg/mL。
关键词 油田管道; 细菌腐蚀; 硫酸盐还原菌; 银纳米簇水凝胶; 抗菌性能
1 引 言
近年来,我国多数油田已进入高含水开发期,在油田开采过程中,细菌的腐蚀危害较为严重,造成了较大的经济损失,已经成为油田开发的重点和难点问题[1]。据相关文献报道,对油田腐蚀危害最大的细菌为硫酸盐还原菌(Sulfate reducing bacteria,SRB)[2,3]。SRB是獨特的原核生理群组,是一类具有各种形态特征,能通过异化作用将硫酸盐作为有机物的电子受体进行硫酸盐还原的严格厌氧菌[4,5]。SRB可以通过自身的异化作用代谢产生高浓度的H2S、FeS以及Fe(OH)2[6~8],导致油田管线和设备严重腐蚀,以及过滤系统堵塞等。因此,解决细菌对油田设备腐蚀的问题刻不容缓。由于杀菌剂[9,10]具有经济、方便、见效快等特点,油田控制细菌生长繁殖主要使用杀菌剂。目前,石油管道中使用的杀菌剂主要有氧化型杀菌剂、非氧化型杀菌剂和复配型性杀菌剂3种。氧化型杀菌剂[11,12]包括氯系杀菌剂和溴系杀菌剂; 非氧化型杀菌剂[13,14]包括醛类、氯代酚类、有机胺类、季铵盐类、季磷盐类杀菌剂等; 复配型性杀菌剂包括SQ8(二硫氰基甲烷+1227+溶剂+表面活性剂)、S15(二硫氰基甲烷+溶剂+表面活性剂)等。氧化型杀菌剂具有污染小、见效快、价格低等优点,但其药效维持时间较短,稳定性差,易被污水中有机物消耗掉而失去活性[15]; 非氧化型杀菌剂的杀菌持久性好,但普遍具有毒性,并易产生耐药性[16]。复配型杀菌剂利用各单剂间相互的协同效应取得了较好的应用效果,但长期使用也会产生耐药性[17]。因此,开发新型的石油管道杀菌剂非常必要。
银作为广谱杀菌剂,广泛应用于纺织、制药、材料、建筑等行业。纳米银是一类新型抗菌剂[18~21],由于其尺寸小、比表面积大,具有极强的抑菌、杀菌的作用,并且无耐药性,因此,其抗菌性已被广泛研究和应用。如纳米银与聚谷氨酸、壳聚糖复合得到水凝胶抗菌剂[22]; 汤建新等[23]将聚乙烯亚胺包埋无色纳米银形成协同抗菌剂; 王梓屹等[24]将纳米银应用于根管消毒。
水凝胶具有三维网络结构,在水中能够吸收大量的水分而溶胀,并在溶胀后继续保持其原有结构而不被溶解[25~28]。自1960年首次制得聚羟乙基丙烯酸甲酯(PHEMA)水凝胶以来,水凝胶凭借其优异的载药不失活性等特点,已在食品、环境工程等领域广泛应用[29]。纳米银的性质极不稳定,易发生团聚和氧化,影响其抗菌效果。研究发现,水凝胶不仅可提高银纳米粒子稳定性,同时银纳米粒子也可改善水凝胶的物理机械性能[30]。基于此,本研究以AgNO3和L-半胱氨酸为原料,利用紫外光照还原法制备具有抗菌效应的新型抗菌材料银纳米簇水凝胶,并研究其对SRB的抗菌性能,以期解决现有抗菌材料耐药性的问题。
2 实验部分
2.1 仪器与试剂
ZF-6三用紫外分析仪(上海嘉鹏科技有限公司); GI54TR高压灭菌锅(Zealway Instrument 公司); UV755B紫外可见分光光度计(上海佑科仪器仪表有限公司); Bug Box厌氧工作站(英国Ruskinn公司); XD-202细胞恒温培养箱(美国Thermo Fisher公司); JSM-7800F场发射扫描电子显微镜、JEM-2100F透射电子显微镜(日本电子株式会社); XD-202倒置生物显微镜(江南永新公司)。
Cu(NO3)2·3H2O、L-半胱氨酸(分析纯,上海阿拉丁生化科技股份有限公司); AgNO3、Na2SO4、MgSO4·7H2O(分析纯, 成都市科龙化工试剂厂); 葡萄糖、(NH4)2SO4、Fe2(SO4)3(分析纯,上海麦克林生化科技有限公司); 胰蛋白胨、酵母提取物(英国OXOID公司); 琼脂粉、牛肉膏(北京索莱宝科技有限公司); 脱硫弧菌脱硫亚种(广东省微生物菌种保藏中心); 哥伦比亚血琼脂平板培养基(重庆蒙博生物科技有限公司); 碘化丙啶(PI)溶液(重庆蒙博生物科技有限公司); 4′,6-二脒基-2-苯基吲哚二盐酸盐(DAPI)染液(重庆蒙博生物科技有限公司); 实验用水为超纯水。
2.2 实验方法
2.2.1 银纳米簇水凝胶的制备 银纳米簇水凝胶的制备方法参考文献[30]并稍作修改,具体步骤如下: 在室温条件下,取0.1 mol/L AgNO3溶液300 μL、0.01 mol/L L-半胱氨酸溶液2 mL,混匀,365 nm紫外光照射4.5 h,每隔30 min取出,振荡5 s。常温开盖放置12 h,得到黄色银纳米簇水凝胶。
2.2.2 样品的表征 将制得的银纳米簇水凝胶滴在导电硅片上,在干燥箱中干燥,用扫描电子显微镜(SEM)在加速电压为5 kV下进行观测。材料的粒径用透射电子显微镜(TEM)表征。
2.2.3 SRB培养 SRB干粉的活化操作过程在厌氧工作站中完成。首先向安瓿管内加入200 μL无氧灭菌水使菌粉溶解,随后吸取100 μL菌悬液滴加在血琼脂平板培养基中间,涂抹均匀,最后将培养基置于厌氧罐中,于37℃恒温培养箱中培养5天,得到SRB菌种。将SRB分散在液体培养基中,制成细菌悬浮液(菌悬液),备用。液体培养基由5 g蛋白胨、3 g牛肉膏、0.2 g酵母提取物、5 g葡萄糖、1.5 g MgSO4·7H2O、1.5 g Na2SO4、0.016 g (NH4)2SO4、0.049 g Fe2(SO4)3,加1 L超纯水制成。固体培养基组成与液体培养基相同,只需另加入琼脂。
2.2.4 银纳米簇水凝胶对SRB的抗菌实验 NaClO为油田常用的无机杀菌剂,由于银纳米簇水凝胶为无机材料,所以选择NaClO作为对照。(1)最小抑菌浓度(MIC)测定 按文献[31]的方法,向无菌的离心管中分别加入2.5 mL经高压灭菌的液体培养基,再加入抗菌材料,利用二倍稀释法使银纳米簇水凝胶的最终浓度分别为300、150、75、37.5、18.75 和19.38 μg/mL,NaClO最终浓度分别为900、450、225、112.5、56.25和28.12 μg/mL, 分别向上述试管中加入100 μL浓度约为7.6×105 CFU/mL的受试菌悬液,作为实验组,同时设置空白对照组为不含材料的空白液。将离心管于37℃恒温培养,通过观察培养液浑浊状况评价细菌生长情况。所有实验均在厌氧工作站中进行,确保实验在厌氧无菌环境下操作。(2)最小杀菌浓度(MBC)测定 实验选取MIC及以上浓度所对应的试管中的培养液作为测定MBC的实验物,吸取100 μL培养物涂布在固体培养基上,37℃恒温培养,并观察不同浓度下细菌生长情况。实验均在厌氧工作站中进行,确保实验在厌氧无菌环境下操作。(3)银纳米簇水凝胶对SRB生长曲线的影响 基于上述MIC和MBC的实验结果,选取MIC、MBC以及其中间浓度考察细菌生长情况。每隔2 h取样,用紫外-可见分光光度计测定600 nm处的吸收值(A600)。绘制横坐标为培养时间、 纵坐标为A600的生长曲线。同时设置不含材料的液为空白对照组。(4)SRB荧光染色实验 将与银纳米簇水凝胶和NaClO作用后的SRB用磷酸盐缓冲液制备成悬液。依次加入适量碘化丙啶(PI)和4′,6-二脒基-2-苯基吲哚二盐酸盐(DAPI)染液,避光反应20 min,在荧光显微镜下观察SRB的存活情况。其中,抗菌材料浓度为材料的最小杀菌浓度。DAPI染液直接使用,将PI稀释到浓度约为10 μg/mL。
3 结果与讨论
3.1 银纳米簇水凝胶的表征和性能评价
依照上述实验步骤,将AgNO3与L-半胱氨酸混合均匀的白色浑浊液经过紫外光照还原后,颜色逐渐变黄并透明,得到如图1所示黄色的银纳米簇水凝胶。反应机理[30]如下: 在紫外光照射下,电子e-aq以及羟基自由基·OH与Ag+发生还原反应,形成Ag单质,延长光照即形成原子团簇; 其次,L-半胱氨酸的巯基SH)(易结合到Ag表面,形成一层自组装单体,羧基和氨基通过分子间氢键相互作用形成空间网络凝胶结构,将银纳米簇包覆在内,从而增强银纳米簇的稳定性。此水凝胶具有明显的触变性,即剧烈摇晃后,水凝胶状态将变成流体状态,而常温静置一段时间后,又再次水凝胶化,形成水凝胶状态(图1)。
TEM对银纳米簇水凝胶表征, 结果如图2所示,银纳米簇水凝胶分散性较好,未发生团聚,少部分发生聚集呈链条状分布,平均粒径约为5 nm。使用Digital Micrograph软件对纳米粒子的高分辨TEM图像进行测量,得到10个晶格间距约为2.31 nm,与文献[32]报道的银纳米簇晶格间距一致(图2插图)。为了确定材料中银元素的价态,进一步利用XPS对银纳米簇水凝胶进行表征分析(图3)。在银纳米簇水凝胶的X射线光电子能谱(XPS)全谱图(图3A)中,观察到Ag 3d、N 1s、S 2p和C 1s的特征峰,证明银纳米簇水凝胶中存在半胱氨酸分子。如图3B所示,367.8和373.8 eV的结合能分别对应Ag 3d5/2和Ag 3d3/2,与文献[32,33]报道的银纳米簇中Ag(0)的结合能一致。但Ag与Ag(0)的结合能非常接近,不能排除Ag的存在。以上实验结果表明,已成功制得银纳米簇水凝胶。
采用SEM对银纳米簇水凝胶表面微观结构进行表征,结果表明,制备的银纳米簇水凝胶干燥后分布均匀,进一步放大,呈现大小不一的多孔结构。能谱(EDS)实验结果表明,所制备的银纳米簇水凝胶抗菌材料主要成分为银元素,这与TEM、XPS表征结果吻合。图4中出现硅元素则是用硅片作为承载材料载体的缘故,另外,碳、氧、硫、氮元素均来自L-半胱氨酸。EDS成像分析表明,银、碳、氧、硫、氮元素分布非常均匀(图4)。鉴于银纳米簇水凝胶的结构以及元素价态等特征,文献[34,35]报道其对大肠杆菌和金黄色葡萄球菌具有优异的抑菌效果,主要因为银纳米粒子及其释放的Ag+可以通过破坏细胞膜、与DNA结合、攻击核糖体钝化酶等途径导致菌体细胞死亡。
3.2 银纳米簇水凝胶对SRB的MIC和MBC
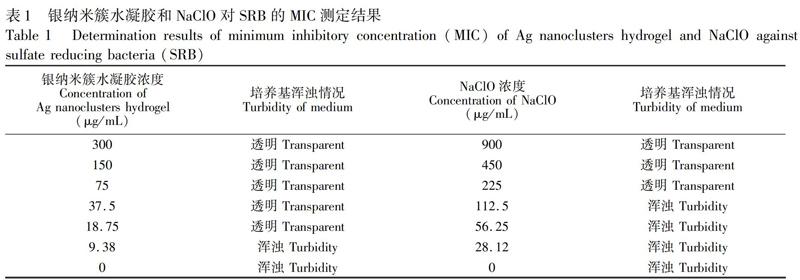
鉴于银纳米簇水凝胶对大肠杆菌和金黄色葡萄球菌的优良抗菌效果,针对目前石油管道抗菌剂耐药性的问题,进一步考察了银纳米簇水凝胶对石油管道腐蚀细菌SRB的抗菌性能。MIC是指抗菌药物能抑制培养基中细菌生长的最低浓度,以液体培养基明显不浑浊为判定依据[31]。按上述实验步骤测定银纳米簇水凝胶对受试菌株SRB的MIC结果如表1所示。当银纳米簇水凝胶浓度为 0~9.375 μg/mL,對照材料NaClO浓度为0~112.5 μg/mL时,受试菌液呈现肉眼可见的浑浊现象,这是由于SRB繁殖生长所致,说明受试菌液中的抗菌剂无法抑制SRB生长。当银纳米簇水凝胶浓度为18.75~300 μg/mL,NaClO浓度为225~900 μg/mL时,受试菌液无肉眼可见的浑浊现象,表明此浓度下的抗菌剂抑制SRB的生长繁殖。由此确定,银纳米簇水凝胶和NaClO对SRB的MIC分别为18.75和225 μg/mL,所制备银纳米簇水凝胶材料的MIC远低于常规抑菌剂NaClO。
MBC是以固体培养基上无菌落生长为判定依据。在MIC的基础上,分别选取18.75和225 μg/mL及以上浓度测定银纳米簇水凝胶和NaClO的MBC。结果表明,当银纳米簇水凝胶浓度高于37.5 μg/mL, NaClO浓度为450 μg/mL时,固体培养基上无菌落生长。测得银纳米簇水凝胶和NaClO对SRB的MBC分别为37.5 和450 μg/mL,表明制备的银纳米簇水凝胶对SRB的杀菌能力明显优于NaClO。
3.3 银纳米簇水凝胶对SRB生长曲线的影响
材料对受试菌SRB生长曲线的影响如图5所示,不同浓度的材料对SRB的抑制作用不同,抑制作用随材料浓度的升高而增强。银纳米簇水凝胶对SRB的抑菌作用较好,当其浓度为MIC时,受试菌出现约32 h的生长延迟; 当溶液浓度为28.12 μg/mL时,可强烈地抑制其生长,当溶液浓度达到MBC时,在36 h可完全抑制受试菌生长,表现出优异的抑菌杀菌性能。NaClO浓度为MIC时,受试菌仅出现约18 h的生长延迟,当NaClO浓度为337.5 μg/mL, 36 h细菌开始明显生长。
3.4 SRB荧光染色
为了进一步探索银纳米簇水凝胶对SRB的抗菌性,将材料与SRB作用后,利用DAPI/PI染液染色进行荧光成像。PI是一种不能穿透完整细胞膜,但能穿透凋亡晚期细胞和死细胞的破损细胞膜,并使其在荧光显微镜下呈现红色荧光的荧光染料。相反,DAPI是一种能透过完整的细胞膜,可以使活细胞和固定细胞染色,并在荧光显微镜下呈现蓝色的荧光染料。因此,可以通过荧光显微镜图像上蓝色和红色荧光的情况判断细菌存活状况。图6A为未加材料的空白对照,呈现出蓝色荧光,表示细菌存活良好。图6B和6C为SRB与银纳米簇水凝胶和NaClO作用后的荧光图,呈现出红色荧光,表明细菌与抗菌材料作用后死亡。上述结果进一步证明了银纳米簇水凝胶对SRB的杀菌作用。
4 结 论
采用AgNO3和L-半胱氨酸,利用紫外光照制备得到银纳米簇水凝胶材料,并将其用于硫酸盐还原菌的抗菌性研究。SEM、XPS、TEM等表征结果表明,银纳米簇水凝胶分布均匀,粒径约5 nm,银元素主要以Ag(0)形式存在。抗菌实验结果表明,银纳米簇水凝胶对SRB的MIC为18.75 μg/mL, MBC为375 μg/mL,而对照材料NaClO对SRB的MIC为225 μg/mL,MBC为450 μg/mL,说明银纳米簇水凝胶的抗菌性能明显优于NaClO, 具有良好的抗菌性。本研究将银纳米簇水凝胶用于油田管道的抗菌研究,比水凝胶展现出优异的抗菌能力,在油田管道杀菌方面具有潜在的应用价值。
References
1 Wu T Q, Xu J, Sun C, Yan M C, Yu C K, Ke W. Corros. Sci., 2014, 88: 291-305
2 Dec W, Jaworska-Kik M, Simka W, Michalska J. Mater. Corros., 2018, 69(1): 53-62
3 Li Q S, Wang J H, Xing X T, Hu W B. Bioelectrochemistry, 2018, 122: 40-50
4 Marja-Aho M, Rajala P, Huttunen-Saarivirta E, Legat A, Kranjc A, Kosec T, Carpen L. Sens. Actuators A, 2018, 274: 252-261
5 Vaithiyanathan S, Chandrasekaran K, Barik R C. 3 Biotech, 2018, 8(12): 495-505
6 Zhai X F, Li K, Guan F, Sun C T, Duan J Z, Hou B R. Surf. Coat. Techol., 2018, 344: 259-268
7 Fida T T, Voordouw J, Ataeian M, Kleiner M, Okpala G, Mand J, Voordouw G. Front. Microbiol., 2018, 9: 981-991
8 Rasool K, Nasrallah G K, Younes N, Pandey R P, Mahmoud K A. ACS Sustainable Chem. Eng., 2018, 6(3): 3896-3906
9 Yin B, Williams T, Koehler T, Morris B, Manna K. Int. Biodeterior. Biodegrad., 2016, 126: 204-207
10 LI Xiao-Dan, WANG Jian-Mei, WANG Xiang-Jun, YANG Hua, JI Xiao-Feng, XU Jie, QIAN Ming-Rong. Chinese J. Anal. Chem., 2019, 47(2): 138-146
李曉丹, 汪建妹, 王向军, 杨 华, 吉小凤, 徐 杰, 钱鸣蓉. 分析化学, 2019, 47(2): 138-146
11 SHAO Xiang-Wen, ZHANG Ting-Ting, AI Cui-Ling, XU Jun-Ge. Industrial Water Treatment, 2019, 39(4): 86-88
邵享文, 张婷婷, 艾翠玲, 许俊鸽. 工业水处理, 2019, 39(4): 86-88
12 MA Rong. Oil-gasfield Surface Engineering, 2016, 35(6): 88-89
马 荣. 油气田地面工程, 2016, 35(6): 88-89
13 WANG Lin, ZHANG Shou-Xian, WANG Wei-Dong, ZHANG Xiu-Xia. Modern Chemical Industry, 2017, 37(12): 114-117
王 淋, 张守献, 汪卫东, 张秀霞. 现代化工, 2017, 37(12): 114-117
14 LI Yan-Qing. Chemical Engineering Design Communication, 2016, 42(6): 21-22
李延庆. 化工设计通讯, 2016, 42(6): 21-22
15 YANG Peng-Hui, ZHANG Yu-Xiang, LI Ting, REN Xiang-Mei, YANG Jiang. Shandong Chemical Industy, 2015, 44(3): 52-54
杨鹏辉, 张宇翔, 李 霆, 任香梅, 杨 江. 山东化工, 2015, 44(3): 52-54
16 LIU Xia, LI Peng-Fei, ZHANG Xiu-Hua, WANG Dong-Hai, CHENG Zhong-Fa, GAO Can-Zhu. Journal of Water Treatment Information Reporting, 2016, 35(2): 1-4
刘 霞, 李鹏飞, 张秀华, 王东海, 程终发, 高灿柱. 水处理信息报导, 2016, 35(2): 1-4
17 ZHANG Qing-Dong, ZHOU Guo-Ying, ZHAO Dong-Feng. Guangdong Chemical Industy, 2014, 41(5): 233-234
张庆冬, 周国英, 赵东风. 广东化工, 2014, 41(5): 233-234
18 Kalaiyarasan T, Bharti V K, Chaurasia O P. RSC Adv., 2017, 7(81): 51130-51141
19 Koudehi M F, Fooladi A A I, Aghozbeni E A H, Mohammad R N. Mater. Technol., 2019, (221): 1-9
20 Dil N N, Sadeghi M. J. Hazard. Mater., 2018, 351: 38-53
21 Rao A V, Ashok B, Umamahesh M, Umamahesh M, Chandrasekhar, V, Subbareddy G V, Rajulu A V. Int. J. Polym. Anal. Charact., 2018, 23(6): 493-501
22 WANG Jian-Tao, PAN Xiao-Chen, WANG Shu-Fang. Ion Exchange and Adsorption, 2016, (4): 297-305
王建涛, 潘晓晨, 王淑芳. 离子交换与吸附, 2016, (4): 297-305
23 TANG Jian-Xin, DONG Lin-Li, SU Wei, WANG Shuang-Shuang, XU Li-Jian. Journal of Functional Materials, 2015, 46(14): 14097-14102
湯建新, 董林利, 苏 伟, 王霜霜, 许利剑. 功能材料, 2015, 46(14): 14097-14102
24 WANG Xin-Yi, GAO Yan, HU Xiao-Li, ZHUANG Pei-Lin, JIANG Xiao-Qiong, MA Ke. Chin. J. Stomatol. Res. (Electronic Edition), 2015, (4): 283-288
王梓屹, 高 燕, 胡晓莉, 庄沛林, 蒋晓琼, 马 可. 中华口腔医学研究杂志(电子版), 2015, (4): 283-288
25 GAO Min-Jun, LIU Gen-Qi, XUE Ya-Feng, CHEN Xiao-Juan, SHI Wei-Jiang, FAN Xiao-Dong. Chinese J. Anal. Chem., 2017, 45(5): 727-733
高敏君, 刘根起, 薛亚峰, 陈小娟, 师维江, 范晓东. 分析化学, 2017, 45(5): 727-733
26 LIU Wan-Yi, YANG Lu-Ze, YU Meng, LIU Miao. Chinese J. Anal. Chem., 2016, 44(5): 707-715
刘宛宜, 杨璐泽, 于 萌, 刘 淼. 分析化学, 2016, 44(5): 707-715
27 MENG Liang, MENG Pin-Jia, ZHANG Qing-Qing, WANG Yan-Ji. Chinese J. Anal. Chem., 2015, 43(4): 495-501
孟 梁, 孟品佳, 张庆庆, 王彦吉. 分析化学, 2015, 43(4): 495-501
28 CHAI Rui-Tao, LIU Yu-Teng, ZHANG Guo, ZHU Wei-Huang, CHEN Yu-Yun, FENG Jian-Jun, CHAI Shou-Ning. Chinese J. Anal. Chem., 2018, 46(3): 432-437
柴瑞涛, 刘雨腾, 张 国, 朱维晃, 陈宇云, 冯建军, 柴守宁. 分析化学, 2018, 46(3): 432-437
29 Hoffman A S. Adv. Drug Deliv. Rev., 2002, 54(1): 3-12
30 Cui Y Y, Wang Y L, Zhao L N. Small, 2015, 11(38): 5118-5125
31 Wiegand I, Hilpert K, Hancock R E W. Nat. Protoc., 2008, 3(2): 163-175
32 Zhang Y Y, Jiang H, Ge W, Li Q W, Wang X M. Langmuir, 2014, 30(36): 10910-10917
33 Li H W, Yue Y, Liu T Y, Li D M, Wu Y Q. J. Phys. Chem. C, 2013, 117: 16159-16165
34 Shome A, Dutta S, Maiti S, Kumar Das P. Soft Matter, 2011, 7(6): 3011-3022
35 Guzman M, Dille J, Godet S. Nanomed.-Nanotechnol. Biol. Med., 2012, 8(1): 37-45
Antibacterial Activity of Ag Nanoclusters Hydrogel
to Sulfate Reducing Bacteria in Oil Field Pipeline
YANG Mei1, 2, SHAO Ze-Yu1, 2, LIAO Xiao-Ling1, 2, XU Wen-Feng*1, 2, ZHANG Yuan-Yuan*1, 2
(Institute of Biomedical Engineering1, Chongqing Engineering Laboratory of Nano/Micro Biological Medicine
Detection Technology2, Chongqing University of Science and Technology, Chongqing 401331, China)
Abstract A novel antibacterial material of Ag nanoclusters hydrogel using silver nitrate and L-cysteine as raw materials was prepared by ultraviolet light reduction method. The structure and morphology of the material were characterized by transmission electron microscope (TEM), X-ray photoelectron spectra (XPS), scanning electron microscope (SEM) and X ray energy spectrum analysis (EDS). The antimicrobial properties of Ag nanoclusters hydrogel against sulfate reducing bacteria (SRB) were further studied through the minimum inhibitory concentration (MIC), the minimum bactericidal concentration (MBC), growth curve and bacterial staining experiment using anaerobic workstations. The results indicated that, compared with the conventional inorganic antibacterial material sodium hypochlorite, the prepared Ag nanoclusters hydrogel had excellent antibacterial effect on SRB, and the MIC and MBC against SRB were 18.75 μg/mL and 37.5 μg/mL, respectively.
Keywords Oilfield pipeline; Bacterial corrosion; Sulfate reducing bacteria; Ag nanoclusters hydrogel; Antibacterial properties
(Received 21 December 2019; accepted 28 October 2020)
This work was supported by the National Natural Science Foundation of China (No. 11532004), the Natural Science Foundation of Chongqing Science and Technology Commission (Nos. CSTC2018jcyjAX0286, CSTC2019JCYJ-msxmX0221, CSTC 2019JSCX-msxmX0231), and the Postgraduate Science and Technology Innovation Program of Chongqing University of Science and Technology (No. YKJCX1820206).
2019-12-21收稿; 2020-10-28接受
本文系國家自然科学基金项目(No. 11532004)、重庆市科委自然科学基金项目(Nos. CSTC 2018JCYJAX0286, CSTC2019JCYJ-msxmX0221, CSTC 2019JSCX-msxmX0231)和重庆科技学院研究生科技创新计划项目(No. YKJCX1820206)资助
* E-mail: xwf_228@163.com; zhyy1216@126.com

