一种超灵敏检测镉离子的核酸适配体电化学传感器
袁敏 钱世权 曹慧 徐斐 叶泰 于劲松 郭文 吴嘉颖 阿提坎?吾斯曼

摘 要 设计了一种基于核酸适配体检测镉离子(Cd2+)的电化学生物传感器, 将适配体互补链(CDNA)通过AuS键自组装于金电极表面, 并与适配体杂交结合形成双链DNA。由于适配体对Cd2+有特异性结合能力, 加入Cd2+后, 与互补链竞争结合适配体, 使修饰二茂铁基团的适配体从金电极表面脱落, 二茂铁的电化学信号显著减小。采用方波伏安法(SWV)进行检测, 本传感器对Cd2+的线性检测范围为1.0 nmol/L~10.0 μmol/L, 检出限为65.1 pmol/L, 线性方程为ΔI =0.2872+0.2327lgC(R2=0.9972), 10 s内即可完成检测。实际江水样品中Cd2+的检测结果与石墨炉原子吸收光谱法的检测结果一致, 加标回收率为97.1%~99.5%。本方法灵敏度高、检测速度快、特异性强, 在镉环境污染监测方面具有良好的应用前景。
关键词 镉离子; 电化学; 生物传感器; 适配体; 二茂铁
1 引 言
随着工业化的发展, 重金属污染日益严重, 一些难降解的重金属在生物体内累积会引发多种疾病[1]。镉(Cd)在冶金、颜料、镍镉电池和军工等领域应用广泛[2,3], 进入人体后, 可与蛋白质结合, 抑制多种酶的活性, 从而影响机体的正常功能[4,5]。我国国家标准规定, 饮用水中镉的最高限量值为44.5 nmol/L[6]。因此, 建立一种高灵敏监测环境和食品中镉含量的方法具有重要意义[7,8]。
目前, 检测镉等重金属离子的方法主要有原子吸收光谱法(AAS)[9,10]、电感耦合等离子体发射光谱法(ICP-AES)[11]及原子荧光光谱法(AFS)[12]等。Wu等[13]对冬虫夏草微波消解后, 用ICP-AES测量其中的Cr、Cd、Pb、As、Hg和Ni。Rizwan等[14]以氯化胆碱、苯酚配制低共熔溶剂(DESs),萃取水、食品中的Pb2+, 并利用石墨炉原子吸收光谱仪(GF-AAS)进行了测定。但是, 这些方法所用仪器昂贵, 操作复杂, 对实验场所要求高。如原子吸收光谱仪测定不同元素需更换光源灯; 原子荧光光谱法则由于可与氢化物发生反应的元素有限, 限制了该方法的应用[15,16], 因此,开发一种简便、快速、灵敏度高、特异性好的重金属检测方法仍是目前研究的热点。
核酸适配体[17]因其特异性好、靶分子范围广、可体外合成和易于修饰等特点被广泛用于重金属检测。本研究组利用核酸适配体和石英晶体微天平技术构建了用于检测Pb2+和As3+的压电生物传感器[18,19]。Huang等[20]利用核酸适配体和AuNPs, 基于HCR杂交链式反应, 制备了一种简单快速、操作简单的Pb2+比色生物传感器。目前报道的Cd2+适配体传感器多使用2014年Wu等[21]利用指数富集的配体系统进化(SELEX)技术筛选出的核酸适配体序列, 但该序列含有大量的T和G碱基, 导致Pb2+ 和Hg2+ 容易对检测结果造成严重的干扰。2016年,Wang等[22]筛选出一条新的Cd2+核酸适配体, 其解离系数与之前的适配体相当, 但具有更高的靶标特异性, 因而更适合应用于发展Cd2+传感器。2019年,Zhou等[23]利用该适配体建立了一种Cd2+ 荧光检测方法, 检出限为3 nmol/L, 并证明Cd2+与适配体的结合力强于适配体与其部分互补序列之间的碱基配对作用力, Cd2+存在時, 可将适配体序列从双链DNA中解离。
电化学传感器[24~26]具有简单、快速、灵敏等优点, 基于适配体构建的电化学传感器由于其检测速度快、设备简单易操作、检测范围宽、灵敏度高, 被广泛用于医疗和食品安全等领域[27~31]。2017年, Lotfi等[32]基于Cd2+与适配体的特异性结合, 诱导适配体单链DNA形成发夹结构, 使修饰亚甲基蓝的DNA的 3′端靠近电极表面, 通过亚甲基蓝电化学信号的增强, 实现了Cd2+的灵敏检测, 但该方法灵敏度较低, 检出限仅为92 nmol/L, 无法满足国家标准规定饮用水中镉的最高限量(44.5 nmol/L)检测要求。 因此, 建立一种高灵敏检测Cd2+的方法非常必要。
基于Wang等[22]筛选的Cd2+适配体, 本研究发展了一种“Turn-off”型核酸适配体电化学传感器, 通过Cd2+与适配体的特异性结合, 使适配体与其互补序列解链, 使传感器表面的电化学信号大幅降低, 基于此实现Cd2+的灵敏检测。与传统的交流伏安 (ACV) 法和微分脉冲伏安 (DPV) 法相比, 方波伏安(SWV)法可以在较短时间内同时分析正向、反向电流以及净电流, 从而获得较宽电位范围的电位图, 提高检测灵敏度, 缩短检测时间[33]。本研究利用二茂铁(Fc)标记的核酸适配体与Cd2+之间的度亲和力, 采用SWV检测, 实现了对Cd2+的高灵敏快速分析, 检出限达到pmol/L级别, 并对实际水样进行了分析检测。
2 实验部分
2.1 仪器与试剂
TC-XP-G PCR仪(杭州博日科技有限公司); VORTEX-5旋涡混合仪(海门市其林贝尔仪器制造有限公司); FA2204B电子天平(杭平公司); S210 pH计(梅特勒-托利多仪器有限公司); CHI660E电化学工作站(上海辰华仪器有限公司); TGL-16G高速离心机(上海安亭科学仪器厂); Savant AA石墨炉原子吸收分光光度计(澳大利亚GBC科学仪器公司)。
三羟甲基氨基甲烷(Tris)、巯基己醇(MCH)、三-(2-甲酰乙基)膦盐酸盐(TCEP)(Sigma-Aldrich公司); K3[Fe(CN)6]、KCl、NaCl、CdCl2、HgCl2、ZnCl2、CuCl2、FeCl2、Pb(Ac)2、H2O2(30%)、浓H2SO4、无水乙醇、NaH2PO4、K2HPO4(国药集团化学试剂公司)。所用试剂均为分析纯;实验用水为超纯水(≥18.3 MΩ·cm)。
电化学检测采用三电极体系: 金电极(Au, 直径2 mm)为工作电极, 铂丝为对电极, Ag/AgCl电极为参比电极。电极均购于武汉高仕睿联科技有限公司。
所用DNA核酸序列由生工生物工程(上海)股份有限公司合成,3′修饰Fc的Cd2+适配体(Cd Apt)序列为: 5′-CTCAGGACGACGGGTTCACAGTAGGTTGTC-Fc-3′; 5′修饰巯基的部分互补序列为: 5′-SH-ACTAATGATCTGTGTAATGCTGTGAACCCGTCGTCCTGAG-3′。
2.2 自组装膜金电极的制备
将100 μmol/L CDNA在95℃加热变性5 min, 降温至25℃, 静置5 min, 加入等体积3 mmol/L TCEP, 用10 mmol/L Tris-HCl缓冲液(含100 mmol/L NaCl, pH 7.4)稀释至10 μmol/L, 于4℃保存。
取20 μL上述制备好的CDNA溶液, 将处理好的金电极[34,35]浸没其中, 置于25℃恒温箱反应16 h, 用10 mmol/L Tris缓冲液(含100 mmol/L NaCl, pH 7.4)洗净, 在氮气下吹干, 浸入1 mmol/L MCH 1 h, 封闭空余的电极表面, 然后滴加15 μL 5 μmol/L Cd Apt, 25℃恒温箱中反应30 min, 得到双链DNA修饰的自组裝膜金电极(Au/CDNA/MCH/Cd Apt), 于4℃保存。每一步的电极组装过程均采用CV法和电化学阻抗谱(EIS)测试。
2.3 电化学检测Cd2+
将制备的Au/CDNA/MCH/Cd Apt浸入20 μL不同浓度的Cd2+溶液中反应30 min, 用缓冲液洗净, 氮气吹干, 在10 mmol/L PBS(含100 mmol/L NaCl, pH 7.4)中, 采用SWV法测定, 参数设置: 电位0.6~0.2 V, 频率(Frequency) 25 Hz, 阶跃电位(Step potential) 4 mV, 振幅(Amplitude) 25 mV。
2.4 样品处理和镉离子的测定
黄浦江水采集自上海杨浦段。水样以8000 r/min离心15 min, 过0.22 μm膜, 用10 mmol/L Tris缓冲液(含100 mmol/L NaCl, pH 7.4)调至pH 7.4, 采用本方法进行测定, 并进行加标回收实验, 计算回收率。同时, 使用石墨炉原子吸收光谱法(GF-AAS)测量。
3 结果与讨论
3.1 实验原理
本研究基于Cd2+适配体对Cd2+的高特异性亲和力, 采用竞争法实现响应信号“Turn off”变化, 发展了一种检测Cd2+的电化学生物传感器。实验原理示意图见图1, 5′端修饰巯基的CDNA通过AuS键固定在金电极上, 随后将适配体Cd Apt滴加到电极表面, 与CDNA通过碱基互补配对, 形成部分互补的双链DNA, 刚性的双链结构可极大地增加电极表面直立状态DNA的数量。由于Cd Apt 的3′端修饰有Fc, Fc靠近电极, 引起高强度的信号; 当Cd2+存在时, Cd Apt与Cd2+发生特异性结合, 破坏DNA的双链结构, 使Cd Apt游离出来, 修饰电极Fc的电流信号随之减弱, 使用SWV法通过检测信号的变化实现对Cd2+的快速、灵敏检测。相比于电极表面直接修饰适配体序列, 利用竞争法, 靶分子与适配体结合, 与互补序列分离, 有利于增强电极表面电阻抗的变化程度, 提高了灵敏度。
3.2 电极修饰过程的表征
采用CV法表征金电极表面互补序列CDNA和无修饰适配体Cd Apt的相互作用过程, 结果如图2A所示。裸金电极(图2A曲线a)在0.2 V处出现一对对称的氧化还原峰, 峰电流差值为140 μA; 修饰巯基的CDNA在裸金电极表面形成导电性较差的自组装膜, 阻碍[Fe(CN)6]3-/4-在电极表面的电子传递, 峰电流差值减小(图2A曲线b); 采用MCH封闭电极表面空余结合位点, 以减少非特异性吸附, 进一步减少了电子传递, 导致峰电流差值进一步减小, 氧化还原峰位出现较大的位移(图2A曲线c);
无修饰适配体序列Cd Apt与CDNA通过杂交反应在电极表面形成刚性双链DNA, 峰电流差值略降, 氧化还原峰位也有显著位移(图2A曲线d); 将Cd2+溶液滴加到电极表面后, Cd2+与适配体Cd Apt发生特异性结合, 使Cd Apt从双链DNA中解离出来, 峰电流差值恢复到只有CDNA和MCH的状态(图2A曲线f)。EIS表征结果如图2B所示, 在高频区观察到的半圆部分直径增大, 反映出界面电荷转移电阻(Rct)增加, EIS表征结果与CV的表征结果一致, 表明此电化学生物传感器可以实现Cd2+的电化学检测。
3.3 SWV法检测Cd2+
采用SWV检测修饰电极对Cd2+的电化学响应。Au/CDNA/MCH/Cd Apt电极在0.38 V附近出现Fc的信号峰(图3a), 当电极与5 μmol/L Cd2+溶液孵育后, Fc的信号峰电流值减小(图3b)。这是因为Cd2+与Cd Apt发生特异性结合, 使标记了FC的适配体Cd Apt从双链中解离, Fc远离电极表面, 因此峰电流降低。
3.4 实验参数的优化
对影响电化学传感器分析性能的实验参数进行了优化, 包括适配体互补序列CDNA在金电极上的自组装时间、CDNA浓度、CDNA与Cd Apt的用量比例、传感器与Cd2+反应的时间等。随着CDNA在金电极上自组装时间延长, Au/CDNA/MCH/Cd Apt电极与Cd2+反应前后的峰电流差值越来越大(图4A), 10 h后逐渐趋于平缓, 16 h时反应完全, 因此选择16 h为CDNA在金电极上的最佳自组装时间。随着滴加在金电极表面CDNA浓度逐渐增加, 电流差值逐渐增大(图4B), 当CDNA浓度为10 μmol/L时, 电流差值最大; CDNA浓度继续增高, 电流差值反而逐渐减弱, 可能是CDNA浓度过高时, 产生的空间位阻效应阻碍了电子传递, 导致电流降低, 所以选择10 μmol/L为最适CDNA浓度。当CDNA与Cd Apt的用量比为1∶0.5时(即CDNA为10 μmol/L, Cd Apt为5 μmol/L), 电流差值最大(图4C), Cd Apt浓度过低时, 可能导致电极表面固定的大量CDNA缺乏Cd Apt与之杂交, 电流差值较小; 当Cd Apt浓度过高, 电极表面的双链DNA密度大, 空间位阻大, 不利于Cd2+与Cd Apt的结合以及Cd Apt从电极表面双链DNA中的脱离。随着Cd2+与传感器反应时间的延长, 电流差值逐渐增大, 30 min时逐渐平缓, 表明反应趋于完全, 因此选择最佳反应时间为30 min(图4D)。
3.5 Cd2+适配体传感器的检测性能
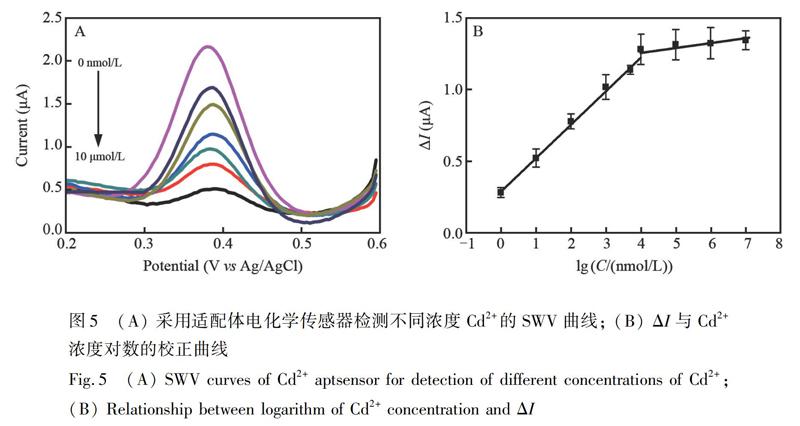
测量了传感器对不同浓度Cd2+的SWV响应, 结果如图5所示。以Au/CDNA/MCH/Cd Apt电极测得的信号值为空白值I0, Cd2+与适配体Cd Apt发生特异性反应后, 以Au/CDNA/MCH/Cd Apt/Cd2+电极测得的电流值为I1, 如图5B所示, 在1.0 nmol/L~10.0 μmol/L范围内, Cd2+浓度的对数值(lgC)与电流差值ΔI(I1-I0)有良好的线性关系, 线性回归方程为: ΔI=0.2872+0.2327lg[C/(nmol/L)), 相关系数R2=0.9972,检出限(3σ)为65.1 pmol/L。
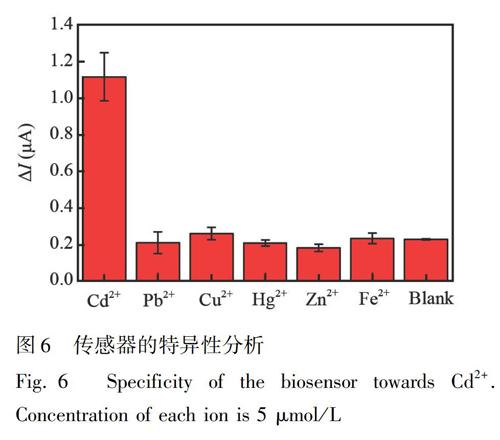
考察了传感器对其它二价金属阳离子(Pb2+、Zn2+、Hg2+、Cu2+和Fe2+)的电化学响应, 如图6所示, 此生物传感器仅对Cd2+(5 μmol/L)有明显的电化学响应, 而对于相同浓度其它金属离子的响应非常微弱, 表明此传感器对Cd2+具有较高的选择性。相比于文献报道的检测Cd2+的方法, 本方法具有较低的检出限(表1)。
3.6 实际样品的检测
采用本方法对黄浦江水样进行直接分析, 未检出Cd2+。在水样中进行加标回收实验, Cd2+的添加水平为1.0、10和100 nmol/L, 回收率分别是97.1%、 97.9%和99.5%(表2), 本方法的测量结果与我国国家标准[40]使用的Cd2+检测方法-石墨炉原子吸收光谱法(GF-AAS)的测量结果一致, 表明本方法在实际水样检测中具有良好的实用性。
4 结 论
基于适配体对Cd2+的特异性竞争性识别作用构建了适配体电化学生物传感器, 实现了水样中Cd2+的超灵敏检测, 检出限(3σ)为65.1 pmol/L。本传感器操作简单方便, 无需复杂的样品前处理或浓缩等步骤。采用方波伏安法(SWV)对Cd2+进行检测, 可检测的线性范围宽(1 nmol/L~10 μmol/L), 实际江水样品中Cd2+的回收率为97.1%~99.5%。本研究构建的Cd2+适配体电化学传感器检出限低、灵敏度高、特异性好, 具有良好的实际应用前景。
References
1 Gu Q, Chen Z P, Yu X L, Cui W T, Pan J C, Zhao G, Xu S, Wang R, Shen W B. Plant Sci., 2017, 261: 28-37
2 LI Na, LI Xi, CHU Mei, CHENG Dan, ZHOU Jian, CHEN Qi, LI Yu-Gang, DONG Yu-Lin. Mater. Rep., 2017, 31(11):115-120
李 娜, 李 曦, 褚 梅, 程 丹, 周 键, 陈 奇, 李玉刚, 董玉林. 材料导报, 2017, 31(11): 115-120
3 Yuan Z, Peng M, He Y, Yeung E S. Chem. Commun., 2011, 47(43): 11981-11983
4 Mameli M, Aragoni M C, Arca M, Caltagirone C, Demartin F, Farruggia G, Filippo G D, Devillanova F A, Garau A, Isaia F, Lippolis V, Murgia S, Prodi L, Pintus A, Zaccheroni N. Chem. -Euro J., 2010, 16(3): 919-930
5 Feng Y. Environ. Develop., 2013, 29(3): 87-93
6 GB5749-2006. Standards for Drinking Water Quality. National Standards of the People′s Republic of China
生活饮用水卫生标准. 中华人民共和国国家标准. GB5749-2006
7 Li Y P, Wang S L, Prete D, Xue S Y, Nan Z R, Zang F, Qian Z. Sci. Total Environ., 2017, 595: 344-351
8 Cao H B, Gao F Y, Xia B, Zhang M M, Liao Y L, Yang Z, Hu G L, Zhang C Y. Ecotox. Environ. Safe., 2016, 125: 93-101
9 David M, Guillermo G, Luis G, Juan M J. Food Compos. Anal., 2018, 67: 178-183
10 HUANG Chu-Chu, LI Qing, ZHANG Guo-Xia, WANG Zheng. Chinese J. Anal. Chem. , 2016, 44(7): 1047-1052
黃楚楚, 李 青, 张国霞, 汪 正. 分析化学, 2016, 44(7): 1047-1052
11 David A, Ryan E, Avery H, Wu F C, Dulasiri A. Microchem. J., 2017, 135: 129-139
12 Luo H, Wang X Y, Dai R, Liu Y, Jiang X, Xiong X L, Huang K. Microchem. J., 2017, 133: 518-523
13 Wu S W, Li G D, Wang Y, Li N, Xin S G, Hou L H, Zhang S Q. Appl. Mechan. Mater., 2015, 733: 299-302
14 Rizwan A Z, Mustafa T, Muhammad Y K. J. Mol. Liquids, 2018, 259: 220-226
15 Wang Q, Yang Z. Environ. Pollut., 2016, 218: 358-365
16 Wang H, Wen F, Chen Y, Sun T, Meng Y, Zhang Y. Biosens. Bioelectron., 2016, 85: 692-697
17 Tuerk C, Gold L. Science, 1990, 249(4968) : 505-510
18 Yuan M, Song Z, Fei J, Wang X, Xu F, Cao H, Jinsong Yu. Microchim. Acta, 2017, 84:1397-1403
19 Yuan M, Zhang Q Q, Song Z, Ye T, Yu J, Cao H, Xu F. Microchim. Acta, 2019, 186: 268
20 Huang Z J, Chen J M, Luo Z W, Wang X Q, Duan Y X. Anal. Chem., 2019, 91(7): 4806-4813
21 Wu Y, Zhan S, Wang L, Zhou P. Analyst, 2014, 139(6): 1550
22 Wang H, Cheng H, Wang J, Xu L, Chen H, Pei R. Talanta, 2016, 154: 498-503
23 Zhou B, Yang X Y, Wang Y S, Yi J C, Zeng Z, Zhang H, Zhang H, Chen Y T, Hu X J, Suo Q L. Microchem. J., 2019, 144: 377-382
24 Hammond J L, Formisano N, Estrela P, Carrara S,Tkac J. Essays Biochem., 2016, 60(1): 69-80
25 Wang L, Wang C, Hao L. Analyst, 2018, 143(13): 3202-3208
26 Gobelli D, Correa N M, Barroso M F, Moyano F, Molina P G. Electroanalysis, 2015, 27(8): 1883-1891
27 Shui B Q, Tao D, Cheng J, Mei Y, Guo Z Z. Analyst, 2018, 143(15): 3549-3554
28 Liu X Y, Deng K Q, Wang H, Li C X, Huang H W. Microchim. Acta, 2019, 186(6): 347
29 Xiao Q, Feng J R, Feng M M, Li J W, Huang S. Microchim. Acta, 2019, 186(7): 478
30 Yang Y B, Yang X D, Yang Y J, Yuan Q. Carbon, 2017, 129: 380-395
31 XIAO Qing, CHEN Lin, LI Wen-Feng, YANG Li-Qin, CAO Zhong, YU Xin-Yao, LONG Shu, HE Jing-Lin, XIAO Zhong-Liang. Chinese J. Anal. Chem., 2018, 46(12): 45-53
肖 情, 陳 琳, 李文锋, 杨丽琴, 曹 忠, 于鑫垚, 龙 姝, 何婧琳, 肖忠良. 分析化学, 2018, 46(12): 45-53
32 Lotfi Z Z H R, Rodriguez Y M, Lai R Y. J. Electroanal. Chem., 2017, 803: 89-94
33 Zhou B, Yang X Y, Wang Y S, Yi J C, Zeng Z, Zhang H. Microchem. J., 2019, 144: 377-382
34 CAO Ya, KANG Ming-Yang, CHEN Hong, TANG Ying-Ying, FENG Chang, ZHAO Jing, LI Gen-Xi. Chinese J. Anal. Chem., 2017, 45(12): 1903-1908
曹 亚, 康明扬, 陈 红, 唐盈盈, 冯 畅, 赵 婧, 李根喜. 分析化学, 2017, 45(12): 1903-1908
35 Gonzalez J Q, Sequí J A. J. Electroanal. Chem., 2019, 854: 113549

