开阳地区桑葚果园富硒酵母菌的分离、筛选及鉴定
杨新,陈莉,杨双全,卢红梅,章之柱,杨华连,孟洋,魏建敏
1(贵州大学,贵州省发酵工程与生物制药重点实验室,贵州 贵阳,550025)2(贵州大学 酿酒与食品工程学院,贵州 贵阳,550025) 3(贵州大学 化学与化工学院,贵州 贵阳,550025)4(开阳县市场监督管理局,贵州 贵阳,550300)
硒(selenium,Se)是一种人体生长发育所必需的微量元素,具有“生命火种”、“心脏的守护神”和“抗癌之王”的美誉[1-2]。硒作为体内某些酶和蛋白的重要组成部分,具有抗衰老、抗氧化、抗肿瘤、影响人和动物的生殖发育、增强机体免疫力、拮抗有害重金属和预防多种疾病等生物学功能[3-6]。硒元素的缺乏会引起心血管疾病、肿瘤、克山病、大骨节病、癌症、高血压和免疫系统功能紊乱等疾病[7-10]。由于硒元素在人体中无法合成,因此需要从日常饮食中摄取,人体内硒水平的高低主要取决于膳食结构、食物中硒的含量及其化学形态[11]。然而,硒在地壳中的分布极不均匀,很多国家和地区都处于缺硒状态。我国是一个缺硒较为严重的国家,国土面积72%地区的土壤硒元素缺乏(<0.6 mg/kg),开阳县土壤硒含量为0.12~2.43 mg/kg,均值为0.61 mg/kg,属于我国少有的富硒地之一[12]。从硒摄入量来看,我国大部分人群平均每天硒摄入量为26~32 μg,明显低于世界卫生组织制定的硒参考平均每天摄入量为40~200 μg[13-14]。从硒适量到硒中毒这个范围是比较狭窄的,成年人每日硒平均摄入量<40 μg或>400 μg均会对人体健康造成威胁[14],因此在适宜的范围内,寻找安全性较高、无毒副作用的富硒产品,来满足人体对硒元素的需求已成为一种必然趋势。
随着我国食品工业的飞速发展,功能化和营养化时代已到来,富硒产业正在蓬勃发展,富硒产品的开发方兴未艾。富硒酵母被认为是一种比无机硒更安全、更有效的硒源,常被用来作为营养强化剂[15]。目前发现的天然富硒酵母有红酵母、黏红酵母、产朊假丝酵母和酿酒酵母等,因天然的富硒酵母富硒量不高,研究人员通过优化培养基、培养条件和培养工艺等多种方法来提高酵母菌的富硒量[16]。PONCE等[17]在酿酒酵母的对数期和稳定期分别添加不同量的硒盐,其富硒量提高了20%~30%;YIN等[18]对培养基pH值、溶氧量等条件进行优化,最终酿酒酵母的富硒量达到了639 μg/g;ZHANG等[19]研究表明,酵母菌在酸的胁迫下有利于促进其对亚硒酸钠的同化和生物转化,从而使得硒在胞内富集;PANKIEWICZ等[20]研究表明,采用脉冲电场对酵母细胞进行处理,提高了酵母的耐受性或改变了酶活性,使得细胞内的硒富集量增加了65%。尽管如此,但当前各种酵母菌仍然存在富硒能力不稳定和富硒能力较低等缺陷,与工业化生产要求具有一定差距,这成为酵母富硒生产中的一个瓶颈。此外,一个酵母细胞中富集的最大硒量理论上大约为6 000 mg/kg,它与酵母细胞中的甲硫氨酸和半胱氨酸(残基)的含量有关[21],因此,要想得到高富硒酵母菌,进一步从富硒地筛选出能够在胞内积累大量硒蛋氨酸的酵母菌是很有必要的。
为了获得富硒量较高的酵母菌,本研究以开阳地区的富硒桑葚果园为分离源,通过分离筛选及酵母菌对硒的耐受性和富集能力的比较,筛选出富硒能力强的酵母菌,然后采用分子生物学研究方法对其进行鉴定,从而为富硒酵母菌在食品领域的研究开发提供理论基础和实践依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
分离样品采于开阳县某桑葚基地,随机选取1亩地的4个角及中心点5棵桑葚树,分别在每棵树的上中下处随机摘取适量桑葚果、桑葚叶,并于根部取适量的土壤,分别装于无菌密封袋,混匀,带回实验室,存放于4 ℃冰箱备用。
1.1.2 试剂
葡萄糖(分析纯),天津市永大化学试剂有限公司;酵母浸出粉、蛋白胨,上海博微生物科技有限公司;琼脂、乙二胺四乙酸二钠(ethylene diamine tetraacetic acid-2Na,EDTA-2Na),北京索莱宝科技有限公司;NaCl(分析纯),成都临江化工厂;氯霉素,生工生物工程(上海)股份有限公司;HCl、HNO3、甲苯(分析纯),重庆川东化工(集团)有限公司;HClO4(分析纯),成都金山化学试剂有限公司;3,3′-二氨基联苯胺(diaminobenzidine,DAB),上海源叶生物科技有限公司;亚硒酸钠(Na2SeO3)(分析纯),山东西亚化学股份有限公司。
1.1.3 培养基
富集培养基(g/L):葡萄糖20.0、氯霉素0.10(灭菌之后添加),pH自然。
分离纯化培养基(g/L):酵母浸出粉10.0、葡萄糖20.0、蛋白胨20.0、琼脂20.0、氯霉素0.1(灭菌之后添加),pH自然。
富硒培养基(g/L):酵母浸出粉10.0、葡萄糖20.0、蛋白胨20.0、琼脂20.0(固体加,液体不需要添加),pH自然,在无菌操作台中吸取1 000 μg/mL硒标准溶液,配制成不同硒浓度的富硒培养基。
WL营养琼脂培养基(g/L):葡萄糖50.0、酵母膏4.0、蛋白胨5.0、KH2PO40.55、KCl 0.425、 MgSO40.125、CaCl20.125、MnSO40.0025、FeCl30.002 5、溴甲酚绿0.022、琼脂20.0、氯霉素0.10,调pH值至6.5。
以上培养基均在121 ℃条件下高压灭菌20 min,备用。
1.1.4 仪器与设备
SN-CJ-IF洁净工作台、YXQ-LS-5DS11立式压力蒸汽杀菌器,上海博讯实业有限公司医疗设备厂;SPX-250B智能型生化培养箱、DHG—9140B(101-2B)智能型电热恒温鼓风干燥箱,上海琅玕实验设备有限公司;BCD-290 W冰箱,青岛海尔股份有限公司;SZ-96A自动纯水蒸馏器,上海嘉措仪器设备有限公司;ZD-2A自动电位滴定仪,上海大普仪器有限公司;DMS-653广西生物数码显微镜,深圳市博宇仪器有限公司;∑IGMA电子扫描显微镜,北京普瑞赛司仪器有限公司;722S可见分光光度计,上海菁华科技仪器有限公司;Multiskan GO全波长酶标仪,赛默飞世尔科技有限公司;2720 thermal cycler聚合酶链式反应(polymerase chain reaction,PCR)仪、3730XL测序仪,Applied Biosystems;JY300C电泳仪、JYDF电泳槽、JY04S-3C凝胶成像仪,北京君意东方电泳设备有限公司;TG16-WS台式高速离心机,湖南湘仪实验室仪器开发有限公司;VaCo 5-II-D真空冷冻干燥机,Zirbus technology GmbH Hilfe Gottes。
1.2 实验方法
1.2.1 桑果中酵母菌的分离
取10粒成熟的桑果、5片叶子、1 g土壤分别加入灭过菌的装有100 mL富集培养基的锥形瓶中,然后将锥形瓶放在28 ℃的恒温培养箱中培养1~2 d。在无菌条件下分别取上述富集过后的母液1 mL,采用无菌生理盐水按10倍梯度稀释法稀释至10-6。选择10-3~10-6稀释梯度的样品匀液,每个稀释梯度吸取200 μL均匀涂布于灭过菌的酵母膏胨葡萄糖(yeast extract peptone dextrose medium,YPD)固体培养基上,于28 ℃恒温培养箱中培养48~72 h,观察并记录菌落特征。分别挑选不同形态的单菌落,通过划线稀释法在YPD固体培养基上进行划线,然后置于28 ℃恒温培养箱中培养48~72 h,重复3~4次纯化操作,得到纯的酵母菌。
1.2.2 富硒酵母菌种子液的制备
用接种环挑取1环活化好的酵母菌接种到含有100/250 mL YPD种子液培养基的三角瓶中,在28 ℃、150 r/min的恒温摇床中培养10 h后,得到种子液。
1.2.3 富硒酵母菌的筛选
1.2.3.1 富硒酵母菌的初筛
首先将分离纯化后得到的酵母菌接种到含有20.00 μg/mL硒(按质量分数将亚硒酸钠折算成硒,后文相同)的YPD培养基上,然后通过观察酵母菌的长势及颜色,选出长势较好且颜色微红或未变红[22]的酵母菌做液体培养试验。
将上述筛选的酵母菌以5%的接种量分别接种于含有硒质量浓度为0.00、5.00、10.00、20.00、30.00、40.00、50.00 μg/mL的YPD液体培养基的试管中,在28 ℃恒温培养箱中培养48~60 h,通过观察试管底部菌体沉淀量及其颜色变化,然后经过对比筛选出富硒能力较强的酵母菌。
1.2.3.2 富硒酵母菌的复筛
将初筛得到的富硒酵母菌以5%的接种量分别接种于含有100/250 mL硒质量浓度为20.00 μg/mL的YPD液体培养基的三角瓶中,在28 ℃、150 r/min的恒温摇床中培养48 h,测其生物量及富硒量,然后计算其硒转化率,筛选获得硒转化率较高的酵母菌。
1.2.4 富硒酵母菌的初步鉴定
1.2.4.1 富硒酵母菌的个体形态特征
本研究观察菌体个体形态特征采用光学显微镜及电子扫描显微镜。光学显微镜通过载玻片法:用接种环挑取少许生长于培养基上的菌进行制片,在普通光学显微镜下进行观察并拍照[23];电镜扫描:首先在样品台上粘上导电双面胶,然后蘸少许样品于导电双面胶上,使用洗耳球将没有固定牢固的样品吹掉。由于菌体的导电性能比较差,因此,在固定好的样品上喷金来提高其导电性,使得成像清晰,最后上机观察并拍照[24]。
1.2.4.2 富硒酵母菌的培养特征
固体培养特征:采用划线法将活化好的菌种接种于含有YPD固体培养基的平板上,然后置于28 ℃恒温培养箱中培养2~3 d,最后观察菌株的生长状况并进行记录,主要从菌落表面特征、菌落颜色及菌落边缘形状等特征入手。
液体培养特征:将活化好的种子液按5%的接种量接种于含有100/250mL YPD液体培养基的三角瓶中,在28 ℃条件下培养2~3 d,观察并记录试验现象。液体培养特征:培养基表面是否出现菌膜或菌璞,底部有无沉淀,培养基是否浑浊等。
1.2.4.3 WL营养琼脂培养基鉴定
WL营养琼脂培养基对于大多数典型的酵母菌可以进行区分,利用它可以对酵母菌进行初步鉴定。将保藏的菌株活化3代后,在营养琼脂培养基上进行划线接种,于28 ℃下培养5 d后,观察并记录菌落的颜色及形态,根据菌落的颜色和形态对酵母菌进行初步鉴定。
1.2.5 分子生物学鉴定
1.2.5.1 DNA的提取
按照DP336试剂盒说明书提取。
1.1.5.2 PCR扩增
以提取的酵母菌的DNA作为模板,26S rDNA序列扩增采用的正向扩增引物为NL1(GCATATCAATAAGCGGAGGAAAAG);反向扩增引物为NL4(GGTCCGTGTTTCAAGACGG)。反应体系(50 μL)为2×Es Taq Master Mix 25 μL,RNase-Free Water 22 μL,Forward Primer(20 μmol/L)1.0 μL,Reverse Primer(20 μmol/L)1.0 μL,Template DNA 1 μL。反应条件为95 ℃预变性10 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,循环30次,72 ℃终延伸7 min。PCR产物进行琼脂糖凝胶电泳,DL2000 DNA Marker作为参照标准,凝胶成像仪观察并记录结果。
1.2.5.3 菌株系统进化分析
将大小合适及条带清晰的PCR扩增产物在平台进行测序,将所得到的序列在NCBI数据库中用BLAST与己知序列进行同源性比较分析,然后利用软件MEGA 5.0构建系统发育树。
1.2.6 硒含量的测定[25]
1.2.6.1 标准曲线的绘制
吸取10 μg/mL的硒标准液0.00、2.00、4.00、6.00、8.00、10.00 mL分别移到100 mL的烧杯中,加蒸馏水至35.00 mL,然后加入1.00 mL 5%(质量分数)的EDTA-2Na溶液,摇匀,并用HCl(体积比为1∶1)调节pH值至2.5左右,再加4.00 mL 0.5%(体积分数)的DBA溶液,振荡摇匀,置于黑暗处静置30 min。然后用质量分数为5%的NaOH溶液调pH值至6.5~7.0,倒入到分液漏斗中,加10.00 mL的甲苯用力振荡2 min,使甲苯充分萃取无机硒,静置分层,弃水层,甲苯层过滤,收集滤液,用全波长酶标仪测定甲苯层在420 nm处的吸光值,每组做3次平行,并进行重复试验,取平均值,以横坐标为浓度,纵坐标为吸光值绘制标准曲线。
1.2.6.2 酵母硒的测定
消化:准确称取0.100 0 g酵母粉置于烧杯中,并放入几粒沸石,加入5.00 mL混合消化液[V(浓HNO3)∶V(HClO4)=4∶1]),先放置一晚上进行冷消化处理,次日在电热炉上进行加热消化,在加热过程中,刚开始消化瓶内冒大量的白烟,溶液由深棕色变为淡黄色,继续加热,待淡黄色烟雾散尽后,溶液变为无色,继续冒白烟,待溶液只剩下1 mL左右接近蒸干时,可以看见有类似于白色晶体的物质析出,此时取下消化瓶,视为消化完全,等消化瓶自然冷却后,定容至50 mL。为了减少酸中一些微量杂质对结果的干扰,同时做空白对照。
测定:取10.00 mL样液,放入100 mL烧杯中,加水至35 mL,后续步骤同标曲的绘制。根据样品测得的吸光值,在标准曲线中查找相对应的无机硒含量,每组重复3次,取平均值,此为酵母硒。其中总硒含量为培养基中所添加的量,硒转化率计算如公式(1)所示:
(1)
(2)
式中:QR,酵母硒的富硒量,μg/g;A,吸光度;a,硒标曲的斜率;b,硒标曲的截距;V0,酵母粉消化后定容的体积,mL;V1,测定时吸取样液的体积,mL;10,将0.100 0 g算换成1 g;η,硒的转化率;m,酵母菌的生物量,g;Q0,发酵液硒的初始质量,μg。
1.2.7 酵母菌的生物量测定
菌体生物量的测定采用干重法。具体方法为取清洗干净的50 mL离心管6个,然后吸取混匀的酵母菌液50 mL,分别加入离心管内,并利用以8 000 r/min离心10 min,舍弃上层清液,用蒸馏水洗涤沉淀并合并,再次离心,舍弃上层清液,重复洗涤3次,然后放入-80 ℃的冰箱预冻24 h,再用真空冷冻干燥机冻干,将冻干得到的菌粉用分析天平称量,即为酵母菌的生物量。
1.3 数据分析
各实验组数据进行3次测定,数据均采用平均值的形式表示,图的绘制采用Origin 8.6软件。
2 结果与分析
2.1 富硒酵母菌的初筛
通过涂布法,结合菌落特征,采用划线方法,共分离纯化得到75株酵母菌。将分离纯化得到的75株酵母菌,通过划线法接种到含有20.0 μg/mL硒的YPD培养基上,根据酵母菌的长势及颜色,共选出12株长势较好且颜色粉红或未变红的酵母菌,分别命名为ST1、ST2、SG1、SG2、SG3、SG4、SG5、SG6、SG7、SG8、SY1、SY2。
将12株酵母菌分别以5%的接种量接种到含不同硒质量浓度(0.00、5.00、10.00、20.00、30.00、40.00、50.00 μg/mL)的YPD培养基的试管中,28 ℃恒温培养48 h,比较同一菌株在含有不同硒浓度YPD培养基的试管中底部的菌体沉淀量及颜色的变化,结果如表1、表2所示。
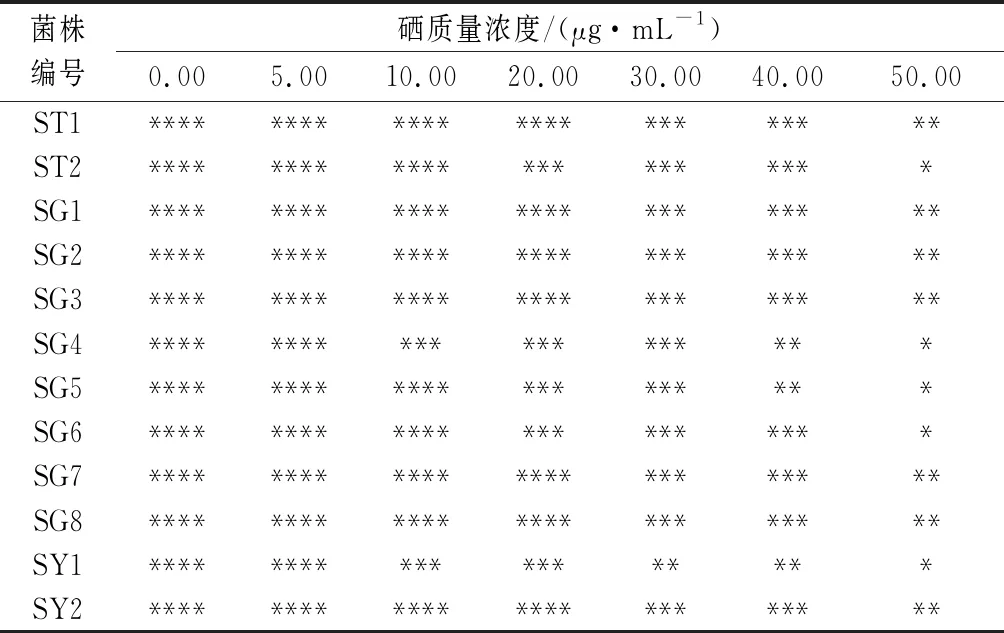
表1 不同酵母菌在富硒培养液中的菌体沉淀量Table 1 The amount of yeasts precipitated by different yeasts in selenium-rich medium
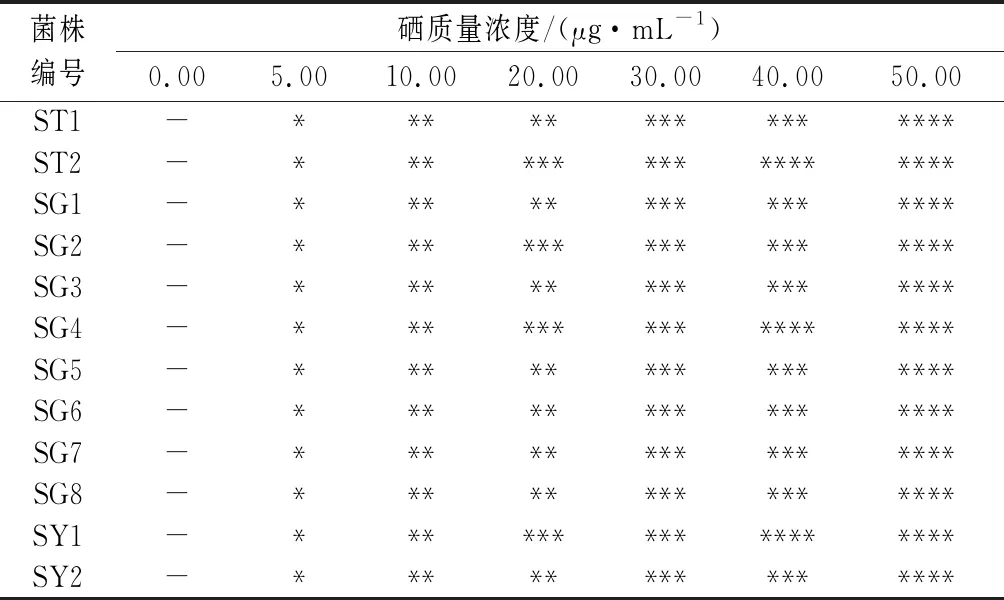
表2 不同酵母菌在富硒培养液中的颜色比较Table 2 Color comparison of different yeasts in selenium-rich medium
目前,对富硒微生物筛选的常用方法可分为耐硒法和红硒法2大类,耐硒法是基于微生物对无机硒的抗性与其对无机硒的生物转化能力呈正相关,红硒法是基于微生物对硒的生物转化能力与红硒的形成呈负相关[26-27],该方法常用于富硒微生物的筛选。由表1可知,随着硒浓度的增加,各酵母菌培养液菌体的沉淀量逐渐减少,当硒质量浓度为20.00 μg/mL时,菌株ST1、SG1、SG2、SG3、SG7、SG8和SY2的培养液菌体沉淀量变化相对较小,表明菌株ST1、SG1、SG2、SG3、SG7、SG8和SY2对无机硒亚硒酸钠的耐受性较强。由表2可知,随着硒浓度的增加,各酵母菌培养液菌体的颜色逐渐加深,当硒质量浓度为20.00 μg/mL时,菌株ST1、SG1、SG3、SG5、SG6、SG7、SG8和SY2的菌体为粉红色,而其他菌株菌体的颜色为红色,表明菌株ST1、SG1、SG3、SG5、SG6、SG7、SG8和SY2对亚硒酸钠的转化能力强。结合耐硒法和红硒法,最终选择ST1、SG1、SG3、SG7、SG8和SY2作为后续试验菌株。
2.2 富硒酵母菌的复筛
2.2.1 硒标准曲线的绘制
2.2.1.1 检测波长的确定
将配制的硒标准系列溶液在300~800 nm内采用全波长酶标仪(Multiskan GO)进行扫描,结果如图1所示,在420 nm处有最大吸收值,故选用420 nm为测定波长。

图1 硒与3,3′-二氨基联苯胺络合物的紫外可见光谱图Fig.1 Uv-visible spectrogram of selenium complex with 3,3′-diaminobenzidine
2.2.1.2 硒标准曲线
将配制的硒标准系列溶液,采用全波长酶标仪测其420 nm处的吸光值,然后以吸光值为纵坐标,硒浓度为横坐标绘制标准曲线(图2)。其回归方程为y=0.004 61x-0.005 82,R2=0.999 23,表明硒质量浓度在0~100 μg/mL线性良好。
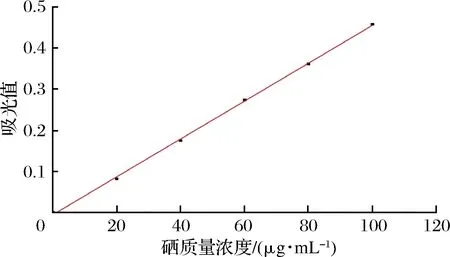
图2 硒标准曲线Fig.2 Selenium standard curve
2.2.2 酵母菌富硒能力比较
将初筛得到的酵母菌分别以5%的接种量接种到含有20.00 μg/mL硒的培养基中,恒温摇床(28 ℃)培养48 h后测其生物量、富硒量和硒的转化率,结果如图3所示。在20.00 μg/mL硒质量浓度酵母菌对硒的富集能力不一样,其中酵母菌ST1、SG1、SG3、SG7、SG8、SY2的硒含量分别为1 998.62、1 969.04、1 857.30、1 965.09、1 717.42、2 278.35 μg/g,生物量分别为3.88、4.07、4.07、3.88、4.28、4.31 g/L,硒转化率分别为38.76%、40.02%、37.82%、38.08%、36.72%、49.11%。从而得出酵母菌SY2对亚硒酸钠的转化率最高,因此,选用SY2进行后续实验。

图3 酵母菌SY2对亚硒酸钠的转化率Fig.3 The conversion rate of yeast SY2 to sodium selenite
2.3 富硒酵母菌的初步鉴定
2.3.1 富硒酵母菌的个体形态特征
将活化好的种子液按5%的接种量接种于含有100/250 mL不同硒浓度的YPD液体培养基的三角瓶中,在28 ℃条件下培养2~3 d。然后制作载玻片,进行显微镜观察,同时进行电镜扫描,结果如图4所示,酵母菌呈椭球形,出芽生殖,随着硒浓度的增加,细胞大小和形态受到一定的抑制。当硒质量浓度为0.00 μg/mL时,细胞平均大小为3.56×4.3 μm,硒质量浓度为10.00 μg/mL时,细胞平均大小为3.36×4.13 μm,硒质量浓度为20.00 μg/mL时,细胞平均大小为3.22×3.95 μm,硒质量浓度为40.00 μg/mL时,细胞平均大小为3.08×3.78 μm。当硒质量浓度为40.00 μg/mL 时,部分细胞形态明显发生形变。

a-0.00 μg/mL;b-10.00 μg/mL;c-20.00 μg/mL;d-40.00 μg/mL图4 酵母菌SY2的个体形态特征Fig.4 Individual morphological characteristics of yeast SY2
2.3.2 富硒酵母菌的培养特征
将活化好的菌种划线接种于不同硒浓度的YPD固体培养基上,同时将活化好的种子液按5%的接种量接种于含有100/250 mL不同硒浓度的YPD液体培养基的三角瓶中,在28 ℃条件下培养2~3 d,结果如图5所示,酵母菌株SY2菌落表面光滑、反光,奶酪状,乳白色,边缘平滑。液体培养基表面无菌膜或菌璞,底部有沉淀,培养基浑浊。随着硒浓度的增加,菌落逐渐变小,颜色越来越深。同样,液体培养过程中,随着硒浓度的增加,培养液的颜色越来越红。
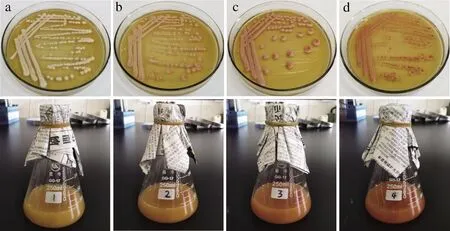
a-0.00 μg/mL;b-10.00 μg/mL;c-20.00 μg/mL;d-40.00 μg/mL图5 酵母菌SY2的培养特征Fig.5 Culture characteristics of yeast SY2
2.3.3 富硒酵母菌的培养特征
将酵母菌株SY2接种到WL营养琼脂培养基上,于28 ℃恒温培养箱中培养5 d后,其菌落形态如图6所示,菌落颜色为奶油色带绿色,球形凸起,表面光滑,不透明,奶油状,根据相应酵母菌在WL营养琼脂培养基上的菌落特征,初步鉴定其为酿酒酵母菌(Saccharomycescerevisiae)。

图6 酵母菌SY2在WL营养琼脂培养基上的菌落形态Fig.6 Colony morphology of yeast SY2 on WL nutrient agar medium
2.4 富硒酵母菌的分子生物学鉴定结果
利用NL1和NL4一对引物扩增酵母菌SY2的26S rDNA近5′端的D1/D2区域,产物在1%(质量分数)琼脂糖凝胶,PCR电泳图谱如图7所示,得到约600 bp的片段,清晰可见,无杂带,可用于26S rDNA测序。将测序结果输入到NCBI数据库BLAST中,与己知序列进行同源性比较分析,结果如表3所示,然后利用MEGA 5.0软件构建系统发育树(图8)。

M-DL2000 Marker图7 富硒酵母菌SY2 26S rDNA序列PCR扩增电泳Fig.7 Electropherogram of PCR amplification products of 26S rDNA sequence from selenium-enriched yeast SY2
由表3可知,筛选得到的酵母菌株SY2与酿酒酵母菌(S.cerevisiae)的相似度为100%,即可鉴定其为酿酒酵母菌(S.cerevisiae),这与WL培养基初步鉴定结果一致,也进一步说明WL培养基初步鉴定结果较为准确。由图8可知,酿酒酵母菌SY2与菌株S.cerevisiae(JN867135.1)及S.cerevisiae(LC334458.1)聚在一起。

表3 酵母菌SY2与相关菌株的相似性Table 3 Similarities between yeast SY2 and related strains

图8 富硒酵母菌株SY2系统发育树Fig.8 The phylogenetic tree of Selenium-enriched yeast SY2
3 结论
本研究从开阳地区的富硒桑葚果园中分离纯化得到75株酵母菌,采用平板划线及液体培养,根据耐硒法和红硒法进行初筛,得到6株富硒能力较好的酵母菌,然后通过硒转化率进行复筛,得到1株硒转化率较高的酵母菌,编号为SY2,其富硒量为2 278.35 μg/g,生物量为4.31 g/L,硒转化率为49.11%,最后通过形态观察、WL培养基鉴别及26S rDNA测序分析,鉴定菌株SY2为酿酒酵母菌(S.cerevisiae)。
关于酵母菌的富硒研究,此前已有较多报道,比如陈妍等[28]研究表明,啤酒酵母(酿酒酵母)(S.cerevisiae)对硒的富集能力为932 μg/g,生物量为8.59 g/L;邹艳等[29]研究表明,产朊假丝酵母(Candidautilis)对硒的富集能力为1 575 μg/g,生物量为5.86 g/L;蔡飞等[30]研究表明,库德毕赤酵母(Pichiakudriavzevii)对硒的富集能力为862 μg/g,生物量为9.63 g/L。本研究筛选得到酿酒酵母菌(S.cerevisiae)具有较高的富硒量及转化率。后续可将该富硒酵母菌应用于桑葚果酒及其他产品的生产,这对于促进桑葚资源的综合利用,丰富富硒产品的多元化开发,推动开阳县富硒产业的不断发展都将具有积极意义。

