γ-聚谷氨酸/壳聚糖纳米颗粒的制备及pH 响应释放性能
任东雪, 陈鹏程, 郑 璞, 徐志南, 卢 松
(1. 江南大学生物工程学院,江苏 无锡 214122;2. 浙江大学化学与生物工程学院,杭州 310027;3. 内蒙古阜丰生物科技有限公司,呼和浩特 010030)
一个有效的药物传递系统[1-3]通常可以将一种治疗物质引入体内,通过控制药物在体内释放的速率、时间和位置来提高其有效性和安全性,并避免不良反应。近年来,高分子纳米药物载体(如脂质体、胶束[4,5]、药物前体[6]、水凝胶[7,8]等)被广泛用于药物传递系统。Wang 等[9]利用L-苹果酸和D/L-乳酸的直接缩聚反应制备pH 响应性载体用于包载阿霉素;徐杰等[10]将黄原胶以胱胺四酰肼为交联剂进行酰胺化制备pH 还原响应性微凝胶用于抗癌药物的输送;Kim 等[11]利用亲水的丙烯酸与4-2-乙烯基苄氧基-N-N-二乙基烟酰胺进行聚合反应,所得产物可包载不溶于水的药物紫杉醇用于口服给药体系。虽然这些系统都可以定向传送药物,但其制备过程复杂,且涉及使用有机溶剂,副产物较多,需多次除杂,在生物体内难以降解,影响了其应用。
随着绿色经济的发展,基于可生物降解的聚合物引起了人们广泛的兴趣,其中聚氨基酸和多糖类物质等作为药物载体在生物相容性等方面显示出更大的优势。γ-聚谷氨酸(γ-PGA)[11]是一种细胞亲和性良好、无毒无害、易降解的天然阴离子聚合物材料,壳聚糖(CS)[12]是一种源自几丁质脱乙酰化的多糖类聚阳离子聚合物。Hong 等[13]利用γ-PGA 的羧基与CS 的氨基之间的静电相互作用制备了纳米颗粒用于提高叶黄素的溶解性;Meng 等[14]将带负电荷的阴离子聚合物γ-PGA 与带正电荷的药物匹杉琼通过静电作用自组装,用于药物的口服化疗。虽然γ-PGA/CS 复合聚电解质纳米体系在提高药物水溶性和定向传送方面取得了良好的效果,但针对该系统表面电荷对其释药性能等方面的影响尚无详细的研究。
为了拓展γ-PGA/CS 作为药物载体的应用范围,本文利用γ-PGA 与CS 之间温和的静电作用力,自组装制备纳米载体用于包载药物分子阿莫西林(A),并对两种表面分别带正、负电荷的载药纳米颗粒(γ-PGA-CSA(+)、(-))在pH 响应控释药物、抗蛋白污染、细胞毒性及其对肠道致病菌的抑制效果等方面进行了详细的研究。结果表明:表面带负电荷的纳米载体较带正电荷的纳米载体表现出较为优越的应用潜力,并且纳米载体制备工艺简单、绿色环保,在口服药物载体方面具有应用价值。
1 实验部分
1.1 原料和试剂
γ-PGA:Mw= 1×106,由实验室枯草芽孢杆菌HB-1 发酵制备[15];CS:Mw= 6×105,脱乙酰度90%,上海源叶生物科技有限公司;阿莫西林、牛血清蛋白(BSA)、二甲基亚砜(DMSO)和透析袋(分子排阻孔径为1.4×104):上海一飞生物科技有限公司;细胞培养基(DMEM)和3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT):Sigma-Aldrich 公司;小鼠胚胎成纤维细胞(NIH/3T3):中科院研究所;革兰氏阳性菌金黄色葡萄球菌(Staphylococcus aureus,型号ATCC 29213)和革兰氏阴性菌大肠杆菌(Escherichia coli,型号ATCC 8739):NTCC 质粒菌种基因库。
1.2 载药纳米颗粒的合成
在室温搅拌(600 r/min)下,将10 mL、2 g/L 的γ-PGA 用微量注射泵按照6 mL/h 的速率分别滴加到0.2 g/L和1.0 g/L 的CS 醋酸缓冲液(50 mL,pH=2.5)中,继续搅拌12 h,透析除去未结合的小分子聚合物,即得到表面分别带正、负电荷的纳米载体(γ-PGA-CS(+)、(-))。之后将5 mL 阿莫西林水溶液(2 g/L)按照10 mL/h 的速率注入γ-PGA-CS 纳米载体中,搅拌过夜,反应液转移至透析袋中,用10 mmol/L 柠檬酸缓冲液(pH=2.5)透析以除去未结合的游离药物分子,间隔1 h 换缓冲液,直至透析袋外溶液中检测不到药物的紫外吸收[16],将透析袋内的溶液冷冻干燥后,得到载药纳米颗粒γ-PGA-CS-A。
1.3 表征
采用美国尼高力仪器公司NEXUS 傅里叶红外光谱(FT-IR)仪测定聚合物和纳米颗粒的特征吸收峰,扫描波长为4 500~500 cm-1;使用德国布鲁克AXS 有限公司D8 X 射线衍射(XRD)仪进行(XRD)扫描,工作电压和电流设定为35 kV 和40 mA,2θ 为5°~60°;用美国布鲁克海文仪器公司ZetaPALS 纳米粒径仪检测其在不同pH 下载药纳米颗粒的粒径、电位和粒径多分散指数,测试温度为25 ℃;采用日本日立株式会社的H-7650透射电子显微镜(TEM)观察载药纳米颗粒在不同pH 下的粒径大小和形态。
1.4 性能测试
1.4.1 体外药物释放实验 载药纳米颗粒γ-PGA-CS-A 的体外释放实验在体外模拟消化道缓冲液中进行,包括pH 为2.5、6.5 的柠檬酸缓冲液(25 mmol/L)和pH 为7.4 的磷酸钠缓冲液(25 mmol/L)。将10 mL 载药纳米颗粒水溶液置于透析袋,浸没于40 mL 上述缓冲液中开始透析(37 ℃,120 r/min),间隔2~4 h 取4 mL 透析液,与此同时添加相同体积缓冲液使得释放介质总体积不变,样品稀释2~5 倍后于272 nm 处测定其吸光度(A272),根据样品吸光度计算药物质量浓度,利用式(1)计算阿莫西林在不同时间点的累积释放率(Rc),每个样品设3 个平行对照。

其中:V0为释放缓冲液的总体积,40 mL; ρi为第i 次取样中阿莫西林的质量浓度(mg/L);V 为每次取样的体积,4 mL;m 为透析袋内的药物总质量。
1.4.2 抗蛋白吸附性能 用1 mol/L 盐酸溶液和1 mol/L NaOH 溶液调节γ-PGA-CS 的pH 分别至 7.4,6.5 和2.5,取10 mL 不同pH 下的纳米颗粒溶液,与10 mL 牛血清蛋白溶液(0.5 g/L)混合,置于37 ℃、110 r/min 摇床反应,间隔24 h,取出1 mL 混合溶液,1.2×104r/min 速率下离心10 min,取其上清液,稀释3~8 倍,用考马斯亮蓝法[17]测定未吸附蛋白的质量分数,使用式(2)计算载药纳米颗粒的蛋白吸附率(Ap)。

其中:ma和mb是指吸附在纳米颗粒上的蛋白质量和反应溶液中的总蛋白质量。
1.4.3 细胞毒性研究 收集对数期小鼠胚胎成纤维细胞,调整细胞悬液浓度,每孔按照104个细胞铺板,每孔200 μL 培养液,CO2体积分数为5%,37 ℃孵育,至细胞单层铺满孔底(96 孔平底板)。加入50 μL 不同质量浓度的载药纳米颗粒、游离药物和空白药物载体溶液,每个质量浓度设置3 个对照,同时设置不加药物的阴性对照组,不加细胞的作为空白对照组,CO2体积分数为5% ,37 ℃孵育48 h,倒置显微镜下观察细胞形态。待细胞完全贴壁后,采用MTT 法[18]测定细胞存活率。每孔加入20 μL MTT 溶液(5 mg/mL),置于培养箱中再培养4 h,之后去除孔内培养液。然后每孔加入150 μL DMSO,置于脱色摇床上低速振荡10 min,使蓝紫色结晶物充分溶解于DMSO,待其变为澄清溶液时,置于酶标仪下检测各孔在490 nm 下的吸光度(A),按照式(3)计算细胞存活率(VC)。

其中:AC,AB,AE分别代表实验组、空白对照组和阴性对照组在490 nm 处的吸光度。
1.4.4 模拟体内抑菌研究 将相同药物浓度的游离药物和载药纳米颗粒溶液置于pH=2.5 的模拟胃酸缓冲液中,在120 r/min 透析2 h,然后将其置于600 nm 下吸光度为0.4 的大肠杆菌ATCC 8739 和金黄色葡萄球菌ATCC 29213 生长培养基中,同时设置不加药的阴性对照组,于37 ℃、110 r/min 震荡培养约12 h,取菌液稀释涂布固体LB 平板,按照式(4)计算致死率(K)[19]。每个样品设3 个平行对照,取其平均值作为最终实验结果。

其中:NE,NC分别代表阴性对照组和实验组的菌落数。
2 结果和讨论
2.1 载药纳米颗粒的制备
γ-PGA 含有丰富的游离羧基,CS 则含有大量游离氨基,氨基和羧基之间存在强烈的静电吸引力使γ-PGA 和CS 结合在一起,形成不同大小的颗粒,具体的粒径、电位和分散指数(PDI)如表1 所示。当羧基与氨基的物质的量之比分别为1∶2 和2∶1 时,纳米颗粒粒径保持在200 nm 左右,分散指数较小,分散性良好。其原因在于氨基和羧基通过静电吸引使其内部结构稳定,过量的氨基或者羧基分布在纳米颗粒外部相互排斥,使其分散性良好。当纳米颗粒中氨基的摩尔分数高于羧基的相应值时,CS 包裹在γ-PGA 表面,使得纳米颗粒表面带正电荷,而羧基过量时使纳米颗粒表面带负电荷。因此,选用羧基与氨基的物质的量之比为1∶2 或2∶1 的两种纳米载体包载药物阿莫西林,制备表面分别带正、负电荷的载药纳米颗粒γ-PGA-CS-A。

表 1 羧基和氨基的物质的量之比对纳米颗粒的粒径、电位和分散指数的影响Table 1 Effects of the ratio of carboxyl group to amino group on the particle size, Zeta potential and PDI of nanoparticles
2.2 载药纳米颗粒的表征
2.2.1 粒径大小 γ-PGA-CS-A(+)和γ-PGA-CS-A(-)两种载药纳米颗粒在不同pH 下的粒径、电位和PDI 结果(图1)显示,纳米颗粒的粒径大小和PDI 随pH 变化呈现一致的规律,均表现为在酸性条件下粒径较小,PDI 较低,颗粒之间分散性良好;随着pH 的升高,其粒径逐渐增大,PDI 随之增大。推测其原因在于CS 的氨基在pH 为2.5~5.0 时质子化后带正电荷,γ-PGA 的羧基去质子化后带负电荷,CS 质子化的氨基和γ-PGA 去质子化的羧基通过静电作用络合,两者之间的静电吸引作用使其结构紧凑,粒径较小;当pH 逐渐增大,CS 的氨基逐渐去质子化不带电,与γ-PGA 的羧基之间的静电作用减小,导致纳米颗粒内部结构不稳定以至膨胀裂解,粒径增大。γ-PGA-CS-A(+)中CS 摩尔分数高,使其表面在pH 为2~7 时均带正电荷,而γ-PGA 摩尔分数高的γ-PGA-CS-A(-)在强酸条件下带正电荷,随着pH 的升高,γ-PGA 羧基去质子化而带负电荷,因此其在pH 为4~7 时发生电荷反转,表面带负电荷。为了进一步验证γ-PGA-CS-A 的粒径大小随pH 变化的规律,对pH 为2.5、6.5 和7.4 下的载药纳米颗粒进行TEM 表征,结果如图2 所示。当pH=2.5 时,γ-PGA-CS-A 的粒径为200 nm 左右;当pH=6.5 时,粒径增加到500 nm 左右;当pH=7.4 时,粒径增大到0.7~1.2 μm,进一步验证了DLS 的测定结果,γ-PGA-CS-A 的粒径随pH 的升高而逐渐增大。

图 1 γ-PGA-CS-A 的粒径、电位和分散指数Fig. 1 Mean particle size, Zeta potentials and PDI of γ-PGA-CS-A
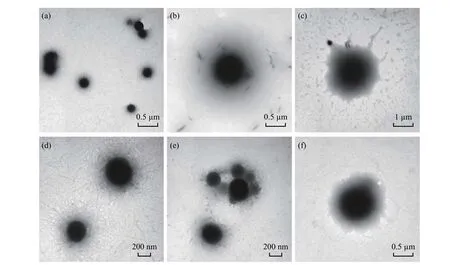
图 2 γ-PGA-CS-A(+)在pH 为2.5(a),6.5(b)和7.4(c),γ-PGA-CS-A(-)在pH 为2.5(d),6.5(e)和7.4(f)下的透射电镜图Fig. 2 TEM images of γ-PGA-CS-A (+) at pH values of 2.5 (a), 6.5 (b) and 7.4 (c), γ-PGA-CS-A (-) at pH values of 2.5 (d), 6.5 (e) and 7.4 (f)

图 3 γ-PGA,CS 和γ-PGA-CS(a)以及阿莫西林和γ-PGA-CS-A(b) 的红外谱图Fig. 3 FT-IR spectra of γ-PGA, CS and γ-PGA-CS (a), amoxicillin and γ-PGA-CS-A (b)
2.2.2 红外和XRD 样品的红外表征结果如图3 所示。CS 的―NH3+在1 658 cm-1处有振动吸收峰,γ-PGA COO-的― 在1 665 cm-1处出现吸收峰,纳米颗粒γ-PGA-CS(+)在1 689 cm-1和1 626 cm-1处都出现吸收峰,γ-PGA-CS(-)在1 705 cm-1和1 603 cm-1处出现吸收峰,说明γ-PGA 的羧基和CS 的氨基通过静电作用实现了交联。纳米颗粒载药后,载体原有的氨基和羧基吸收峰依旧存在,但是吸收峰面积发生变化,说明药物的整合改变了载体原有的吸收峰强度。同时,2 400~3 700 cm-1处氢键峰变宽,说明药物和载体之间存在强大的氢键作用力,正是这种作用力使得药物被成功包载。XRD 谱图(图4)中CS 在 12.5°和21.0°出现乙酰胺和氨基的结晶峰,γ-PGA 由于其螺旋结构在24.0°出现宽而长的反射带,两种纳米颗粒的XRD 谱图中,CS 的结晶峰消失。推测其原因是CS 的天然晶体通过与γ-PGA 相互静电作用而转化为无定形构象的纳米颗粒γ-PGA-CS。阿莫西林在10°~50°出现一些复杂的晶体衍射峰,载药后的纳米颗粒只出现2 个不同于载体和药物的衍射峰,推测其原因是药物与载体的整合使药物原来的晶体结构发生变化,同时也意味着载体成功地负载了药物。
2.3 酸性条件下的稳定性研究
由载药纳米颗粒在pH=2.5 胃酸环境下的稳定性(图5)可知,两种载药纳米颗粒均可在100 h 内保持较小的粒径和良好的分散性,说明其可以保持稳定的内部结构去抵抗胃酸的破坏。
2.4 体外释放研究

图 4 γ-PGA,CS 和γ-PGA-CS(a)以及阿莫西林和γ-PGA-CS-A(b)的XRD 谱图Fig. 4 XRD spectra of γ-PGA, CS and γ-PGA-CS (a), amoxicillin and γ-PGA-CS-A (b)
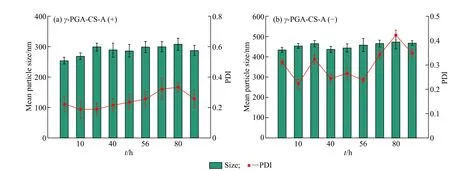
图 5 γ-PGA-CS-A 在pH = 2.5 下的稳定性Fig. 5 Stability of γ-PGA-CS-A at pH = 2.5
为了研究载药纳米颗粒作为口服药物的潜在应用,测定了其在不同pH 下的体外释放(图6)。结果显示载药纳米颗粒释放行为取决于缓冲液的pH。在不同pH 下,阿莫西林在初始释放阶段的累积释放率存在显著差异,当pH=2.5 时,γ-PGA-CS-A(+)的释放量为50%,随着pH 升高到6.5,释放量提高到60%左右,而当pH=7.4 时,前5 h 释放量较大(约60%),之后缓慢释放,最终在25 h 累积释放率达到95%(图6(a)),接近完全释放。γ-PGA-CS-A(-)较γ-PGA-CS-A(+)具有更加良好的pH 响应能力,在酸性条件下,前5 h 左右仅释放25%,随着时间的延长,γ-PGA-CS-A(-)保持稳定不再释放药物,当pH=6.5 时呈现相似的规律。当pH=7.4 时,在前期释放60%之后,在之后的20 h 左右缓慢释放,最终释放量达到85%(图6(b)),其原因在于γ-PGA-CSA(-)中γ-PGA 含量较高,其游离羧基与带正电荷的阿莫西林之间的静电吸引作用使得药物释放量较低,而γ-PGA-CS-A(+)表面带正电荷,和药物分子之间存在静电排斥作用,造成释放量较高。上述结果表明带正、负电荷的两种纳米颗粒都具备良好的pH 响应释放能力,酸性条件下,氨基和羧基之间的强大静电作用使纳米颗粒内部结构稳定,可以包载较多的药物,释放量较低;而在中性或弱碱性条件下,静电作用被破坏,纳米颗粒迅速解组装,从而较快地释放出大量的药物。模拟口服给药后pH 的变化过程,载药纳米颗粒首先在胃酸环境中保持稳定,迅速调节pH 至肠道的弱酸性环境,药物开始逐渐释放,之后调节缓冲液pH 至肠道细胞间隙的弱碱性环境,药物开始大量释放(图6(c~d))。由pH 引发的释放特性表明,两种纳米颗粒适合口服给药的传送体系。
2.5 抗蛋白吸附研究
为了检测载药纳米颗粒抗杂蛋白吸附的能力,测定了在pH 为2.5、6.5、7.4 的条件下载药纳米颗粒对BSA 的吸附能力(图7)。结果显示,当pH=2.5 时,两种载药纳米颗粒的蛋白吸附率均接近零,原因在于酸性条件下两种载药纳米颗粒都带正电荷,BSA 也带正电荷,两者相互排斥,使蛋白吸附率接近零(图7)。当pH 大于牛血清蛋白等电点4.7 时,蛋白带负电荷,与γ-PGA-CS-A(+)之间存在静电吸引作用,使得蛋白吸附率增加,当pH=7.4 时达到25%,这是因为随着pH 的增大,γ-PGA-CS-A(+)粒径逐渐增大,同时蛋白与γ-PGACS-A(+)之间的静电吸引力使其蛋白吸附率增加,这有利于载药纳米颗粒在肠道环境下与细胞膜的结合。当pH=6.5 和pH=7.4 时,γ-PGA-CS-A(-)的蛋白吸附率均保持在10%以下,这是由于其在弱酸和中性条件下表面带负电荷,与带负电荷的BSA 相互排斥,造成蛋白吸附率较低。因此,两种载药纳米颗粒都可以在胃酸条件下抗杂蛋白的吸附,而在肠道环境下,粒径增大,无论是吸附还是不吸附蛋白,纳米颗粒都会释放药物,所以两种纳米颗粒都具备良好的生物相容性。

图 6 γ-PGA-CS-A(+)(a)和γ-PGA-CS-A(-)(b)在不同pH 中的体外释放曲线;γ-PGA-CS-A(+)(c)和γ-PGA-CS-A(-)(d) 在模拟消化道中的体外释放曲线Fig. 6 In vitro release curves of γ-PGA-CS-A (+) (a) and γ-PGA-CS-A (-) (b) at different pH values; In vitro release curves of γ-PGA-CS-A(+) (c) and γ-PGA-CS-A (-) (d) in the simulated digestive tract

图 7 γ-PGA-CS-A 的蛋白吸附率Fig. 7 BSA adsorbed by γ-PGA-CS-A
2.6 细胞毒性实验
图8 所示为不同质量浓度的载体对NIH/3T3 细胞的毒性。从图8(a)可以看出,载体质量浓度在2~200 μg/mL 对细胞生长几乎没有毒性,细胞存活率都在90%以上,进一步增加载体质量浓度到1 000 μg/mL时,带负电荷的载体对细胞的毒性明显低于带正电荷的载体,推测其原因可能在于带正电荷的载体易于和带负电荷的细胞膜结合,从而造成细胞损伤[20]。
图8(b)显示载药纳米颗粒明显减轻了游离阿莫西林对NIH/3T3 细胞的毒性,因为药物包埋于纳米颗粒内部,中和了药物中高毒性的氨基,因此在相同的药物质量浓度下,载药纳米颗粒对NIH/3T3 的毒性较小,而带负电荷的纳米颗粒相比于游离药物表现出更为明显的作用,当阿莫西林质量浓度为2.0 μg/mL 时,细胞毒性降低了20%。

图 8 空白纳米颗粒(a),游离和载药纳米颗粒(b)的体外细胞毒性Fig. 8 In vitro cytotoxicity of blank nanoparticles (a), free amoxicillin and drug-loaded nanoparticles (b)
2.7 模拟肠道抗菌研究
虽然纳米颗粒的保护壳可以明显降低药物对正常细胞的毒性,但是也会降低药效,影响抗生素阿莫西林对致病菌的抑制效果,因此需要进一步检测γ-PGA-CS-A 是否对革兰氏致病菌具有药效。当阿莫西林初始质量浓度为0.5 μg/mL 时,在酸性溶液中透析2 h 后,游离药物对革兰氏阴性菌的抑制率为70%,γ-PGA-CS-A(+)的抑制率为90%,而γ-PGA-CS-A(-)的抑制率高达100%(图9(a))。革兰氏阳性菌的抑制效果呈现相似的规律,载药纳米颗粒相比游离药物具有更好的抑制菌体生长的能力。这是因为游离药物在pH = 2.5 的缓冲液中透析时大部分药物释放到透析液中,导致透析袋中药物大量损失,而载药纳米颗粒对酸性环境有较好的耐受性,可以在酸性环境中保持稳定,减少药物的释放,使得药物损失量较小,从而在抑菌实验中有较强的抑菌能力。γ-PGA-CS-A(-)抑制菌体生长能力强于γ-PGA-CS-A(+)的原因在于γ-PGA-CS-A(-)在pH = 2.5 的缓冲液中透析时药物释放量低,药物损失量较少,因此具有更好的药效。以上结果说明两种纳米颗粒都具有作为口服药物载体的应用潜力。

图 9 载药纳米颗粒和游离药物对大肠杆菌(a)和金黄色葡萄球菌(b)的抑制作用Fig. 9 Inhibition against Escherichia. coli (a) and Staphylococcus aureus (b) with drug-loaded nanoparticles and free drug
3 结 论
(1)通过简单温和的静电作用制备了表面分别带正、负电荷的载药纳米颗粒,其粒径和表面电荷可以通过调节γ-PGA 的羧基和CS 的氨基物质的量之比来控制。
(2)γ-PGA-CS-A 的粒径随着缓冲液pH 的升高而增加,γ-PGA-CS-A(-)相比γ-PGA-CS-A(+)具备更好的pH 响应释放药物的能力,其在胃酸条件下仅释放25%,而在肠道细胞间隙(pH = 7.4)中释放85%左右。
(3)生物相容性良好的载体(γ-PGA-CS)保护壳明显降低了对正常细胞的毒性(约20%),并且提高了阿莫西林在肠道中对细菌的药效(约42%)。

