基于高密度遗传图谱定位水稻籽粒长宽比QTL
梁文化 陈涛 姚姝 赵凌 朱镇 赵庆勇 周丽慧 赵春芳 路凯 赫磊 王才林 张亚东
摘要:挖掘水稻籽粒长宽比相关的QTL可为水稻粒型的遗传机制研究提供理论基础。以特大粒水稻TD70和小粒籼稻Kasalath构建的重组自交系群体为研究材料,2019、2020年连续2年考察各株系的籽粒长宽比,利用群体重测序构建的高密度遗传图谱对控制水稻籽粒长宽比相关QTL进行分析。结果显示,在重组自交系群体中籽粒长宽比呈连续变异,有明显的超亲分离现象。2019、2020年2年共检测到11个QTLs,分别位于2、3、4、5、6、7、9号染色体上。QTL的LOD值介于3.74~31.41之间,单个QTL可解释2.48%~24.67%的表型变异,2年重复检测到的QTL位点共有4个。进一步分析发现,qLWR2-2、qLWR3-1、qLWR3-2、qLWR4、qLWR5、qLWR6-2及qLWR7共7个位点所在区间与前人的报道相同或相似。qLWR2-1、qLWR6-1、qLWR9-1和qLWR9-2可能是新发现的QTL位点。本研究结果可用于下一步QTL的克隆及分子标记辅助选择育种。
关键词:水稻;重组自交系;长宽比;QTL定位;高密度遺传图谱
中图分类号:S511.03 文献标志码: A
文章编号:1002-1302(2021)23-0047-05
收稿日期:2021-10-06
基金项目:国家自然科学基金(编号:31901485);江苏省重点研发计划(编号:BE2021301);现代农业产业技术体系建设专项(编号:CARS-01-67)。
作者简介:梁文化(1984—),男,山东临沂人,博士,助理研究员,主要从事水稻粒型基因研究。E-mail:liangwenhua0228@126.com。
通信作者:张亚东,博士,研究员,主要从事水稻遗传育种研究。E-mail:zhangyd@jaas.ac.cn。
水稻产量由粒质量、每穗粒数及穗数构成,籽粒形态决定粒质量,同时还影响稻米的外观品质和商品价值。粒型包括粒长、粒宽、粒厚和长宽比[1-3],是典型的多基因控制数量性状,目前通过遗传作图、关联分析、群体测序分析等方法鉴定水稻粒型相关的QTL已经超过500个,这些QTL分布在水稻的12条染色体上,目前已经被克隆和功能验证的超过30个[4-5]。其中,GS3[6]、qGL3[7]、GL7/GW7[8-9]、GL4[10]、GL3.3/TGW3[11-12]、GLW7[13]、GLA[14]、GS9[15]等是调控粒长的QTLs,GW2[16]、GSE5/GW5/qSW5[17-19]、GS5[20]、GW8[21]等对粒宽有调控作用,TGW6[22]和GW6a[23]是千粒质量的主效QTLs,SRS5[24]、GS2/GL2[25-26]是通过与其他基因互作调控籽粒发育的。
长宽比是水稻籽粒重要的性状之一,对稻米品质有重要的影响。目前,虽然已经对水稻粒长、粒宽和千粒质量相关QTLs展开了广泛研究,但是水稻籽粒长宽比QTL仍然没有被精细定位和克隆。遗传群体的构建对于QTL的研究至关重要,与其他分离群体不同,重组自交系群体中每个株系的基因型都是纯合的,方便多年多点试验,可挖掘出更多的遗传信息,适合进行数量性状的研究。笔者所在实验室前期以特大粒粳稻TD70和小粒籼稻Kasalath为亲本构建了重组自交系群体群体,对双亲和群体株系重测序构建了高密度遗传图谱[27]。在此基础上,本研究在不同年份分别考察双亲及群体的籽粒长宽比并进行QTL关联分析。2019—2020年2年的结果显示,共定位到11个籽粒长宽比相关的QTLs,为下一步籽粒长宽比基因的克隆、研究长宽比的遗传机制以及在水稻育种中研究和利用提供了理论依据。
1 材料与方法
1.1 供试材料
特大粒粳稻TD70是天鹅谷///9520//(72-496/苏御糯)杂交后代选出的稳定品系,以TD70与印度小粒籼稻品种Kasalath为亲本,杂交产生F1代,F1代自交获得F2代,进一步通过单籽传法构建TD70/Kasalath的重组自交系群体,连续自交至F14代,最终获得包含186个株系的重组自交系群体[28]。2019、2020年在江苏省农业科学院试验田种植重组自交系群体及2个亲本,每个株系种植4行,每行8 株,行距为26.7 cm,株距为16.7 cm,田间管理与大田相同。
1.2 性状调查
成熟时每个小区随机选取5株混合收种,自然晾干保存。从亲本及每个重组自交系株系中随机挑选10粒饱满种子,用游标卡尺(精度0.01 mm)测量粒长、粒宽,根据粒长和粒宽计算稻谷的长宽比,重复3次,以平均值作为性状的表型值。
1.3 QTLs定位
前期利用重测序技术对重组自交系群体186个株系及2个亲本分别进行全基因组重测序,参考Huang等的方法构建高密度的Bin-map[29]。该图谱包含12 328个Bin 标记,平均每条染色体上有1 027 个,相邻Bin标记间的物理距离平均为 30.26 kb[27]。采用软件IciMapping Ver 4.2.53中的ICIM-ADD算法对2019、2020年重组自交系群体长宽比表型分别进行QTL定位。作图设定PIN为0.001,步长为1 cM,LOD阈值设定为3.0[30]。以LOD峰值作为该QTL 的LOD值,并计算每个QTL对水稻籽粒长宽比的贡献率和加性效应,遵循McCouch的方法等原则对QTL进行命名[31]。采用Mapchart V2.32软件绘制QTL在染色体上的位置分布[32]。
2 结果与分析
2.1 亲本及重组自交系群体籽粒的长宽比
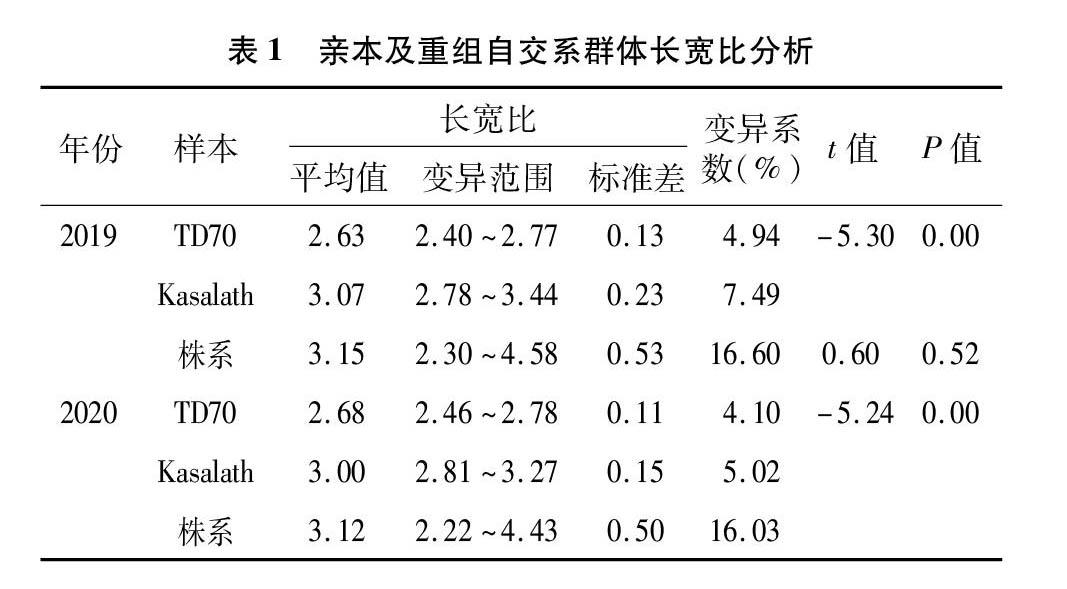
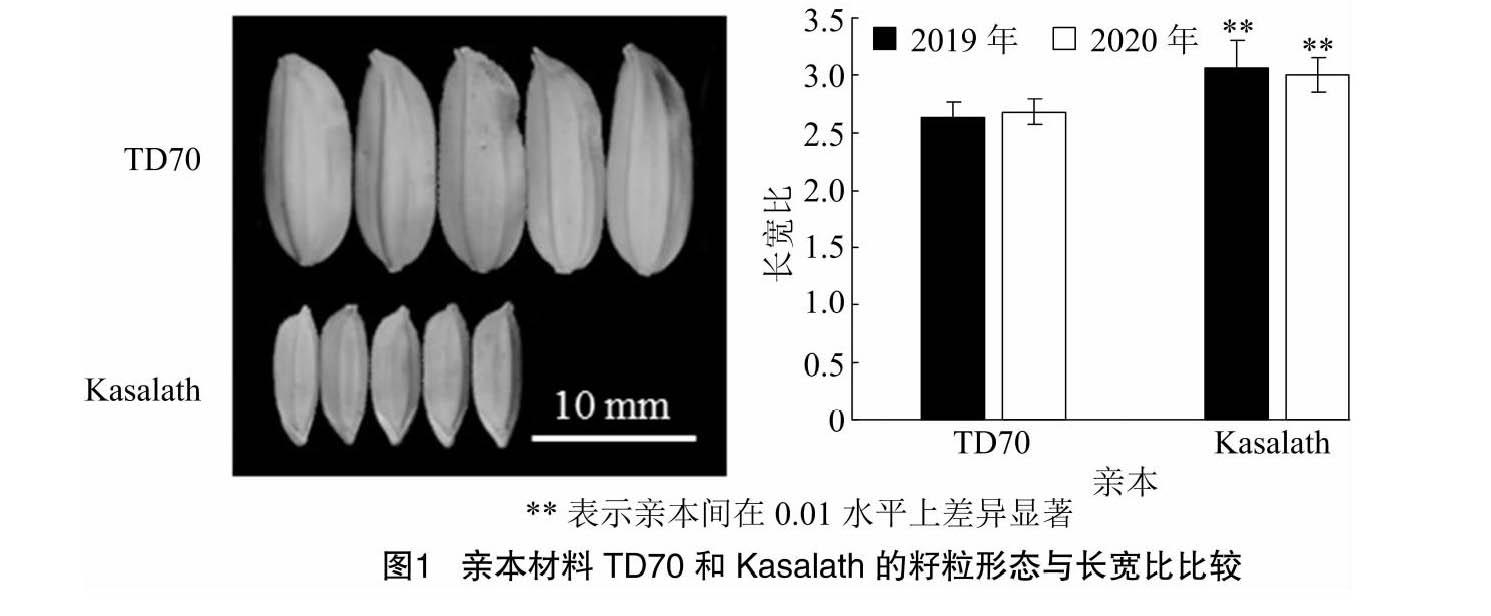
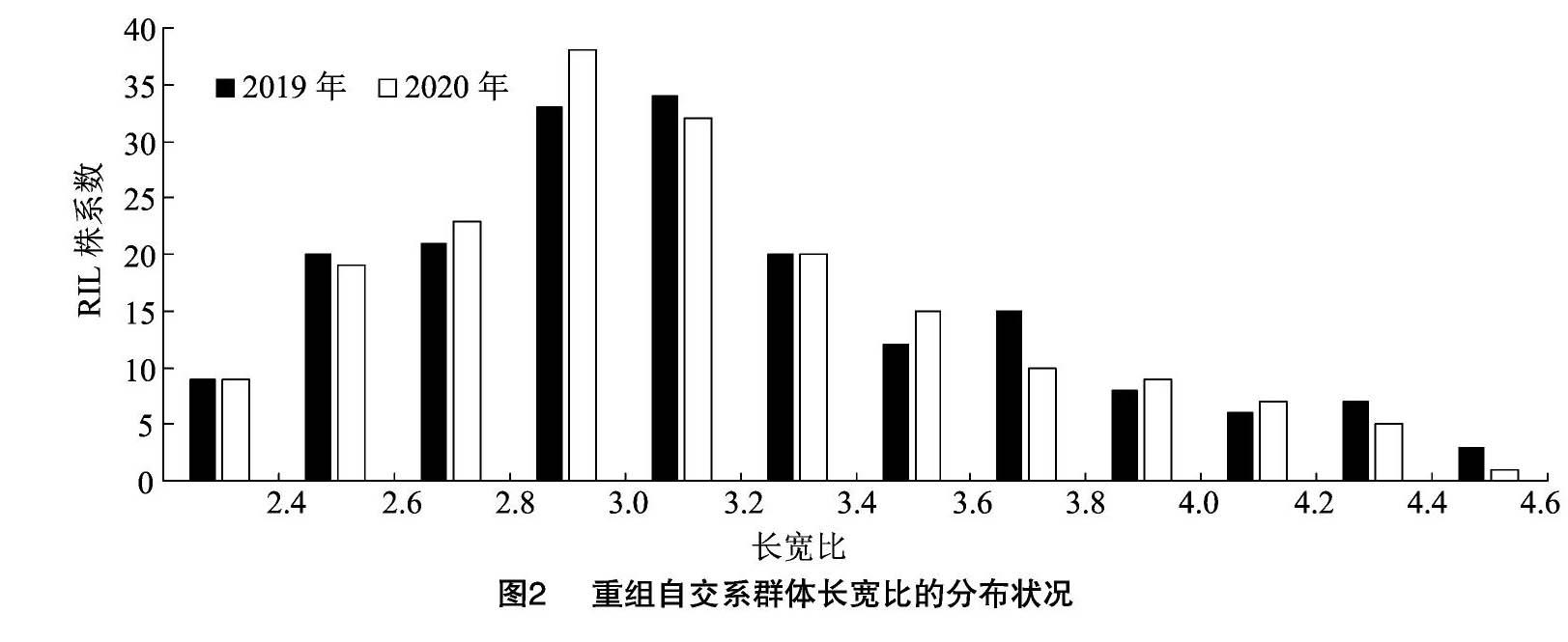
2019、2020年对亲本TD70、Kasalath及186个重组自交系株系长宽比进行考察。结果表明,TD70长宽比分别为2.63±0.13、2.68±1.11,Kasalath长宽比分别为3.07±0.23、3.00±0.15。对亲本籽粒大小(图1)的2年数据进行t测验,结果显示,亲本间长宽比均存在极显著差异(表1)。重组自交系群体2年长宽比分别为2.30~4.58、2.22~4.43,呈现出广泛的变异,平均值分别为3.15±0.53、3.12±0.50(表1)。对长宽比的频率分布及峰值进行分析,结果显示,2年的籽粒长宽比均呈现连续变异的近正态分布(图2),表现出受多基因控制的数量性状的遗传特征,2年间的变化趋势相似,且存在超亲分离现象,符合QTL区间作图分析的要求。
2.2 籽粒长宽比QTL定位
利用前期研究构建的高密度遗传图谱,连续2年对亲本及186个重组自交系株系的籽粒长宽比数据进行考察,采用QTL IciMapping V 4.2.53软件的ICIM-ADD算法进行QTL作图及分析。结果(图3)表明,2年共检测到11个与籽粒长宽比相关的QTLs,分别位于2、3、4、5、6、7、9号染色体的不同位置。籽粒长宽比QTL在染色体上的分布并不均匀,其中,2、3、6、9号染色体分别检测到2个QTLs;4、5、7号染色体分别检测到1个QTL。qLWR3-1、qLWR3-2、qLWR5和qLWR6-1等4个QTL在2019、2020年2年均被检测到,说明这4个QTL受环境影响小,遗传较稳定。
2.3 籽粒长宽比QTL分析
对检测到的11个QTLs进一步分析,发现QTL的LOD值最小为3.74,最大为31.41,贡献率在248%~24.67% 之间。 2年分析结果(表2) 显示,这些QTL分别解释74.55%和74.69%的表型变异。其中,qLWR2-2位于2号染色体,LOD值为14.52,贡献率为9.00%,定位在标记Bin1570~Bin1571之间;qLWR4位于4号染色体,LOD值为410可解释2.68%的表型变异。2019、2020年2年均检测到的QTL有4个:qLWR3-1的2年贡献率分别为12.26%和1499%,加性效应均为0.18;qLWR3-2的2年贡献率分别为13.07%和1126%,加性效应分别为 -0.19 和-0.16;qLWR5位于5号染色体上,贡献率最大,2年贡献率分别为24.67%和22.70%,加性效应分别为0.25和0.23;qLWR6-1的2年贡献率分别为4.90%和6.95%,加性效应分别为-0.11和-0.12。进一步分析发现,QTLs定位物理区间在11 332~68 084 bp之间,其中qLWR3-1、qLWR3-2分别定位在11 332、32 249 bp 的染色體区段内;qLWR5定位在 30 824 bp 物理区间内;qLWR6-1被定位在 27 693 bp 的物理区间内;qLWR7定位于7号染色体上 29 299 bp 物理区间(表2)。
3 讨论与结论
水稻粒型与粒质量密切相关,且对产量和品质均有影响[1]。在水稻长宽比相关的QTL研究方面,方先文等以籼稻扎西玛与优质粳稻南粳46构建了重组自交系群体,利用202对SSR标记进行籽粒性状的QTL分析,检测到6个长宽比相关的QTL[33]。
梁云涛等构建了F2群体,利用184对SSR标记共检测到3个粒型QTL,表型贡献率为10.56%~1477%,QTL物理区间为254 720~407 666 bp[34]。李金吉等利用大粒品种和东北小粒中的F2群体的156对多态SSR标记定位到5个长宽比相关的QTL,分别位于水稻2、3、5号染色体上,贡献率为4%~18%,其中,qL/W-2-1和qL/W-2-2均位于1 274 508 bp物理区间内,qL/W-3-1定位区间为2 706 165 bp[35]。前人通过构建不同的遗传群体对粒型QTL进行检测,但是传统的分子标记构建的遗传图谱不够精细,因而定位到的QTL位点区间较大,后续难以进行精细定位和候选基因的克隆工作。
利用2代测序技术构建高密度遗传图谱对QTL的定位更加精细,徐建军等利用重测序技术构建了包含401个Bin的遗传图谱,定位到8个粒型QTL,定位区间为200 070~5 792 954 bp[36];卫纯洁等利用该群体定位到4个水稻籽粒长宽比相关的QTL,定位区间在17 825~945 168 bp之间[37]。张健等以特异矮杆突变体CHA-1为母本、以籼稻H335为父本构建了275个重组自交系群体,利用简化基因组测序构建的高密度遗传图谱包含2 498个Bin标记,利用该图谱共检测到26个籽粒大小相关的QTL,最小定位区间为90 416 bp[38]。由此可见,2代高通量测序构建的图谱确实优于传统的分子标记图谱,这可能是重测序获得的基因组变异信息更全面,因而图谱标记密度更大,也较均匀。笔者所在实验室前期研究对重组自交系群体186个株系进行全基因组重测序,由于是籼粳交后代基因组差异大,因而SNP位点较多,过滤掉低质量的位点后最终构建的图谱包含12 328个Bin 标记,相邻标记间平均物理距离仅为30.26 kb[27]。本研究利用该图谱对长宽比进行QTL分析,结果表明,11个长宽比相关的QTL定位区间最小为11 332 bp,最大为 68 084 bp,平均为30 083 bp的定位区间较精细,有助于后续对基因的克隆和功能分析。
本研究中qLWR2-2和qLWR7所在区间与张亚东等对粒型QTL定位的区间[28,35]相近,深入分析发现,这2个区间内分别存在已知粒型基因GW2和GL7/GW7[8,9,16]。qLWR3-1、qLWR3-2、qLWR5是2年均检测到的主效QTL位点,定位区间与前人相关的研究结果一致,且区间内分别存在已知的粒型基因GS3、qGL3和GW5[28,38]。qLWR4、qLWR6-2分别位于4、6号染色体上,该区间附近存在已克隆的粒型相关基因D11和TGW6[22,39]。qLWR2-1、qLWR6-1、qLWR9-1和qLWR9-2等4个QTL位点所在区间未见相关报道,可能是本研究新发现的位点,其中,qLWR6-1在2019、2020年2年均检测到,说明该位点遗传较稳定,后续试验将对4个新的位点进一步验证并深入研究。本研究通过高密度Bin图谱定位到控制籽粒长宽比相关QTL位点,既包含前人已经定位或克隆的粒型基因,也发现4个新的QTL位点,有利于下一步相关基因的深入研究和分子标记辅助育种应用。
参考文献:
[1]徐正进,陈温福,马殿荣,等. 稻谷粒形与稻米主要品质性状的关系[J]. 作物学报,2004,30(9):894-900.
[2]高志強,占小登,梁永书,等. 水稻粒形性状的遗传及相关基因定位与克隆研究进展[J]. 遗传,2011,33(4):314-321.
[3]Harberd N P.Shaping taste:the molecular discovery of rice genes improving grain size,shape and quality[J]. Journal of Genetics and Genomics,2015,42(11):597-599.
[4]Li N,Xu R,Li Y H.Molecular networks of seed size control in plants[J]. Annual Review of Plant Biology,2019,70:435-463.
[5]Chan A N,Wang L L,Zhu Y J,et al. Identification through fine mapping and verification using CRISPR/Cas9-targeted mutagenesis for a minor QTL controlling grain weight in rice[J]. Theoretical and Applied Genetics,2021,134(1):327-337.
[6]Fan C C,Yu S B,Wang C R,et al. A causal C-A mutation in the second exon of GS3 highly associated with rice grain length and validated as a functional marker[J]. Theoretical and Applied Genetics,2009,118(3):465-472.
[7]Zhang X J,Wang J F,Huang J,et al. Rare allele of OsPPKL1 associated with grain length causes extra-large grain and a significant yield increase in rice[J]. Proceedings of the National Academy of Sciences of the United States of America,2012,109(52):21534-21539.
[8]Wang Y X,Xiong G S,Hu J A,et al. Copy number variation at the GL7 locus contributes to grain size diversity in rice[J]. Nature Genetics,2015,47(8):944-948.
[9]Wang S K,Li S,Liu Q A,et al. The OsSPL16-GW7 regulatory module determines grain shape and simultaneously improves rice yield and grain quality[J]. Nature Genetics,2015,47(8):949-954.
[10]Wu W G,Liu X Y,Wang M H,et al. A single-nucleotide polymorphism causes smaller grain size and loss of seed shattering during African rice domestication[J]. Nature Plants,2017,3:17064.
[11]Xia D,Zhou H,Liu R J,et al. GL3.3,a novel QTL encoding a GSK3/SHAGGY-like kinase,epistatically interacts with GS3 to produce extra-long grains in rice[J]. Molecular Plant,2018,11(5):754-756.
[12]Ying J Z,Ma M,Bai C,et al. TGW3,a major QTL that negatively modulates grain length and weight in rice[J]. Molecular Plant,2018,11(5):750-753.
[13]Si L Z,Chen J Y,Huang X H,et al. OsSPL13 controls grain size in cultivated rice[J]. Nature Genetics,2016,48(4):447-456.
[14]Zhang Y P,Zhang Z Y,Sun X M,et al. Natural alleles of GLA for grain length and awn development were differently domesticated in rice subspecies Japonica and indica[J]. Plant Biotechnology Journal,2019,17(8):1547-1559.
[15]Zhao D S,Li Q F,Zhang C Q,et al. GS9 acts as a transcriptional activator to regulate rice grain shape and appearance quality[J]. Nature Communications,2018,9:1240.
[16]Song X J,Huang W,Shi M,et al. A QTL for rice grain width and weight encodes a previously unknown RING-type E3 ubiquitin ligase[J]. Nature Genetics,2007,39(5):623-630.
[17]Duan P G,Xu J S,Zeng D L,et al. Natural variation in the promoter of GSE5 contributes to grain size diversity in rice[J]. Molecular Plant,2017,10(5):685-694.
[18]Liu J F,Chen J,Zheng X M,et al. GW5 acts in the brassinosteroid signalling pathway to regulate grain width and weight in rice[J]. Nature Plants,2017,3:17043.
[19]Shomura A,Izawa T,Ebana K,et al. Deletion in a gene associated with grain size increased yields during rice domestication[J]. Nature Genetics,2008,40(8):1023-1028.
[20]Li Y B,Fan C C,Xing Y Z,et al. Natural variation in GS5 plays an important role in regulating grain size and yield in rice[J]. Nature Genetics,2011,43(12):1266-1269.
[21]Wang S K,Wu K,Yuan Q B,et al. Control of grain size,shape and quality by OsSPL16 in rice[J]. Nature Genetics,2012,44(8):950-954.
[22]Ishimaru K,Hirotsu N,Madoka Y,et al. Loss of function of the IAA-glucose hydrolase gene TGW6 enhances rice grain weight and increases yield[J]. Nature Genetics,2013,45(6):707-711.
[23]Song X J,Kuroha T,Ayano M,et al. Rare allele of a previously unidentified histone H4 acetyltransferase enhances grain weight,yield,and plant biomass in rice[J]. Proceedings of the National Academy of Sciences of the United States of America,2015,112(1):76-81.
[24]Segami S,Kono I,Ando T,et al. Small and round seed 5 gene encodes alpha-tubulin regulating seed cell elongation in rice[J]. Rice,2012,5(1):4.
[25]Hu J A,Wang Y X,Fang Y X,et al. A rare allele of GS2 enhances grain size and grain yield in rice[J]. Molecular Plant,2015,8(10):1455-1465.
[26]Che R H,Tong H N,Shi B H,et al. Control of grain size and rice yield by GL2-mediated brassinosteroid responses[J]. Nature Plants,2016,2:15195.
[27]張亚东,梁文化,赫 磊,等. 水稻RIL群体高密度遗传图谱构建及粒型QTL定位[J/OL]. 中国农业科学.[2021-09-21]. https://www.chinaagrisci.com/CN/abstract/abstract21723.shtml.
[28]张亚东,张颖慧,董少玲,等. 特大粒水稻材料粒型性状的QTL检测[J]. 中国水稻科学,2013,27(2):122-128.
[29]Huang X H,Feng Q,Qian Q A,et al. High-throughput genotyping by whole-genome resequencing[J]. Genome Research,2009,19(6):1068-1076.
[30]Meng L,Li H H,Zhang L Y,et al. QTL IciMapping:Integrated software for genetic linkage map construction and quantitative trait locus mapping in biparental populations[J]. The Crop Journal,2015,3(3):269-283.
[31]McCouch S R.Gene nomenclature system for rice[J]. Rice,2008,1(1):72-84.
[32]Voorrips R E.MapChart:Software for the graphical presentation of linkage maps and QTLs[J]. Journal of Heredity,2002,93(1):77-78.
[33]方先文,张云辉,肖西林,等. 基于重组自交系群体的水稻粒形QTL定位[J]. 江苏农业学报,2017,33(2):241-247.
[34]梁云涛,潘英华,徐志健.利用野栽分离群体定位水稻粒型相关QTL[J]. 西南农业学报,2017,30(10):2161-2167.
[35]李金吉,张银霞,赵 娜,等. 水稻粒形与千粒质量的QTL分析[J]. 西北农林科技大学学报(自然科学版),2021,49(2):54-60.
[36]徐建军,赵 强,汤在祥,等. 利用重测序的染色体片段代换系群体定位水稻粒型QTL[J]. 中国水稻科学,2011,25(4):365-369.
[37]卫纯洁,陶亚军,范方军,等. 利用重测序染色体片段代换系群体定位水稻籽粒长宽比QTL[J]. 江苏农业科学,2020,48(6):36-40.
[38]张 健,杨 靖,王 豪,等. 基于高密度遗传图谱定位水稻籽粒大小相关性状QTL[J]. 中国农业科学,2020,53(2):225-238.
[39]Tanabe S,Ashikari M,Fujioka S,et al. A novel cytochrome P450 is implicated in brassinosteroid biosynthesis via the characterization of a rice dwarf mutant,dwarf11,with reduced seed length[J]. The Plant Cell,2005,17(3):776-790.

