外源褪黑素对低温胁迫下不同葡萄品种抗氧化酶活性和AsA-GSH循环的影响
苗卫东 王萌 高换超 井朋伟 李少东 樊秀彩
摘要:利用叶面喷施方法,探讨100 μmol/L外施褪黑素(MEL)溶液对低温胁迫下不同葡萄品种抗氧化酶系统和抗坏血酸-谷胱甘肽循环(AsA-GSH循环)的影响,以此推论MEL在葡萄受到低温胁迫时起到的作用。结果表明,外源MEL可以促进低温胁迫下葡萄抗坏血酸(AsA)和谷胱甘肽(GSH)含量的积累,降低GSSG含量。长时间(7 h)低温胁迫下,外源MEL可以降低脱氢抗坏血酸还原酶(DHAR)含量,能够维持较高的AsA-GSH循环系统中抗坏血酸过氧化物酶(APX)、DHAR、单脱氢抗坏血酸还原酶(MDHAR)、谷胱甘肽还原酶(GR)活性。喷施外源MEL促进了低温胁迫下葡萄AsA-GSH循环快速而有效的运转,降低了低温胁迫对葡萄植株的氧化伤害,从而缓解了低温胁迫对葡萄幼苗的伤害作用。
关键词:葡萄;低温胁迫;外源褪黑素;酶活性;抗坏血酸-谷胱甘肽循环;抗氧化酶
中图分类号: S663.101 文献标志码: A
文章编号:1002-1302(2021)23-0133-06
收稿日期:2021-08-06
作者简介:苗卫东(1968—),男,河南遂平人,副教授,主要从事园艺植物栽培生理研究。E-mail:wangmeng991226@163.com。
通信作者:樊秀彩,硕士,研究员,主要从事葡萄遗传资源研究。E-mail:fanxiucai@caas.cn。
葡萄(Vitis vinifera L.)是我国及世界上的重要水果之一,但在葡萄栽培生产过程中常常遭遇低温胁迫。低温常常引起植物生理代谢紊乱,生长发育受到抑制,降低产量和品质。目前对低温胁迫的研究主要集中在膜伤害、光合、渗透调节物质、抗氧化酶活性等方面[1]。褪黑素(melatonin,简称MEL)是一种生物调节剂,它不仅在植物的正常生长和发育过程中扮演着必不可少的角色,而且它还可以通过提高抗氧化酶活性,降低活性氧(ROS)含量,提高植株抗性,以此缓解多种环境胁迫,如抗寒、干旱、盐渍、营养元素缺乏等[2-3]。
近年来,MEL介导植物对生物和非生物胁迫下的抗性研究越来越受到人们关注,已有研究表明,适宜浓度的MEL处理可以提高植物对低温的忍耐性,但效果卻因MEL处理的浓度、逆境类型及植物种类而异。抗坏血酸-谷胱甘肽(AsA-GSH)循环系统是植物体内清除活性氧自由基的重要途径,但关于MEL是否参与调节低温胁迫下葡萄体内 ASA-GSH 循环,缓解低温胁迫对葡萄植株的氧化伤害研究报道较少[4-5]。本试验选取砧木品种SO4葡萄(SO4 grape)、红提葡萄(Red Globe grape)和无核白葡萄(Thompson Seedless grape)3个葡萄品种的一年生盆栽自根苗为试验材料,研究外源MEL对低温胁迫下葡萄AsA-GSH循环的影响,为进一步研究外源MEL对葡萄植株抗低温胁迫能力的影响、MEL缓解低温伤害等方面提供一定的理论依据,为葡萄防寒管理提供一定的理论依据和技术指导。
1 材料与方法
1.1 材料
试验材料采集于河南科技学院葡萄种质资源圃(试验地点:35°16′ 56″N,113°55′ 49″E;试验时间:2021年3—9月)。以SO4葡萄、红提葡萄、无核白葡萄3个葡萄品种的一年生自根苗为试验材料,采用盆栽方式,盆口直径为30 cm、高为25 cm。每盆装沙壤土4.0 kg。
1.2 方法
1.2.1 材料处理
盆栽苗长势良好后进行试验处理,每个品种随机选取10盆,每盆种植1株一年生自根苗,首先进行低温胁迫处理试验(-15 ℃),常温温度为25 ℃,24 h后取材测定各项指标,每个处理重复3次;然后09:00—10:00时采用100 μmol/L外施褪黑素(MEL)溶液进行叶面喷施,MEL溶液里添加0.5% Tween-20增加表面附着。叶面喷施 3 d 后,测定各项指标。试验设计4个处理:(1)对照,喷施清水后进行常温处理;(2)低温,喷施清水后进行低温处理,处理1、4、7、11、24 h;(3)MEL,常温的喷施MEL;(4)低温+MEL,低温处理的喷施MEL。从每个处理的植株中上部选取叶片3张,所采样品生长势及管理水平一致。
1.2.2 抗氧化酶系统中抗氧化酶活性的测定
超氧化物歧化酶(SOD)活性采用SOD抑制氮蓝四唑(NBT)光化还原法进行测定,过氧化物酶(POD)活性采用愈创木酚法进行测定,过氧化氢酶(CAT)活性采用高锰酸钾滴定法进行测定[6]。以上生理指标均采用北京索莱宝科技发展公司试剂盒进行测定,型号分别为BC0700、PR1400、BC1340,每个指标类型重复测定3次。
1.2.3 AsA-GSH循环代谢物指标的测定
还原型抗坏血酸(AsA)、氧化型抗坏血酸(dehydroascorbic acid,简称DHA)含量的测定采用二联吡啶法[7]。氧化型谷胱甘肽(GSSG)、还原型谷胱甘肽(GSH)含量的测定采用Nagalakshmi等的DTNB检测法[8]。抗坏血酸过氧化物酶(APX)、脱氢抗坏血酸还原酶(DHAR)以及谷胱甘肽还原酶(GR)活性的测定参考Nakano等的方法[9],单脱氢抗坏血酸还原酶(MDHAR)活性的测定参考Krivosheeva等的方法[10]。以上生理指标均采用北京索莱宝科技有限公司试剂盒进行测定,型号分别为BC1170、BC1160、BC0195、BC0650、BC1230、BC1180,每个指标类型重复测定3次。
1.3 数据处理
采用SPSS 22.0软件进行数据处理。
2 结果与分析
2.1 褪黑素对低温胁迫下不同葡萄品种抗氧化酶活性的影响
2.1.1 低温胁迫下不同葡萄品种抗氧化酶活性的变化
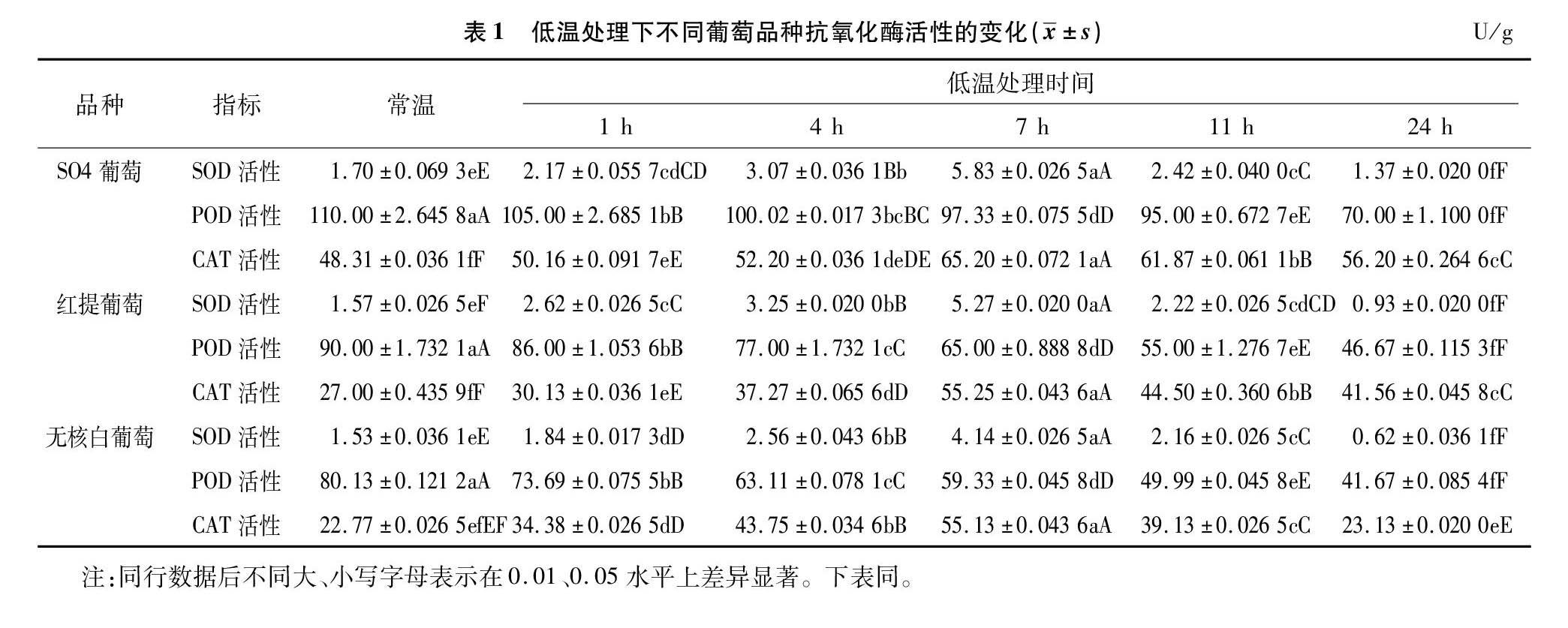
由表1可知,低温胁迫处理后,3个葡萄品种的SOD和CAT依然保持较高的酶活性,这可能是SOD和CAT保護酶活性的耐寒机制已形成,当处理7 h时,酶活性达到最高,与常温相比差异极显著(P<0.01),这是低温的一种适应性反应,使其比在常温下能更有效地清除体内的有毒物质,保护葡萄植株免受伤害或减少伤害。当低温胁迫7 h时,砧木SO4葡萄的SOD和CAT活性最高,分别达到(5.83±0.002 65) U/g鲜质量(FW)和(65.20±0.072 1) U/g 鲜质量。但到7 h后,3个葡萄品种的SOD和CAT活性均开始随着处理时间的增加呈下降趋势,说明随着低温处理时间的延长,葡萄植株有受冻害的可能,因此在葡萄栽植管理过程中,遇到低温胁迫时,葡萄品种、温度和时间都是必须要考虑的因素。随着低温胁迫时间的增加,3个葡萄品种的POD活性均呈逐渐下降的趋势,低温处理24 h,SO4葡萄的POD活性降低到(70.00±1.100 0) U/g FW,红提葡萄的POD活性为(46.67±0.115 3) U/g FW,无核白葡萄的POD活性仅为(41.67±0.085 4) U/g FW。说明随着低温胁迫时间的延长,抗氧化酶的活性受到破坏,葡萄植株受到低温伤害。
2.1.2 褪黑素对低温胁迫下不同葡萄品种抗氧化酶活性的影响
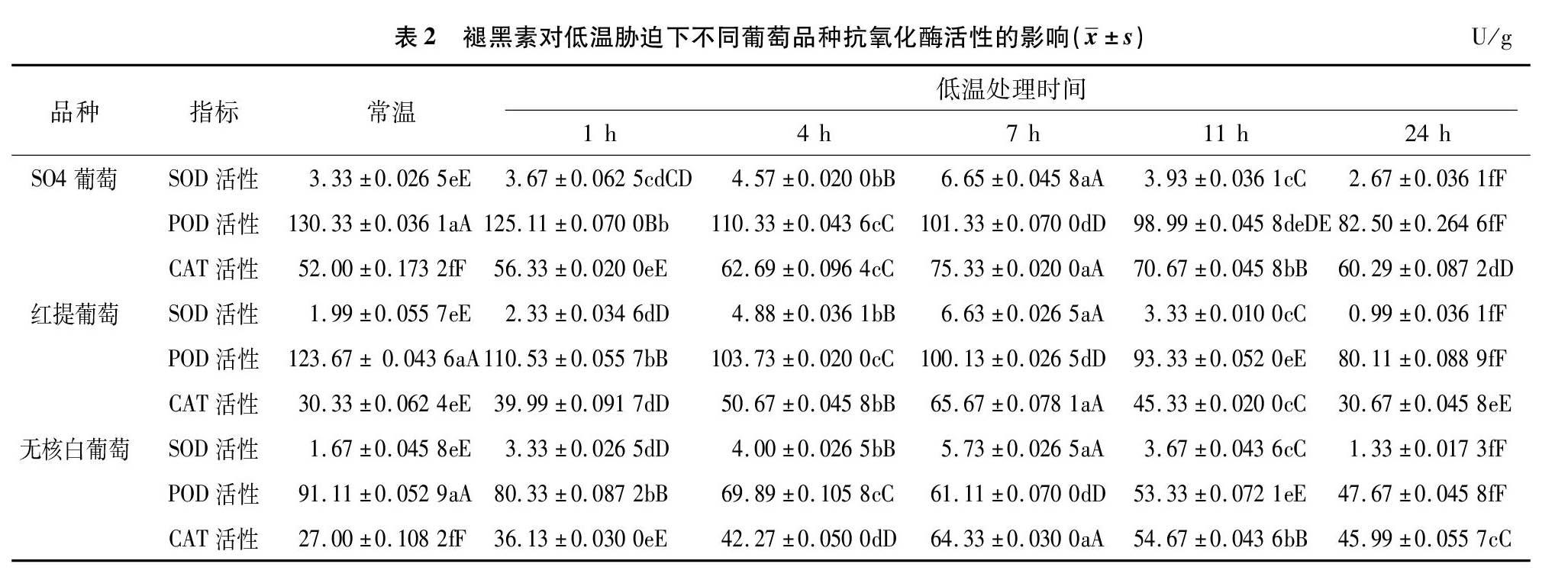
由表2可知,在1~24 h低温胁迫时间内,喷施外源MEL,3个葡萄品种SOD和CAT活性均呈现先升高后降低的趋势,在7 h时酶活性达到最高,与常温相比差异极显著(P<0.05);POD活性呈现逐渐下降的趋势。在低温胁迫的整个过程中,喷施外源MEL显著提高了SOD和CAT活性。喷施外源MEL降低了低温胁迫下的POD活性,说明喷施外源MEL在低温胁迫下可以提高葡萄SOD和CAT活性,抑制POD活性,说明喷施外源MEL可以增加葡萄植株体内抗氧化物酶活性,间接增加了抗氧化物质的含量,能有效地清除体内的自由基,提高葡萄植株抵抗低温胁迫的能力。
2.2 褪黑素对低温胁迫下不同葡萄品种AsA-GSH循环途径的影响
2.2.1 低温胁迫下不同葡萄品种AsA-GSH循环中酶活性和代谢物的变化
在抗坏血酸代谢中,APX以AsA作为电子供体,催化AsA与H2O2反应,达到分解H2O2的目的;MDHAR以还原型辅酶II(NADPH)作为电子供体,将单脱氢抗坏血酸(MDHA)还原为AsA;脱氢抗坏血酸还原酶(DHAR)在碱性条件下催化GSH使脱氢抗坏血酸还原酶(DHA)还原为AsA;谷胱甘肽还原酶(GR)是一种黄素蛋白氧化还原酶,能催化GSSG还原为GSH,从而使细胞内的谷胱甘肽库保持在还原状态。
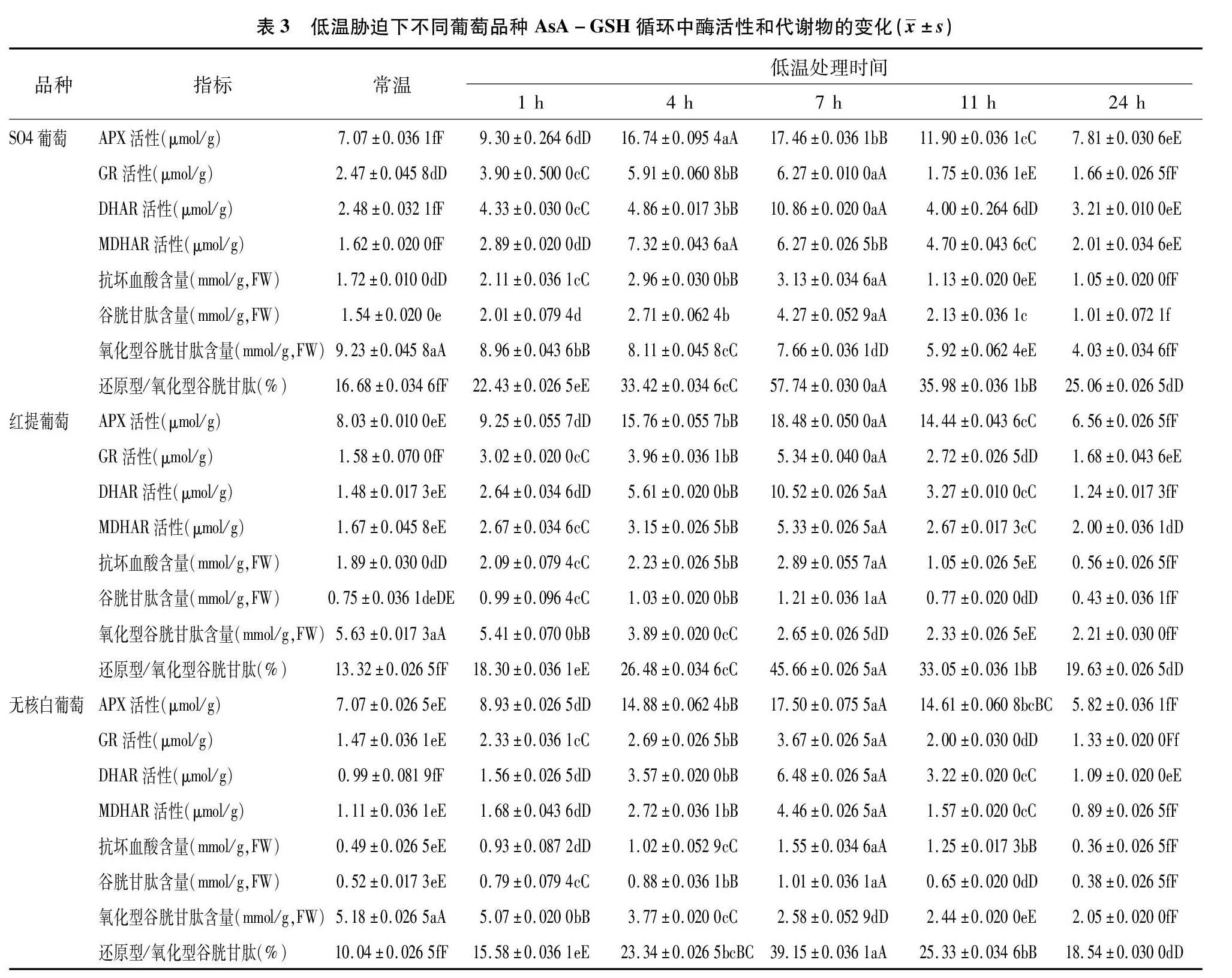
由表3可知,低温胁迫过程中,随着处理时间的延长,3个葡萄品种APX、GR、DHAR和MDHAR活性呈现先升高后降低的趋势,而且低温7 h时极显著高于常温水平。低温处理7 h时,SO4葡萄中GR、DHAR和MDHAR活性分别达到(6.27±0.010 0) μmol/g、(10.86±0.020 0) μmol/g 和(6.27±0.026 3) μmol/g,而APX活性在红提葡萄中达到(18.48±0.050 0) U/g FW,是3个葡萄品种中APX活性最高的。值得注意的是,SO4葡萄中MDHAR活性在低温处理 4 h 时达到峰值,这比红提葡萄和无核白葡萄中MDHAR活性峰值提早3 h。结果表明,3个葡萄品种在抵抗低温胁迫过程中AsA-GSH循环中各种酶活性明显增加,且SO4葡萄的增加幅度更大。但超过7 h低温胁迫后,3个不同葡萄品种APX、GR、DHAR和MDHAR活性开始出现下降,说明低温胁迫一定时间内,葡萄自身会启动体内AsA-GSH循环系统中的酶活性,提高防御能力,但是随着低温胁迫时间的延长,这种能力会下降,AsA-GSH循环系统中APX、GR、DHAR和MDHAR活性下降。
低温胁迫期间3个葡萄品种的AsA和GSH含量及GSH/GSSG比值的变化与酶活性变化一致,均表现为先上升后下降的趋势,而氧化型谷胱甘肽含量则为逐渐下降趋势,低温处理24 h后,SO4葡萄、红提葡萄和无核白葡萄分别降低到(4.03±0.034 6) mmol/g FW、(2.21±0.030 0) mmol/g FW和(2.05±0.020 0) mmol/g FW。3个葡萄品种的AsA和GSH含量在低温胁迫7 h时达到最大值,与对照相比差异极显著。3个葡萄品种中SO4葡萄的AsA含量、GSH含量以及GSH/GSSG值最高,分别达到(3.13±0.034 6) mmol/g FW、(4.27±0.052 9) mmol/g FW和57.74%;其次为红提葡萄,该品种的AsA含量、GSH含量以及GSH/GSSG值分别为(2.89±0.0557) mmol/g FW、(1.21±0.036 1) mmol/g FW和45.66%;无核白葡萄的AsA含量、GSH含量以及GSH/GSSG值最低,依此为(1.55±0.0346)mmol/g FW、(1.01±0.036 1) mmol/g FW和39.15%。说明低温胁迫期7 h之前,3个葡萄品种中的AsA含量和GSH含量增加,GSSG含量降低,促使AsA最大程度地保持在还原状态,有利于增强葡萄幼苗抵抗低温胁迫的能力,而随着低温胁迫时间的延长,AsA-GSH循环系统中APX、GR、DHAR和MDHAR活性降低,GSH含量和GSSG含量降低,促使AsA含量下降,葡萄会受到低温伤害。
2.2.2 褪黑素对低温胁迫下不同葡萄品种AsA-GSH循环途径的影响
GR、DHAR、MDHAR对维持AsA-GSH循环的有效运行具有重要的作用。由表4可知,低温胁迫下喷施外源MEL,APX、GR、DHAR和MDHAR活性在7 h前逐渐增加,随后快速下降。低温胁迫1~11 h时喷施外源MEL,APX、GR、DHAR、MDHAR活性显著高于常温。喷施外源MEL在低温胁迫7 h时,SO4葡萄中DHAR和MDHAR活性均高于红提葡萄和无核白葡萄,分别达到(12.11±0.040 0) 、(8.50±0.043 6) μmol/g;而APX和GR活性在红提葡萄中最高,分别达到(29.33±0.045 8) U/g FW和(8.93±0.026 5) μmol/g。说明施用外源MEL能保持相对较高的APX、MDHAR、DHAR和GR活性,增强植株对H2O2等活性氧的清除能力。
GSH不仅是一种抗氧化物质,而且是脱氢抗坏血酸还原酶(DHA)的电子供体,能清除生物体内的自由基从而解除毒害,它通过AsA-GSH循环可加快AsA再生[1]。在低温胁迫时喷施外源MEL处理期间,3个葡萄品种中AsA含量、GSH含量、GSSG含量和GSH/GSSG值的变化均表现为先上升后下降的趋势。低温胁迫中喷施外源MEL增加了AsA、GSH、GSSG含量,其中低温胁迫7 h时施加外源MEL,AsA、GSH、GSSG含量和GSH/GSSG值达到最大,与对照相比,效果差异极显著(P<0.01)。3个葡萄品种中SO4葡萄的AsA、GSH、GSSG含量及GSH/GSSG值最高,分别达到(4.67±0.062 4)、(5.67±0.026 5)、(9.16±0.045 8) mmol/g FW和61.90%;其次为红提葡萄,该品种AsA、GSH、GSSG含量以及GSH/GSSG值分别为(3.99±0.020 0)、(2.33±0.036 1)、(4.67±0.045 8) mmol/g FW和49.89%;而无核白葡萄的AsA、GSH、GSSG含量以及GSH/GSSG值是3个品种中最低的,仅为(3.00±0.026 5)、(1.79±0.026 5)、(4.33±0.010 0) mmol/g FW和41.34%。可見,低温胁迫下喷施适量MEL可显著提高GSH含量,降低GSSH含量,导致GSH/GSSG的比值明显提高。说明喷施外源褪黑素可通过提高AsA-GSH循环系统的代谢活动,减轻活性氧对葡萄幼苗的伤害,从而提高葡萄抵抗低温胁迫的能力。
3 讨论与结论
低温胁迫会影响植物的光合作用和能量的产生,导致物质合成受阻,细胞内活性氧积累,代谢失衡从而引发膜脂过氧化、电解质失衡、细胞代谢紊乱等[2,11],严重时会导致植物死亡。面对胁迫植物可以调动自身的抗氧化防御机制,产生SOD、CAT、POD、APX、GR、DHAR、MDHAR等抗氧化酶以及AsA、GSH等抗氧化剂[7-10],通过直接或间接途径还原积累的活性氧[9],从而减少低温对植物造成的伤害。
本试验主要探究低温胁迫下外源施用MEL对不同葡萄品种常规抗氧化酶及AsA-GSH循环代谢系统的影响,结果发现低温处理的3种葡萄,SOD、CAT、POD活性随处理时间的延长均呈现先升后降的趋势,这与郑春芳等的研究结果[5]一致。这可能是由于在胁迫初期,低温作为信号,启动了植物的应激反应,而在胁迫后期低温降低了抗氧化酶活性,大量积累的活性氧诱导丙二醛(MDA)等有毒代谢物质大量产生,进而抑制了保护酶的活性。喷施外源MEL的葡萄,遭受低温胁迫后SOD、CAT、POD活性与未喷施MEL的处理相比也呈现相同的趋势,但是酶活性均高于低温处理植株,这也在其他研究[12-15]中被证明,说明施用外源MEL可以提高SOD、POD、CAT这些常规抗氧化酶的活性,通过减少细胞膜脂过氧化,保持细胞膜完整性进而有效降低低温对葡萄植株造成的伤害。
AsA和GSH可以维持蛋白质的稳定性,生物膜系统结构的完整性及防御膜脂过氧化,与APX、DHAR、MDHAR、GR共同构成了能有效清除自由基的循环系统,即AsA-GSH循环,在抗氧化机制中发挥重要作用,在AsA-GSH循环中AsA借助APX的催化作用与H2O2反应,接受来自GSH的NADPH,把H2O2还原成H2O,同时自身被氧化形成MDHA,一部分的MDHA则在MDHAR的作用下被还原为AsA,重新参与AsA-GSH循环,而另一部分的MDHA通过再次氧化形成DHA,DHA又以GSH为底物在DHAR催化作用下重新生成AsA,而此反应所产生的GSSG在NADPH参与下又被GR催化还原成GSH[16-21]。在本试验中,低温胁迫初期,AsA-GSH系统中的抗氧化酶活性及非酶抗氧化剂含量呈上升趋势,胁迫后期整体又呈下降的趋势,呈现这种趋势的原因推测与SOD、CAT、POD活性变化规律相同。而施用100 μmol/L外源MEL,APX、DHAR、MDHAR、GR活性和AsA、GSH含量提高,GSH/GSSG比值提升,说明施用外源MEL提高了AsA和GSH含量,为AsA-GSH循环系统提供了充足底物,加速了活性氧清除效率,减轻了活性氧对膜脂的伤害,保持了细胞完整性,从而缓解了低温对葡萄的伤害,为葡萄防寒管理提供一定的理论依据和技术指导。
参考文献:
[1]曲凌慧,车永梅,侯丽霞,等. 低温胁迫对葡萄品种梅鹿辄和贝达活性氧代谢的影响[J]. 青岛农业大学学报(自然科学版),2010,27(2):117-121,125.
[2]卞凤娥,唐翠花,邢 浩,等. 外源褪黑素对干旱胁迫下葡萄内源褪黑素及叶绿素荧光特性的影响[J]. 植物生理学报,2018,54(10):1615-1623.
[3]Zetterstrom R C,Eijkman C,Sir Hopkins F G. The dawn of vitamins and other essential nutritional growth factors[J]. Acta Padiatrica,2006,95(11):1331-1333.
[4]尹永强,胡建斌,邓明军. 植物叶片抗氧化系统及其对逆境胁迫的响应研究进展[J]. 中国农学通报,2007,23(1):105-110.
[5]郑春芳,刘伟成,魏 龙,等. 外施褪黑素对低温胁迫下红树植物秋茄光合作用和抗坏血酸-谷胱甘肽循环的调控[J]. 植物生理学报,2019,55(8):1211-1221.
[6]李小方,张志良. 植物生理学实验指导[M]. 5版.北京:高等教育出版社,2016:292.
[7]Jiang M Y,Zhang J H.Effect of abscisic acid on active oxygen species,antioxidative defence system and oxidative damage in leaves of maize seedlings[J]. Plant and Cell Physiology,2001,42(11):1265-1273.
[8]Nagalakshmi N,Prasad M N V.Responses of glutathione cycle enzymes and glutathione metabolism to copper stress in Scenedesmus bijugatus[J]. Plant Science,2001,160(2):291-299.
[9]Nakano Y,Asada K.Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J]. Plant and Cell Physiology,1981,22(5):867-880.
[10]Krivosheeva A,Tao D L,Ottander C,et al. Cold acclimation and photoinhibition of photosynthesis in Scots pine[J]. Planta,1996,200(3):296-305.
[11]黄 娟,刘纪疆,高明华,等. 近30年伊宁县气候变化规律及其对冰葡萄种植可行性的影响[J]. 江苏农业科学,2021,49(15):136-142.
[12]王 芳,王 淇,赵曦阳. 低温胁迫下植物的表型及生理响应机制研究进展[J]. 分子植物育种,2019,17(15):5144-5153.
[13]郁万文,曹福亮,汪贵斌.低温胁迫下银杏活性氧代谢与膜伤害的关系[J]. 东北林业大学学报,2010,38(7):46-48.
[14]丁红映,王 明,谢 洁,等. 植物低温胁迫响应及研究方法进展[J]. 江苏农业科学,2019,47(14):31-36.
[15]雷雪峰,马爱生,李海翠,等. 8种禾本科牧草低温胁迫的生理响应及抗寒性比较[J]. 江苏农业科学,2019,47(9):218-222.
[16]Tan D X,Manchester L C,Reiter R J,et al. Significance of melatonin in antioxidative defense system:reactions and products[J]. Neurosignals,2000,9(3/4):137-159.
[17]Potters G,Horemans N,Bellone S,et al. Dehydroascorbate influences the plant cell cycle through a glutathione-independent reduction mechanism[J]. Plant Physiology,2004,134(4):1479-1487.
[18]吴锦程,梁 杰,陈建琴,等. GSH对低温胁迫下枇杷幼果叶绿体AsA-GSH循环代谢的影响[J]. 林业科学,2009,45(11):15-19.
[19]Wu X X,He J E,Ding H D,et al. Modulation of zinc-induced oxidative damage in Solanum melongena by 6-benzylaminopurine involves ascorbate-glutathione cycle metabolism[J]. Environmental and Experimental Botany,2015,116:1-11.
[20]韩 敏,曹逼力,刘树森,等. 低温胁迫下番茄幼苗根穗互作对其抗坏血酸-谷胱甘肽循環的影响[J]. 园艺学报,2019,46(1):65-73.
[21]Nahar K,Hasanuzzaman M,Alam M M,et al. Exogenous spermidine alleviates low temperature injury in mung bean (Vigna radiata L.) seedlings by modulating ascorbate-glutathione and glyoxalase pathway[J]. International Journal of Molecular Sciences,2015,16(12):30117-30132.

