复方丹参片含量测定与化学模式识别研究
崔新刚 王颖莹 王新胜
【摘 要】 目的:通过化学模式识别研究,评价复方丹参片的质量。方法:采用HPLC法对复方丹参片中丹参酮IIA、丹酚酸B、三七皂苷Rg1、人参皂苷Rb1、三七皂苷R1及人参皂苷Re进行含量测定,结合聚类分析、主成分分析及正交偏最小二乘判别分析对复方丹参片质量进行评价。结果:主成分分析和聚类分析结果基本一致,正交偏最小二乘判别分析法结果表明不同厂家复方丹参片的指标成分含量存在差异。结论:化学模式识别为不同厂家复方丹参片的质量控制提供参考。
【关键词】 HPLC;指标成分;化学模式识别
【中图分类号】R284.3 【文献标志码】 A 【文章编号】1007-8517(2021)21-0062-05
Chemical Component Analysis and Chemical Pattern Recognition from Compound Danshen Tablet
CUI Xingang1 WANG Yingying2 WANG Xinsheng3
1.Luoyang Maternal and Child Health Hospital,Luoyang 471023,China;2.School of Chemical Engineering and Pharmaceuticals, Henan University of Science and Technology, Luoyang 471023,China;3.Luoyang Food and Drug Inspection Institute,Luoyang 471023,China
Abstract:Objective The quality of compound Danshen tablets from different manufacturers was evaluated using chemical pattern recognition.Methods The contents of tanshinone IIA, salvianolic acid B, and panax notoginseng saponins were determined using HPLC method. Principal components analysis, cluster analysis and orthogonal partial least square-discriminate analysis were performed using IBM SPSS 18.0 Statistics software and SIMCA-P 14.5 software.Results The results of principal components analysis and cluster analysis showed that the samples from the same manufacturer could be clustered into one category. The results of orthogonal partial least square-discriminate analysis showed the contents of index compounds were different from different manufacturers.Conclusions The results of chemical pattern recognition can offer reference for quality control of compound Danshen tablet.
Key words:HPLC;Index Component;Chemical Pattern Recognition
复方丹参片系由丹参、三七、冰片组成的中药复方制剂,具有活血化瘀、理气止痛作用,为《中国药典》2015版收载的成方制剂[1]。主治气滞血瘀所致的胸痹,症见胸闷、心前区刺痛;冠心病心绞痛[2]。我国有数家药厂的复方丹参片投放市场,但临床反映不同厂家复方丹参片的疗效存在明显差异。化学成分研究[3-4]显示,不同厂家复方丹参片中有效成分含量差异显著。为了评价不同厂家复方丹参片的质量差异,陈永等[5]测定三七中三七皂苷R1、人参皂苷Rg1、人参皂苷Re和人参皂苷Rb1的含量,评价复方丹参片质量。马启武[6]测定复方丹参片中丹参酮IIA、丹酚酸B的含量,比较其质量差异。现有报道中提到的评价方法常以其中一味药评价其质量,通常为方中的君药或臣药,不能全面反映其质量差异。本研究参考《中国药典》2015年版中对复方丹参片的检测方法,在《中国药典》检测方法的基础上对检测条件进行了优化,将丹参酮IIA、丹酚酸B及三七总皂苷含量作为质量评价指标。为了更好的综合比较、评价不同厂家复方丹参片的質量,本研究以复方丹参片中丹参酮IIA、丹酚酸B、人参皂苷Rg1、人参皂苷Rb1、三七皂苷R1及人参皂苷Re为指标,进行聚类分析、主成分分析和正交偏最小二乘判别分析,旨在为其质量控制提供依据和参考。
1 仪器与材料
1.1 仪器 Agilent1200型高效液相色谱仪(包括G1315B型二极管阵列检测器、自动进样器,美国安捷伦科技有限公司);KQ-100ES超声波清洗器(昆山市超声仪器有限公司);赛多利斯BSA8201电子天平(赛多利斯科学仪器(北京)有限公司);易普易达Smart-S2型超纯水机(南京易普易达科技发展有限公司)。
1.2 药品与试剂 丹参酮ⅡA(批号:110766-201816)、丹酚酸B(批号:111562-201702)、人参皂苷Rg1(批号:l10703-201728)、人参皂苷Rb1(批号:110704-201722)、三七皂苷R1(批号:110745-201614)、人参皂苷Re(批号:110754-201823)等对照品均购自中国食品药品检定研究院。样品分别购于不同厂家共10批次,每个厂家购买2个批次,分别为北京A公司(批号:20190933;20190331,编号S1、S2)、广州的B公司(批号:L18A011;L18A017,编号S3、S4)、云南C公司(批号:201811;201910,编号S5、S6)、湖北D公司(批号:20190910;20190814,编号S7、S8)、上海的E公司(批号:201906107;201811027,编号S9、S10)。甲醇、乙腈为色谱纯(天津天津市科密欧化学试剂有限公司);甲酸为分析纯(国药集团化学试剂有限公司)。
2 方法与结果
2.1 丹参酮ⅡA的含量测定
2.1.1 色谱条件 色谱柱:Sysmetry C18色谱柱(250 mm×4.6 mm,5 μm);柱温:25 ℃;流速:1.0 mL/min;流动相:甲醇-水(73∶27);进样量:10 μL;检测波长:270 nm。
2.1.2 对照品制备 精密称取丹参IIA对照品适量,置于棕色量瓶中,加甲醇制成每1 mL含对照品40 μg的溶液,即得对照品溶液。
2.1.3 供试品制备 取本品10片,糖衣片需先除去糖衣,精密称定,研细粉,取约1 g细粉,置于具塞棕色瓶中,精密加入甲醇25 mL,密塞,称定重量。将所制得供试品溶液进行超声处理(功率250 W,频率33 kHz)15min,放冷,再次称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液,置棕色瓶中,即得供试品溶液。
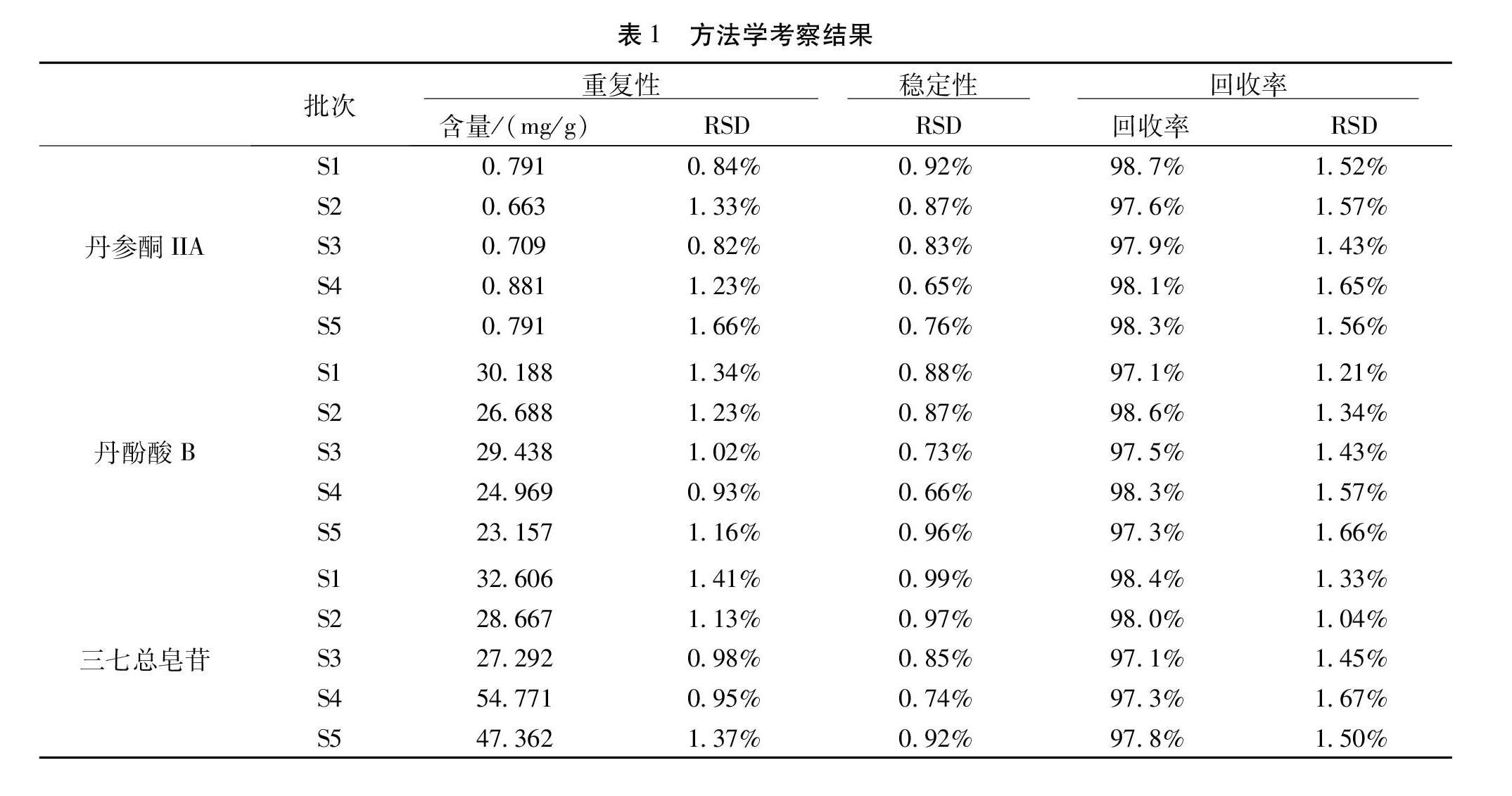
2.1.4 方法学考察[1]2.1.4.1 重复性试验 取复方丹参片(批号:20190933、L18A011、201811、20190910、201906107,即S1、S3、S5、S7、S9)按供试品溶液的制备方法分别平行制备6份供试品溶液,按2.1.1色谱条件检测丹参酮IIA的平均含量,结果见表1,表明本方法重复性良好,精密度较高。
2.1.4.2 稳定性试验 取复方丹参片(批号: 2019 0933、L18A011、201811、20190910、201906107)供试品溶液,按本试验色谱条件分别于0、2、4、6、8 h进行检测,计算丹参酮IIA峰面积RSD,结果见表1,表明本方法稳定性良好。
2.1.4.3 加样回收率试验 取已知含量复方丹参片样品(批号:20190933、L18A011、201811、20190910、201906107),分别加入一定量的对照品溶液后,测定含量,计算回收率,结果见表1,回收率良好。
2.1.5 样品测定 按2.1.3制备样品溶液,精密吸取样品溶液和对照品溶液各10 μL,按2.1.1色谱条件,分别测定10个样品中的丹参酮IIA,以外标法计算含量。色谱图如图1所示,测定结果见表1。
2.2 丹酚酸B的含量测定
2.2.1 色谱条件 色谱柱:Sysmetry C18 色谱柱(250 mm×4.6 mm,5 μm);柱温:25 ℃;流速:1.0 mL/min;流动相:乙腈-甲醇-甲酸-水(10∶30∶1∶59);进样量:10 μL;检测波长:286 nm。
2.2.2 对照品制备 精密称取丹酚酸B对照品适量,置于棕色量瓶中,加水制成每1 mL含对照品60 μg的溶液,即得对照品溶液。
2.2.3 供试品制备 取本品10片,糖衣片需先除去糖衣,精密称定,研细粉,取0.15 g细粉,置于50 mL棕色量瓶中,加水适量,将所制得供试品溶液进行超声处理(功率300 W,频率50 kHz)30min,放冷,加水至刻度,摇匀,离心机离心,取上清液,即得供试品溶液。
2.2.4 方法学考察 按照2.1.4.方法,结果见表1,表明本方法重复性良好,精密度较高,稳定性良好,回收率良好。
2.2.5 样品测定 按2.1.4样品测定方法。色谱图如图2所示,测定结果见表1。
2.3 三七总皂苷的含量测定
2.3.1 色谱条件 色谱柱:Sysmetry C18 色谱柱(250 mm×4.6 mm,5 μm);柱温:25 ℃;流速:1.0 mL/min;流动相:以乙腈为流动相A,以水为流动相B,按规定条件进行梯度洗脱,详见表2;进样量:10 μL;检测波长:203 nm。
2.3.2 对照品制备 精密称取人参皂苷Rg1对照品、人参皂苷Rb1对照品、三七皂苷R1对照品及人参皂苷Re对照品适量,加70%甲醇制成每1 mL含人参皂苷Rg1及人参皂苷Rb1各0.2 mg,三七皂苷R1及人参皂苷Re各0.05 mg的混合溶液,即得对照品溶液。
2.3.3 供试品制备 取本品10片,除去包衣,精密称定,研细粉,取约1 g,精密称定,精密加入70%甲醇50 mL,称定重量,将所制得供试品溶液进行超声处理(功率250 W,频率33 kHz)30min,放冷,再称定重量,用70%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得供试品溶液。
2.3.4 方法学考察 按照2.1.4.方法,结果见表1,表明本方法重复性良好,精密度较高,稳定性良好,回收率良好。
2.3.5 样品测定 分别精密吸取对照品溶液与供试品溶液各20 μL,注入液相色谱仪,测定。色谱图如图3所示,测定结果见表1。
2.4 主成分分析 以10批复方丹参片中的指标成分含量测定结果为变量,运用SPSS Statistics 18.0软进行主成分分析,计算成分特征值、贡献率及累计贡献率,前2个主成分累计贡献率为96.692%,可以反映复方丹参片质量,结果见表3。将10批复方丹参片中指标成分含量结果导入SIMCA-P 14.5软件,得分矩阵图如图4所示。S1-2为一类,S3-6为一类,S7-10为一类。
2.5 聚类分析 以复方丹参片的指标成分含量结果为变量,运用SPSS Statistics 18.0统计软件,采用组间连接法,以欧式平方距离为度量标准进行系统聚类分析,结果如图5所示。由图可知在组间距为25时,10批样品分为3类,S1-2为一类,S3-6为一类,S7-10为一类,该结果与主成分分析结果一致。
2.6 正交偏最小二乘判别分析 以含量测定结果为变量,导入SIMCA-P1 14.5软件,进行正交偏最小二乘判别分析,模型参数为R2X为1,R2Y为0.892,Q2为0.312,说明矩阵良好,得分矩阵图如图6所示。分类结果与主成分分析、聚类分析结果一致。以VIP值大于1位标准,筛选得到指标成分三七皂苷R1、丹酚酸B和人参皂苷Re为复方丹参片的差异组分。见表4。
3 讨论
复方丹参片为中药复方制剂,是常用临床药。由表1可知,不同厂家生产的复方丹参片都符合《中国药典》2015版标准,每片含丹参酮ⅡA不得少于0.20 mg,丹酚酸B不得少于5.0 mg,人参皂苷Rg1、人参皂苷 Rb1、三七皂苷R1及人参皂苷Re的总量不得少于6.0 mg。但主成分分析和聚类分析结果表明,不同厂家生产的复方丹参片间存在一定的差异,正交偏最小二乘判别分析结果表明三七皂苷R1、丹酚酸B和人参皂苷Re是控制复方丹参片的关键成分。
基于主成分分析和聚类分析结果,同一厂家不同批次的样品聚为一类,说明同一厂家化学组分差异较小,质量较稳定。由图4-5可知,不同厂家如两个厂家编号S3-4与S5-6,厂家S7-8与厂家S9-10复方丹参片聚为一类,结果表明这些生产厂家可能在原料来源和生产工艺具有类似之处[7]。本研究获得的结果为复方丹参片的质量控制提供依据。
参考文献
[1]中国药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2015:1214.
[2]刘天云,杨晓静,刘明华,等. 不同厂家复方丹参片中三七皂苷类成分含量测定及其高效液相特征图谱[J]. 中国医药药学杂志, 2011, 31(19): 1645-1647.
[3]廖晓虎,潘其麟,王晓晓,等. 基于一测多评法的复方丹参片质量评价研究[J]. 亚太传统医药,2019, 15(11): 46-53.
[4]黃琳,姚小华,林青,等. 复方丹参片指纹图谱研究[J]. 现代中药研究与实践,2012, 26(4): 66-69.
[5]张永,陈旭,丁越,等. HPLC 法结合统计学方法研究复方丹参片中皂苷类成分[J]. 辽宁中医杂志,2019, 46(1): 120-123.
[6]马启武. 不同厂家生产的复方丹参片指标成分的含量比较[J]. 首都医药,2013(4): 63-64.
[7]徐显春,杨天府. 聚类分析在中医药研究中的应用及意义[J].内蒙古中医药,2014,33(35):148-152.
(收稿日期:2021-03-22 编辑:陶希睿)

