4-羟基苯乙酸对M1型巨噬细胞极化及巨噬细胞泡沫化的影响
杨宇哲 李桐云 李 武 杨瑞丽
(1. 华南农业大学食品学院,广东 广州 510642; 2. 海南大学食品科学与工程学院,海南 海口 570228)
动脉粥样硬化(atherosclerosis,AS) 是心脑血管疾病的重要病程之一,慢性炎症及胆固醇代谢异常是动脉粥样硬化最危险的因素[1-2]。巨噬细胞是一类具有高度异质性的细胞群,在促炎的微环境下,巨噬细胞极化成M1型,显著上调肿瘤坏死因子(TNF)-α、白介素(IL)-1β和IL-6等细胞因子的基因表达和分泌量,促进炎症及动脉粥样硬化的发生和发展[3-5]。此外,巨噬细胞转化为泡沫细胞是动脉粥样硬化发展过程中的关键性步骤[6],而这主要与细胞内脂质代谢异常密切相关。研究[7]发现,氧化低密度脂蛋白(ox-LDL) 等胆固醇经白细胞分化抗原36(CD36)摄取,在巨噬细胞内转变成胆固醇酯并大量蓄积,巨噬细胞转化为泡沫细胞。三磷酸腺苷结合盒转运体A1(ABCA1)、三磷酸腺苷结合盒转运体G1(ABCG1)等膜转运蛋白介导巨噬细胞内游离胆固醇流出[8-9],维持细胞内胆固醇平衡,进而抑制泡沫细胞形成。抑制M1型巨噬细胞的大量聚集和泡沫细胞的形成,对于预防AS的发生和发展具有重要意义。
多酚类物质具有抗氧化、降血脂、改善心脑血管疾病等活性[10-11],但是多酚的生物利用率极低,超过95%的膳食多酚不能被小肠吸收[12-13],而通过结肠微生物代谢转化成其他小分子物质再吸收进入人体发挥生物活性作用,例如鞣花酸和鞣花单宁被肠道菌群转化生成的尿石素类物质[14],大豆异黄酮被肠道菌群转化生成雌马酚[15]。已有研究证明,4-羟基苯乙酸(4-hydroxyphenylacetic acid,4-HPAA)是原花青素、山奈酚等多酚类物质的主要肠道菌群代谢物[16-18],且4-HPAA能提高小鼠抗氧化酶和肝脏Ⅱ相代谢酶活力进而预防肝损伤[19]。目前,尚未见4-HPAA对M1型巨噬细胞极化以及对巨噬细胞泡沫样化的研究报道。试验拟探究4-HPPA对M1型巨噬细胞极化过程的作用,并初步研究其对巨噬—泡沫细胞形成的影响,从而探讨多酚肠道菌群代谢物4-HHPA抗动脉硬化的作用,以期为多酚预防和改善动脉粥样硬化作用提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
RAW264.7小鼠巨噬细胞系:广州中医药大学;
4-羟基苯乙酸、脂多糖、干扰素:美国Sigma公司;
氧化低密度脂蛋白:广州弈元生物技术有限公司;
油红O:美国Gibico公司;
TNF-α、IL-6 和IL-1βELISA试剂盒:美国R&D System公司;
总胆固醇、游离胆固醇试剂盒:北京普利莱生物技术有限公司;
DMEM培养基:美国Gibico公司;
细胞总RNA提取试剂盒、Synthesis Super Mix for q PCR、Trans Start Tip Green q PCR Super Mix:北京全式金生物技术有限公司。
1.1.2 主要仪器设备
多功能酶标仪:MultiskanMk3型,美国ThermoFisher公司;
荧光定量PCR仪:CFX96型,美国Bio Rad公司;
CO2细胞培养箱:TC-2323型,美国Shldon公司;
光学显微镜:IX71型,日本Olympus公司。
1.2 方法
1.2.1 4-羟基苯乙酸对RAW264.7细胞活力的影响 采用CCK-8法。收集对数生长期的 RAW264.7细胞并制成细胞悬液,调整细胞密度为5×104mL-1,以100 μL/孔接种于96孔板,待细胞完全贴壁后,弃去培养液。细胞分为空白组(0.1% DMSO无血清培养液),不含细胞的培养液为对照组,以及6.25,12.50,25.00,50.00 μg/mL 4-HPAA 的试验组,每组设置4个复孔,继续培养24 h后,分别加入10 μL的CCK-8溶液,37 ℃孵育1 h。于微量振荡器上振荡5 min,用酶联免疫检测仪检测各孔OD450 nm值,记录数值。按式(1)计算细胞存活的百分数。
(1)
式中:
C——细胞存活率,%;
A1——试验组吸光度;
A0——空白组吸光度;
A2——对照组吸光度。
1.2.2 RAW264.7细胞M1极化模型的建立与试验分组
将对数生长期的RAW264.7以 1×105个/mL接种于6孔板中,待细胞密度达到35%~50%时分为以下3组:空白对照组加入无血清培养液;模型组加入LPS(100 ng/mL)和 IFN-γ(20 ng/mL),诱导M1型巨噬细胞的形成;干预组加入LPS(100 ng/mL)和 IFN-γ(20 ng/mL),同时加入终质量浓度为6.25或12.50 μg/mL 的4-HPAA干预,于37 ℃,5% CO2的培养箱中孵育24 h后进行后续检测。
1.2.3 巨噬细胞源性泡沫细胞模型的建立与试验分组
收集对数生长期的RAW264.7细胞,制成细胞悬液,调整细胞密度为5×106mL-1,以2 mL/孔接种于放有无菌细胞爬片的6孔板中。待细胞完全贴壁后,弃去培养液,用无血清培养基饥饿培养24 h后分为以下3组:对照组加入无血清培养液;模型组加入80 μg/mL的ox-LDL,诱导细胞摄入脂质形成泡沫细胞;干预组加入80 μg/mL的ox-LDL,同时加入终质量浓度为6.25或12.50 μg/mL的4-HPAA干预,孵育24 h后进行后续检测。
1.2.4 炎症因子的分泌检测 采用ELISA法。干预结束后收集细胞上清液,5 000 r/min离心20 min,吸取上清液,使用相应的ELISA检测试剂盒检测TNF-α、IL-6和IL-1β蛋白的水平。
1.2.5 油红O染色 将细胞接种于铺有盖玻片的6孔板中,给药24 h后,移除培养基,PBS 冲洗3次,10%甲醛溶液固定3 h,PBS清洗一次,60%异丙醇放置30 s。吸去异丙醇溶液,加入2 mL 0.5%油红O异丙醇溶液并于60 ℃烘箱中染色30 min。60%异丙醇清洗30 s,蒸馏水清洗3次。苏木素染色5 min,蒸馏水洗5 min。1%盐酸—乙醇分色30 s,PBS返蓝10~15 min。用10 μL 50%甘油水溶液封片,光学显微镜下观察。
1.2.6 巨噬细胞源性泡沫细胞胆固醇酯含量的测定 弃去培养液的细胞用PBS清洗2遍,每孔加入100 μL 1% TritonX-100裂解液,4 ℃裂解30 min,参照试剂盒步骤测定总胆固醇和游离胆固醇含量,胆固醇酯含量为总胆固醇和游离胆固醇的差值。采用BCA试剂盒测定细胞内蛋白含量。
1.2.7 基因表达水平测定 RAW264.7巨噬细胞按1.2.2和1.2.3造模和分组作用24 h后,倾去培养液,用预冷的PBS洗3次,Trizol试剂提取细胞总RNA,用Takara逆转录试剂盒进行逆转录反应cDNA,并采用实时荧光定量PCR仪检测基因(IL-6、TNF-α、IL-1β、ABCA1、ABCG1和CD36)的表达量。实时荧光定量PCR条件为95.0 ℃预变性5 min;95.0 ℃变性30 s,60.0 ℃ 退火30 s,72.0 ℃延伸1 min,30个循环,每个循环结束前系统自动检测荧光产物的量,所有循环结束后,绘制溶解曲线以判断扩增产物的特异性。以β-actin作为内参,采用2-ΔΔCt法分析基因的相对表达量。引物由广州锐博生物科技公司设计并合成(见表1)。

表1 RT-PCR检测引物Table 1 Primer name and sequence
1.3 数据分析
结果以mean±SD表示(n=4)。采用SPSS 22.0软件,单因素分析方法(ANOVA)进行显著性分析,字母不同表示差异显著(P<0.05)。
2 结果与分析
2.1 4-HPAA对RAW264.7细胞活力的影响
由图1可知,当4-HPAA和细胞共同培养24 h时,浓度为6.25~100.00 μg/mL的4-HPAA对细胞活性无显著影响,巨噬细胞存活率均在95%以上。

图1 4-HPAA对细胞活力的影响Figure 1 Effect of 4-HPAA on RAW264.7 viability
2.2 4-HPAA对M1型极化巨噬细胞分泌炎症细胞因子的影响
巨噬细胞向M1型极化后会分泌大量炎症细胞因子。由表2可知,与对照组相比,M1型极化巨噬细胞模型组炎症细胞因子TNF-α、IL-6和IL-1β的分泌量均显著升高(P<0.05),表明M1型极化模型建立成功。与模型组相比,4-HPAA显著降低了炎症细胞因子的分泌水平(P<0.05),其中当浓度为12.50 μg/mL时,4-HPAA组的TNF-α、IL-6和IL-1β分泌量分别降低为M1型极化巨噬细胞模型组的60.78%,38.03%,39.35%(P<0.05)。原花青素[20]、山奈酚[21]、榴莲壳多酚[22]等多酚类化合物具有抗炎症作用,其肠道菌群代谢物4-HPAA可能在其中发挥了重要作用。

表2 4-HPAA对 M1型极化巨噬细胞分泌的炎症因子的影响
2.3 4-HPAA对M1型极化巨噬细胞相关标志基因表达的影响
由图2可知,与空白组相比,M1型极化巨噬细胞模型组的TNF-α、IL-6和IL-1β3种极化相关标志基因mRNA的表达量显著升高(P<0.05);加入4-羟基苯乙酸干预后,与M1型极化组相比,TNF-α、IL-6和IL-1βmRNA的表达量均显著降低(P<0.05),其降低程度与4-HPAA 浓度呈正相关。说明4-HPAA干预后可抑制LPS和IFN-γ诱导的巨噬细胞向M1型极化。韩淇安等[23]发现鞣花酸的肠道菌群代谢产物尿石素A能抑制LPS诱导的巨噬细胞向M1型极化。表明肠道菌群代谢物抑制巨噬细胞向促炎的M1型极化可能在多酚预防和改善动脉粥样硬化发生发展的过程中起到了重要作用。
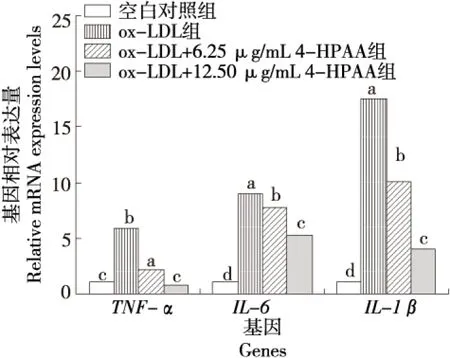
图2 4-HPAA对M1型极化巨噬细胞相关标志基因表达的影响Figure 2 Effect of 4-HPAA on M1 macrophage signature gene expression
2.4 4-HPAA对RAW264.7细胞内脂质蓄积的影响
由图3可知,对照组细胞内未见染红的脂滴,巨噬细胞被80 μg/mL的ox-LDL孵育24 h后,细胞数量减少,胞体内有大量的脂滴排列在细胞膜内侧,有少量细胞破裂且脂滴外溢,细胞泡沫化现象严重。与泡沫细胞模型组比较,不同浓度的4-HPAA干预均能显著降低细胞染红程度,高浓度组抑制细胞内脂质蓄积的效果显著高于低浓度组。原花青素[24]、山奈酚[25]、石榴皮多酚[26]等多酚类化合物具有抑制ox-LDL诱导的巨噬细胞脂质蓄积的作用,改善脂质代谢异常是多酚防治动脉粥样硬化的机制之一。

1. 对照组 2. ox-LDL泡沫细胞模型组 3. ox-LDL+6.25 μg/mL 4-HPAA组 4. ox-LDL+12.50 μg/mL 4-HPAA 组
2.5 4-HPAA对RAW264.7细胞胆固醇含量的影响
由图4可知,与对照组相比,80 μg/mL的ox-LDL处理巨噬细胞24 h后,巨噬细胞内胆固醇酯含量显著升高(P<0.05);与空白对照组相比,泡沫细胞模型组胆固醇酯含量显著升高(P<0.05);与模型组比较,4-HPAA显著降低了巨噬细胞内胆固醇酯含量,且随着4-HPAA浓度的增加,其降低作用更明显(P<0.05),其中12.50 μg/mL 4-HPAA组的胆固醇酯含量降低至泡沫细胞模型组47.30%。与模型组相比,4-HPAA组细胞内游离胆固醇含量有所降低,但无显著性差异,表明巨噬细胞源性泡沫细胞中聚集的脂质以胆固醇酯为主,当胆固醇酯含量超过50%时,巨噬细胞成为泡沫细胞[27],4-HPAA主要通过降低细胞内胆固醇酯的聚集进而抑制泡沫细胞的形成。
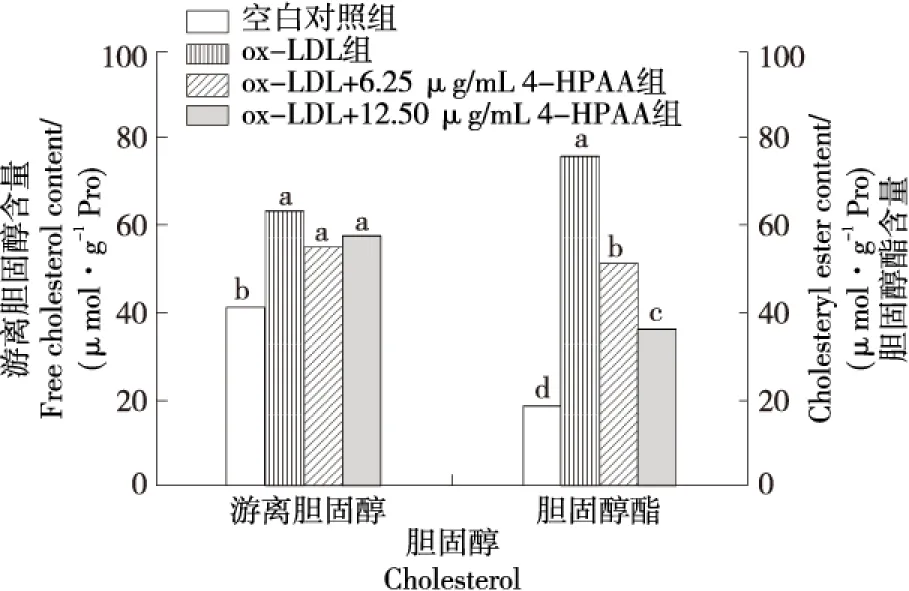
图4 4-HPAA对ox-LDL诱导的巨噬细胞胆固醇含量的影响
2.6 4-HPAA对RAW264.7细胞胆固醇代谢相关基因表达的影响
由图5可知,各组ABCA1表达无显著变化,与泡沫细胞模型组相比,4-HPAA显著上调ABCG1基因表达水平,显著下调CD36基因表达水平。4-羟基苯乙酸通过下调巨噬细胞的CD36和上调ABCG1基因表达,降低细胞内胆固醇摄入并增加胆固醇的流出,减少巨噬细胞内脂质的蓄积,抑制巨噬细胞向泡沫细胞的转化[28]。石榴皮等多酚提取物[29]通过提高ABCA1和/或ABCG1的表达引起的胆固醇流出增加,进而抑制ox-LDL诱导的巨噬细胞泡沫化。

图5 4-HPAA对巨噬—泡沫细胞胆固醇转运相关基因表达的影响
3 结论
试验以多酚肠道菌群代谢物4-羟基苯乙酸为对象,探讨其对M1型巨噬细胞极化及巨噬细胞泡沫化的影响及相关机制。结果表明,4-羟基苯乙酸通过下调M1型巨噬细胞标志基因TNF-α、IL-6和IL-1β的表达,降低炎症细胞因子TNF-α、IL-6和IL-1β的分泌,抑制RAW264.7小鼠巨噬细胞向促炎的M1型巨噬细胞极化;油红O染色发现4-HPAA能显著抑制ox-LDL诱导巨噬—泡沫细胞形成,并显著降低胆固醇酯含量(P<0.05);实时荧光定量聚合酶链式反应检测表明4-HPAA能显著上调三磷酸腺苷结合盒转运蛋白G1、下调CD36基因的表达。说明4-羟基苯乙酸能抑制巨噬细胞向M1型极化,同时能够抑制巨噬—泡沫细胞形成。由于多酚具有相对较低的生物利用度,说明其肠道菌群代谢物可能在其改善动脉粥样硬化的过程中发挥着重要的作用,肠道菌群代谢物4-羟基苯乙酸的生物利用度、效应部位和分子机制等还有待于进一步研究。

