MUC1-GEM-PBCA-NP、CA199-GEM-PBCA-NP静注对裸鼠胰腺癌种植瘤的抑制作用对比观察
张林,侯艳红,李春梅,刘浩润
中国人民解放军总医院第八医学中心,北京 100091
近年胰腺癌发病率及病死率呈快速上升趋势[1],加之治疗效果差,临床5年生存率在各种恶性肿瘤中最低,急需治疗效果更好且毒性更小的治疗方法。随着分子靶向治疗的迅速兴起,目前部分分子靶向治疗的效果颠覆了人类过去的认知,针对胰腺癌的分子靶向治疗研究也成为了新的热点。我们前期研究显示[2-3],表面偶联抗表皮生长因子受体单克隆抗体以及黏性蛋白1(MUC1)单抗的载吉西他滨聚氰基丙烯酸正丁酯纳米粒对裸鼠胰腺癌种植瘤均有一定的靶向性和抑瘤作用。糖类抗原199(CA199)是目前针对胰腺癌特异性最好的血清肿瘤标志物,国内外已广泛应用于临床检测、预后判断[4-5],也有研究将其作为治疗的靶向分子进行实验。CA199本身就是由MUC1分子部分糖蛋白变异形成的,其中一些脱落入血,便可在血清中检测到而成为肿瘤标志抗原[6]。胰腺癌患者血清CA199升高明显,且随病情变化而发生变化,提示CA199可能成为治疗的靶标。2019年8—11月,我们将MUC1与CA199单克隆抗体偶联吉西他滨聚氰基丙烯酸正丁酯纳米粒(MUC1-GEM-PBCA-NP、CA199-GEM-PBCA-NP)注入胰腺癌种植瘤裸鼠体内,比较两者抑制胰腺癌种植瘤的作用,旨在比较MUC1和CA199单克隆抗体修饰载药纳米粒的再导向治疗作用强弱。
1 材料与方法
1.1 实验动物 BALB/c裸鼠65只,雌性,6~8周龄,体质量18~22 g。动物实验于中国人民解放军总医院第八医学中心动物实验室进行,实验条件:实验室温度(22~25)℃,相对湿度40%~70%RH,相对空气压力10~20 Pa,空气交换频率10~15次/小时,备有中央空调和空气过滤机械设备,动物笼具、饮水、垫料、饮用水等均经高压蒸汽消毒,每笼3只鼠,饲以SPF级专用颗粒饲料,自由饮水。
1.2 抗体、试剂及仪器 MUC1单克隆抗体(Abnova公司),CA199单克隆抗体(Abcam公司),α-氰基丙烯酸正丁酯(BCA,北京瞬康医用胶有限公司);人胰腺癌细胞株PANC-1(北京富众科技发展有限公司),细胞培养于含胎牛血清、青霉素、链霉素的DMEM培养液中;85-2恒温加热磁力搅拌器(上海志威电器有限公司),Dextran-70、PluronicF-127(德国BASF公司),吲哚菁绿(Cy3,上海晶纯生化科技股份有限公司),微孔滤膜(欣惠泽奥有限公司),Zetasizer-Nano ZS90型激光粒径分析仪(英国马尔文公司),IX71荧光显微镜(日本Olympus公司)。
1.3 CA199-GEM-PBCA-NP、MUC1-GEM-PBCA-NP及相应荧光纳米粒子的制备 GEM-PBCA-NP的具体制备方法参考本研究组李春梅等[3]的实验方法。制备完成后用激光散射粒度分析仪来观察微球粒径的大小及分布,并计算包封率及载药率。荧光纳米粒子的制备同样参考本研究组李春梅等[3]的实验方法:灭菌水溶解Dxtran-70、PluronicF-127及Cy3作为水相,余制备方式同GEM-PBCA-NP的制备,制备备用含荧光Cy3-PBCA-NP(0.5 mg/mL),抗MUC1及抗修饰的荧光纳米粒方式同MUC1-GEM-PBCA-NP的制备。按前述方法所得到的纳米粒电镜下观察形态表现为光滑的球形,药物均匀地分散在聚合物基质中。GEM-PBCA-NP、MUC1-GEM-PBCA-NP和CA199-GEM-PBCA-NP纳米粒的平均尺寸分别为(48.80±5.64)、(56.37±5.66)、(57.25±5.81)nm。GEM的包封率和载药量在GEM-PBCA-NP、MUC1-GEM-PBCA-NP、CA199-GEM-PBCA-NP纳米粒分别为47.35%±5.14%、46.22%±4.13%、45.57%±4.96%,8.15%±0.84%、6.96%±0.76%、7.05%±0.69%,表面修饰后纳米粒子并无明显变化。成功制备了MUC1-GEM-PBCA-NP和CA199-GEM-PBCA-NP靶向载药纳米粒子。
1.4 裸鼠胰腺癌种植瘤模型制备 参照李春梅等[3]的方法,取对数生长期的人胰腺癌细胞系PANC-1细胞,PBS洗涤3次,重悬于PBS中并调整浓度为6×107/mL。于每只裸鼠右侧腋部皮下注射0.2 mL细胞悬液,观察成瘤情况。7~10 d成瘤(瘤体直径>0.5 cm为制备成功的标准),分组治疗前统一建模,建模不成功者直接剔除。制备成功55只裸鼠(实验分组共需51只,另4只用于抵补到出现观察期中死亡及其他原因退出实验的裸鼠),而后按下述分组情况开始分组治疗。
1.5 裸鼠分组及MUC1-GEM-PBCA-NP、CA199-GEM-PBCA-NP静注方法和肿瘤体积测量、抑瘤率计算 ①肿瘤体积测量:将制模成功的裸鼠随机分为6组各7只。A组:按吉西他滨2.5 mg/kg等剂量的MUC1-GEM-PBCA-NP经尾静脉注射;B组:按吉西他滨2.5 mg/kg等剂量的CA199-GEM-PBCA-NP经尾静脉注射;C组:等量GEM-PBCA-NP经尾静脉注射;D组:吉西他滨2.5 mg/kg量经尾静脉注射;E组:等量PBCA-NP经尾静脉注射;F组:等量生理盐水经尾静脉注射为空白对照。每5 d重复治疗1次,每3 d测量每只动物肿瘤长径(a)和短径(b),肿瘤体积V=a×b2/2。②移植瘤抑瘤率计算:若实验过程中有荷瘤鼠死亡,及时估计并记录死亡时间、解剖以进行尸检。如果不能及时解剖,则先放入-20 ℃冰箱以减少组织自溶;至药物治疗开始第35 d实验终末,根据动物福利,应实行安乐死,每组7只动物均处死。剥离瘤体称重,抑瘤率=[(对照组瘤重-实验组瘤重)/对照组瘤重]×100%。
1.6 裸鼠分组及MUC1-GEM-PBCA-NP、CA199-GEM-PBCA-NP静注方法和移植瘤荧光纳米粒子分布检测 另取9只荷瘤裸鼠分为3组各3只。a组:尾静脉注射MUC1-Cy3-PBCA-NP溶液(10 mg/kg);b组:尾静脉注射CA199-Cy3-PBCA-NP溶液(10 mg/kg);c组:注射等量Cy3-PBCA-NP。于注射后5 h处死裸鼠,取肿瘤组织,用生理盐水充分冲洗避免残留血液及组织液影响荧光检测,滤纸吸干多余水分,迅速放入液氮中冷冻、随后将冰冻组织切片,将组织切片贴于载玻片后,用P0126封片,置于倒置荧光显微镜下检测激发Cy3所发的荧光,软件测定荧光强度。
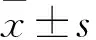
2 结果
2.1 各组肿瘤体积、抑瘤率比较 肿瘤体积、抑瘤率比较见表1。
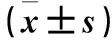
表1 各组肿瘤体积、抑瘤率比较
2.2 各组Cy3荧光信号强度比较 a、b、c三组的荧光强度分别为34.92±4.41、17.15±2.6、4.82±0.73,a组与其余两组比较,a、b组比较,P均<0.05。a组主要定为于细胞胞膜及胞质中;b组Cy3荧光信号强度弱于a组,且主要定为于细胞胞膜,胞质中荧光信号较弱;c组Cy3荧光信号微弱,仅部分细胞胞膜的可见。详见图1。

注:a为a组,b为b组,c为c组。
3 讨论
胰腺癌是目前世界范围内预后及治疗效果最差的恶性肿瘤[7-8]。尽管广大临床和医学科研工作者通过无数次的尝试改善胰腺癌患者的预后,但结果仍然令人沮丧。为了建立更有效的治疗方法,现在全世界范围内也正在进行着大量的研究[9]。随着药物治疗研究的进展,对胰腺癌治疗采用新颖的传统细胞毒性化疗的组合以及配合最新的靶向药物成为主要方向。五氟类、铂类、紫杉醇类等已经成为世界上广泛使用的细胞毒性药物用于治疗泛癌,在临床证据确定后这些药物广泛用于可切除或不能切除的胰腺癌,但目前辅助化疗效果均不佳[10-12]。在靶向药物方面,除了厄洛替尼,目前还没有针对胰腺癌的靶向治疗策略。随着近年来研究者对药物的开发,已经做出了积极的尝试,并开发出新的治疗策略,包括对可切除或边界可切除的胰腺癌患者进行新辅助化疗,多药联合治疗晚期胰腺癌患者的姑息化疗,以及新的靶向药物、载药纳米或免疫细胞治疗等多种治疗策略[13-15]。
在诸多的研究中,靶向纳米载药系统近年成为一个主要的方向,已经有多项采用纳米载药系统进行胰腺癌治疗的研究[16]。目前选择适合的靶向分子是影响治疗效果的一个关键问题,MUC1是胰腺癌靶向治疗的一个新的靶点。研究报道[17],MUC1引导的纳米粒子在胰腺癌中具有良好的再导向作用。CA199是胰腺癌最为敏感和特异的血清肿瘤标志物,与MUC1为同源蛋白。GIRGIS等[18]证实,CA199修饰的纳米粒对于胰腺癌同样具有良好的再导向作用。为进一步明确这两种分子作为靶向治疗胰腺癌纳米粒子靶标效果的差异,本研究在控制同等实验条件下进行了CA199与MUC1作为靶向分子对于胰腺癌种植瘤模型动物的抑瘤效果比较。我们制备的MUC1-GEM-PBCA-NP和CA199-GEM-PBCA-NP为粒径<100 nm的载吉西他滨微粒,前期研究[3]发现这些纳米粒已经在动物体内呈良好的组织分布。本研究显示,MUC1-GEM-PBCA-NP对于裸鼠胰腺癌种植瘤的抑制作用明显优于CA199-GEM-PBCA-NP,而CA199-GEM-PBCA-NP抑瘤效果也明显优于无靶向性的GEM-PBCA-NP和吉西他滨原料药物。这一结果也与我们前期体外细胞杀伤实验的结果相一致,表明抗MUC1与抗CA199修饰的载药纳米粒对于模型动物体内的胰腺癌细胞均具有一定的杀伤作用,可抑制瘤体生长,均可作为胰腺癌纳米药物的候选靶向分子;抗MUC1修饰的载药纳米粒对于动物体内肿瘤的抑制作用强于抗CA199,在靶向纳米粒的设计中可被优先选择。本研究中采用靶向纳米粒的荧光示踪法评估其再导向作用,抗MUC1修饰的荧光纳米粒子可较为高效的结合于种植瘤细胞的细胞膜并进入胞质中,体现了较强的荧光信号,而抗CA199修饰的荧光纳米粒子也在种植瘤细胞细胞膜上检测到一定的荧光信号,胞质中有较弱的信号,但强度显著低于抗MUC1修饰组,这一结果表明抗CA199再导向纳米粒结合到种植瘤细胞上并进入胞内发挥作用的能力较弱。可能的重要原因是由于肿瘤细胞中的CA199大量分泌入血,在血液中可与抗CA199修饰的纳米粒子结合起到了类似抗原封闭的作用,导致大量纳米粒子表面的抗CA199因结合血清游离抗原而失效,进而大大削弱了其再导向作用。
总之,抗MUC1修饰的纳米粒具有更强的再导向作用和肿瘤抑制能力。MUC1可能将是针对胰腺癌开发纳米药物的重要靶向分子。

