IGF2基因在卵巢癌组织中的表达差异分析
吴巧珠 陈凤英 孙芳

[關键词] IGF2基因;卵巢癌组织;卵巢组织;病理分级
[中图分类号] R392.11 [文献标识码] A [文章编号] 1673-9701(2021)29-0021-03
Analysis on the differential expression of IGF2 gene in ovarian cancer tissues
WU Qiaozhu1 CHEN Fengying1 SUN Fang2
1.Department of Obstetrics and Gynecology, the Eighth Affiliated Hospital of Sun Yat-sen University (Shenzhen, Futian), Shenzhen 518000, China; 2.Department of Gynecology, Shenzhen Hospital of the University of Hongkong, Shenzhen 518058, China
[Abstract] Objective To analyze the expression and changes of insulin-like growth factor 2(IGF2) gene in ovarian cancer tissues. Methods A total of 72 patients with ovarian cancer admitted to the Department of Obstetrics and Gynecology of The Eighth Affiliated Hospital of Sun Yat-sen University(Shenzhen, Futian) from February 2018 to April 2019 were selected as the study subjects. They were divided into the high expression group(n=41) and the low expression group(n=31) according to the level of the IGF2 gene expression. Meanwhile, 72 healthy women were selected as the control group during the same period. The difference between high and low expression of IGF2 in patients′ general data was analyzed, Quantitative Real-time Polymerase Chain Reaction (qRT-PCR) experiment and staining experiment. Results The qRT-PCR technique was used to detect the messenger ribonucleic acid (mRNA) expression of IGF2 gene. The detection results showed that the IGF2 gene was highly expressed in ovarian cancer tissue cells, and the level of IGF2 gene was much higher in ovarian cancer cells than that in normal ovarian tissues,the difference was statistically significant (P<0.05). The Western-blot was used to detect the IGF2 protein expression, and the detection results showed that the IGF2 protein was normally expressed in normal ovarian tissues and highly expressed in ovarian cancer tissues, the difference was statistically significant(P<0.05). Conclusion 1. The expression of IGF2 gene in ovarian cancer tissues is significantly higher than that in normal ovarian tissues and paracancerous tissues, and it is significantly correlated with the pathological grading of patients. 2. The expression of IGF2 gene is closely related to the survival time of patients with ovarian cancer, and it is an important poor prognostic factor.
[Key words] Insulin-like growth factor 2 gene; Ovarian cancer tissues; Ovarian tissues; Pathological grading
卵巢癌(Ovarian cancer,OC)是妇科最常见的恶性肿瘤,同时也是最难诊断、恶性程度高、进展快和预后差的妇科肿瘤之一,发病早期隐匿、发生进展快、病死率高,病死率占妇科恶性肿瘤约50%[1]。目前由于缺乏早期有效检测手段,大部分患者确诊时已经为中晚期[2]。因此早诊断、早治疗是促使卵巢癌患者快速康复的关键,长期临床实践发现,胰岛素样生长因子2(IGF2)在卵巢癌女性中呈现高表达,因此加强IGF2因子表达水平的检测,对早期诊断卵巢癌有较大帮助[3]。IGF2与IGF1R、IGF1、IGF2R等6个结合蛋白相辅相成,共同分布于细胞表面,构成胰岛素素样生长因子(Insulin-1ike growth factors,IGFs)。IGFs属于蛋白质复合体,其中各蛋白成分的表达在诊断各类癌症中具有标志性作用[4],IGF2的作用则是能够促进细胞分裂,因此卵巢组织中IGF的过量表达提示可能存在癌细胞[5-6]。研究[7-9]发现,IGF2在细胞增殖、分化和代谢中发挥着重要作用。鉴于此,本研究以72名正常女性、72例卵巢癌女性为对象进行分析,现报道如下。
1 资料与方法
1.1一般资料
选取2018年2月至2019年4月中山大学附属第八医院(深圳福田)妇产科收治的72例卵巢癌患者为观察组,根据其IGF2基因表达情况分为高表达组、低表达组各41例、31例,选取同期72名健康女性为对照组。对照组年龄22~65岁,平均(38.56±1.25)岁;观察组年龄23~66岁,平均(38.52±1.21)岁。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
采用qRT-PCR、Western-blot实验对IGF2表达情况进行分析,先检测其mRNA表达水平,具体方法如下。
1.2.1 提取组织标本RNA 将组织标本离体后,剪切成2 mm3左右,及时放入液氮罐保存。提取RNA前,研磨钵预冷,反复加液氮,确保其充分预冷。之后,取出样本,在预冷的研磨钵放入组织块,研磨期间适量加入液氮,确保研磨期间液氮不会挥发干。研磨组织块重量每次控制在300 mg以内。研磨为粉末后,每个研磨钵加Trizol试剂1 mL,加入后转移到新的离心管(1.5 mL)中。在离心管加入0.2 mL氯仿,震荡30 s,静置5 min。静置后放于4℃,以120 000 g离心处理15 min,将离心后液相分为3层,最下层为酚-氯仿相(红色)、最上层为无色的水相及中间层,其中RNA仅在最上层。将上层水相转移到EP管(1.5 mL,确保洁净),注入预冷的异丙醇500 μL,静置10 min,在4℃下以12 000 g离心15 min,弃去上清液。重复操作2次,在离心管加75%乙醇1 mL(经过预冷处理),轻轻洗涤混匀,于4℃下以7500 g离心5 min,弃去上清液。室温下晾干,干燥沉淀RNA,加20 μL的DEPC水溶解,促使RNA重悬,以移液器从RNA溶解液取2 μL加入干净EP管,同时加98 μL DEPC水,离心混合均匀,将DEPC水作为对照,以紫外分光光度仪检测OD值。利用电泳试验鉴定RNA质量,提取好的RNA放于-80℃保存。
1.2.2 qRT-PCR检测 选择Promega公司的荧光定量试剂盒实施定量反转录聚合酶链反应,所有操作严格按照仪器与试剂说明书执行。
1.2.3 组织标本蛋白提取与Western-blot检测 ①组织标本蛋白提取:提取前1日洗净匀浆器,放于75%乙醇浸泡,提取组织蛋白前将其自然晾干,并置于烤箱。提取前配制裂解液,现配现用,配比为RIPA:PMSF=100:1,配制完成完成安放于4℃冰块上。预冷研磨钵,反复往内加入液氮,确保充分预冷。之后取出样本,剪切为合适的组织块,将40 mg左右组织块放入预冷研磨钵实施研磨,研磨期间适当加入液氮,反复研磨,直到为粉末状。加预冷过且配置好的蛋白裂解液200 μL至冰上进行孵育,时间20 min。之后,将其转移到新的离心管,4℃下以10 000 g离心,时间15 min,上清液则转移到新的离心管处理。②Western-blot检测:将蛋白标准配制液1.2 mL转移至新的管蛋白标准中,混合均匀且充分溶解,促使其达到25 mg/mL的蛋白标准溶液。于配制好的蛋白标准中提取40 μL,稀释为0.5 mg/mL,加稀释液1960 μL。根据样品情况,10 mL BCA试剂A+200 μL BCA试剂B,按照50:1配比配制为BCA工作液,充分混合。将标准品加入96孔板标准孔,加标准品溶液后补充至20 μL,体积依次为0、1、2、4、8、12、16、20 μL。将合适体积的蛋白样品转移到96孔板,加标准品稀释到20 μL。每个测量孔加BCA工作液20 μL,放于37℃,静置30 min。利用酶标仪检测A562、540~595 nm的波长,参考标准曲线将样本蛋白濃度计算出来。
1.3 观察指标
①比较两组IGF2基因在卵巢癌组织和正常组织内的表达差异;②分析IGF2基因在高表达和低表达中的差异。
1.4 统计学方法
采用SPSS 20.0统计学软件分析数据,计量资料以均数±标准差(x±s)表示,组间比较采用t检验;计数资料以[n(%)]表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
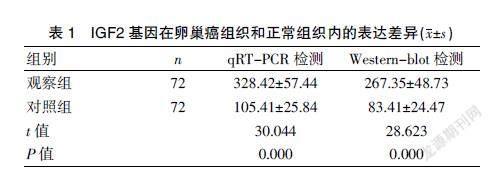
2.1 IGF2基因在卵巢癌组织和正常组织内的表达差异
IGF2基因的mRNA表达,检测方法为qRT-PCR,检测显示在卵巢癌组织细胞中的IGF2高表达,与正常卵巢组织比较,癌细胞中IGF2水平很高,差异有统计学意义(P<0.05);IGF2蛋白的表达,检测方法为Western-blot,检测显示在正常卵巢组织中IGF2蛋白表达正常,在癌细胞组织中呈现高表达,差异有统计学意义(P<0.05)。见表1。
为进一步证实IGF2在癌细胞中的表达情况,用上述两实验分别检测癌组织、癌旁组织,取组织芯片进行检测分析。结果显示,癌旁组织中IGF2表达水平稍微高于正常卵巢组织,但其表达水平明显低于癌细胞组织,比正常组织中水平高可能与癌细胞浸润有关。
2.2 IGF2蛋白高表达和低表达在卵巢癌患者临床各资料之间的差异比较
在qRT-PCR、Western-blot检测基础上,进行染色实验,分析IGF2高表达与低表达患者一般资料的差异。结果显示,两组组织学等级比较,差异有统计学意义(P<0.05),其他临床资料比较,差异无统计学意义(P>0.05)。见表2。
3讨论
卵巢癌属于妇科疾病,对女性危害较大[10],既往很多报告[11-14]显示,IGF2基因在卵巢癌组织中呈现高表达状态,且能加快细胞的有丝分裂过程,进而促使癌细胞生长速度加快。用小鼠进行实验,发现IGF2能够诱导停滞B细胞系生长[15]。也有相关文献[16]报道,结肠癌、口腔癌的生长分化与IGF2基因的表达有密切相关性。在乳腺癌、白血病患者中,IGF2蛋白表达越高,患者病情进展越快。
IGF2基因经过长期研究发现,能够作为鉴别卵巢癌患者程度及分型的重要依据,且患者预后、生存质量都与IGF2有着密切关系,相较于IGF2低表达的卵巢癌患者,IGF2高表达的卵巢癌患者的总生存期和无进展生存期都明显缩短[17]。卵巢癌患者中,癌细胞组织、癌旁组织中的IGF2基因表达有着明显差异,与癌旁组织比较,癌细胞组织中IGF2表达水平很高,说明该基因表达在癌症进展过程中起到促进作用。因此,IGF2基因表达能成为癌症进展的重要标志[18]。
本研究通过qRT-PCR和Western-blot实验分别在mRNA及蛋白水平上进行分析,发现与正常卵巢组织相比,卵巢癌组织中IGF2基因、蛋白表达均呈现出较高水平。进一步进行染色实验,分析卵巢癌组织IGF2水平表达与患者病理类型、年龄等关系,发现病理分级受IGF2水平的直接影响,然而高表达和低表达在患者年龄、病理类型、肿瘤位置和肿瘤大小之间比较,差异无统计学意义(P>0.05)。
计划在下一步的研究中,新一代的基因编辑技术-CRISPR/Cas9技术,构建敲除IGF2基因的人卵巢癌细胞,进一步研究IGF2基因对卵巢癌细胞增殖、侵袭、迁移等生物学作用的影响[19]。
卵巢癌细胞侵袭能力与IGF2表达是否存在联系,研究显示,通过Transwell实验进行验证,发现IGF2表达水平越高,癌细胞的侵袭能力越低[20]。有关IGF2基因及蛋白表达在卵巢癌患者中的情况,还需要更进一步的研究。
[参考文献]
[1] Yang J,Li Y,Yu ZC,et al. Circular RNA Circ100084 functions as sponge of miR 23a 5p to regulate IGF2 expression in hepatocellular carcinoma[J]. Molecular Medicine Reports,2020,21(6):232-235.
[2] Wang XY,Fu XR,Zhang JJ,et al. Identification and validation of m6A RNA methylation regulators with clinical prognostic value in Papillary thyroid cancer[J]. Cancer Cell International,2020,20(15):125-128.
[3] 伍昱燊. 1.成纤维细胞起源的胰岛素样生长因子2通过促进T细胞排除减弱抗肿瘤免疫的功能及机制研究 2.miRNA联合标记作为子宫内膜癌患者生存预后标志物的可行性研究[D].重庆:重庆医科大学,2020
[4] Zhang HB,Zeng Y,Li TL,et al. Correlation between polymorphisms in IGF2/H19 gene locus and epithelial ovarian cancer risk in Chinese population[J]. Genomics,2020,112(3):45-50.
[5] Wu XY,Zhou HY,Yao XM,et al. Long non-coding RNA AB073614 promotes metastasis of gastric cancer cells by upregulating IGF-2[J]. European Review for Medical and Pharmacological Sciences,2020,24(1):131-133.
[6] Lu L,Cai M,Peng M,et al.miR-491-5p functions as a tumor suppressor by targeting IGF2 in colorectal cancer[J].Cancer Management and Research,2019,11:1805-1816.
[7] Kasprzak,Adamek. Insulin-like growth factor 2(IGF2)signaling in colorectal cancer—from basic research to potential clinical applications[J]. International Journal of Molecular Sciences,2019,20(19):78.
[8] 趙欣,李季,刘环秋,等.下调胰岛素样生长因子2基因对HCT116结肠癌干细胞生物学特性的影响[J].中华肿瘤杂志,2019(8):580-586.
[9] Gao YQ,Cheng HY,Liu KF. Long non-coding RNA DANCR upregulates IGF2 expression and promotes ovarian cancer progression[J]. European Review for Medical and Pharmacological Sciences,2019,23(9):38-42.
[10] 陈勇伟,贺敏,姚启盛.胰岛素样生长因子2在膀胱癌中的表达分析[J].国际泌尿系统杂志,2019(1):27-30.
[11] 毕建朋,顾朝辉,贾占奎,等.RNA干扰靶向抑制胰岛素样生长因子2mRNA结合蛋白1基因对肾癌细胞的抑制作用及其机制[J].中华实验外科杂志,2018,35(10):1912-1914.
[12] Bharathavikru R,Hastie ND. Overgrowth syndromes and pediatric cancers:How many roads lead to IGF2?[J]. Genes & Development,2018,32(20):15-16.
[13] 冀萌萌. Igf2/H19在宫内TCDD暴露致成年大鼠卵巢功能损伤中的潜在作用机制[D].郑州:郑州大学,2018.
[14] Küffer S,Gutting T,Belharazem D,et al. Insulin-like growth factor 2 expression in prostate cancer is regulated by promoter-specific methylation[J]. Molecular Oncology,2018,12(2):10-11.
[15] Annette F. IGF2 imprinting loss promotes cancer[J]. Nature Reviews Urology,2017,14(10):22-23.
[16] 高無怨,王丽华.胰岛素样生长因子家族在子宫内膜癌中的作用[J].国际肿瘤学杂志,2017,44(10):794-797.
[17] Huang W,Li BR,Feng H. PLAG1 silencing promotes cell chemosensitivity in ovarian cancer viathe IGF2 signaling pathway[J]. International Journal of Molecular Me-dicine,2020, 45(3):12.
[18] 周楠,回丽敏,刘振兴,等.卵巢上皮性癌组织中IGF2和CD133蛋白的表达及临床意义[J].家庭医药·就医选药,2017(8):39-40.
[19] Manchanda R,Menon U. Setting the threshold for surgical prevention inwomen at increased risk of ovarian cancer[J]. International Journal of Gynecological Cancer Official Journal of the International Gynecological Cancer Society,2018, 28(1):34.
[20] 何哲锋,裴铁民,孟庆辉. IGF2BP1与肿瘤[J]. 国际肿瘤学杂志,2021,48(2):92-95.
(收稿日期:2021-04-21)

